反应工程课后习题答案
- 格式:doc
- 大小:3.19 MB
- 文档页数:120

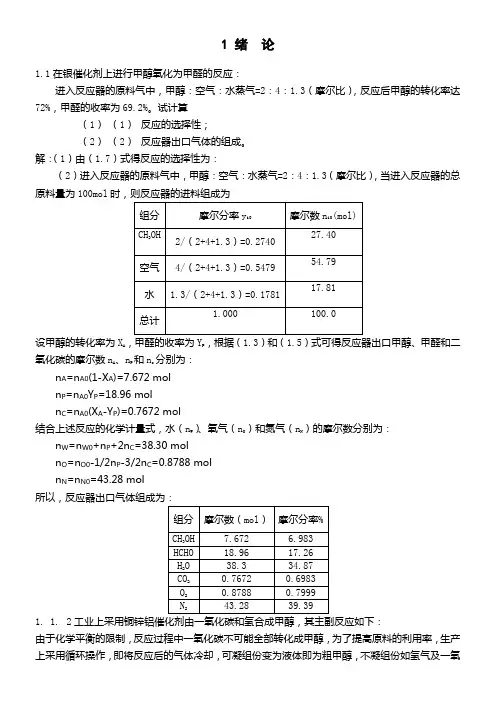
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为2由甲醇的转化率达72%2y x +=72%; 4.27x=69.2% 解得x=18.96; y=0.77 所以,反应器出口气体组成为: CH 3OH:%100221004.27⨯++--y x yx =6.983%空气:%1002210023279.54⨯++--y x y x =40.19% 水: %10022100281.17⨯++++y x y x =34.87%HCHO: %10022100⨯++y x x=17.26%CO 2: %10022100⨯++y x y=0.6983%1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体 Akmol/h原料气和冷凝分离后的气体组成如下:组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 21.460.82CH40.55 3.62N22.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。


1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol设甲醇的转化率为X A,甲醛的收率为Y P,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol所以,反应器出口气体组成为:1. 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 22.9210.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。

化学反应工程许志美课后答案第一章1、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草2、下面化合物能与异羟肟酸铁反应的是()[单选题] *A花椒内酯(正确答案)B柠檬烯C色原酮D天精3、在结晶溶剂的选择过程中首先要遵循的是()[单选题] *A成分的纯度(正确答案)B相似相容原理C冷却热饱和原理D以上都不对4、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷5、木脂素是苯丙素衍生聚合而成的天然化合物,多为()[单选题] *A二聚体(正确答案)B三聚体C四聚体D五聚体6、在溶剂提取法中,更换新鲜溶剂可以创造新的(),从而使有效成分能够继续被提取出来。
()[单选题] *A极性差B压力差C浓度差(正确答案)D体积差7、E何首乌(正确答案)下列不含蒽醌类成分的中药是()*A丹参(正确答案)B决明子C芦荟D紫草(正确答案)8、下列基团在极性吸附色谱中的被吸附作用最强的是()[单选题] *A羧基(正确答案)B羟基C氨基D醛基9、E连续回流提取法(正确答案)用乙醇作溶剂提取时,下列说法正确的是()* A对植物细胞壁穿透力强(正确答案)B溶解范围广,提取较全面(正确答案)C提取液中蛋白质、多糖等水溶性杂质少(正确答案)D有防腐作用,提取液不易发霉变质(正确答案)10、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷11、乙醇不能提取出的成分类型是()[单选题] *A生物碱B苷C多糖D鞣质(正确答案)12、碱水提取芦丁时,若PH过高会使()[单选题] * A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环13、很少含有挥发油的植物科为()[单选题] *A菊科B唇形科C茜草科(正确答案)D姜科14、挥发油常见属于哪类萜类化学物()[单选题] *A半萜与单萜B单贴与倍半萜(正确答案)C倍半萜与二萜D二萜与三萜15、与明胶反应生成沉淀的成分是()[单选题] *A强心苷B皂苷C有机酸D鞣质(正确答案)16、中药丹参中的主要有效成分属于()[单选题] *A苯醌类B萘醌类C蒽醌类D菲醌类(正确答案)17、连续回流提取法与回流提取法比较,其优越性是()[单选题] * A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大18、有机溶剂加热提取中药成分应采用()[单选题] *A回流装置(正确答案)B蒸馏装置C萃取装置D分馏装置19、大黄素型蒽醌母核上的羟基分布情况是()[单选题] * A一个苯环的β位B苯环的β位C在两个苯环的α或β位(正确答案)D一个苯环的α或β位20、下列不能作为极性吸附剂的是()[单选题] *A活性炭(正确答案)B氧化铝C硅胶D氧化镁21、区别挥发油与油脂常用的方法是()[单选题] *A相对密度B溶解性C油迹试验(正确答案)D沸点22、组成木脂素的单体基本结构是()[单选题] *AC5-C3BC5-C2CC6-C3(正确答案)DC6-C423、香豆素与浓度高的碱长时间加热生成的产物是()[单选题] * A脱水化合物B顺式邻羟基桂皮酸(正确答案)C反式邻羟基桂皮酸D醌式结构24、具有光化学毒性的中药化学成分类型是()[单选题] *A多糖B无机酸C鞣质D呋喃香豆素(正确答案)25、属于挥发油特殊提取方法的是()[单选题] *A酸提碱沉B水蒸气蒸馏(正确答案)C煎煮法D浸渍法26、中药补骨脂中的补骨脂内脂具有()[单选题] *A抗菌作用B光敏作用(正确答案)C解痉利胆作用D抗维生素样作用27、E连续回流提取法(正确答案)能用乙醇作溶剂提取的方法有(多选)()* A浸渍法(正确答案)B渗漉法(正确答案)C煎煮法D回流提取法(正确答案)28、挥发性成分的提取,常用的是()[单选题] *A溶剂提取法B水蒸气蒸馏法(正确答案)C超临界液体萃取法D超声提取法29、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法30、以葛根素为指标成分进行定性鉴别的中药是()[单选题] *A葛根(正确答案)B黄芩C槐花D陈皮。


李绍芬《反应工程》课后习题答案1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分 摩尔分率y i0 摩尔数n i0(mol) CH 3OH 2/(2+4+1.3)=0.2740 27.40 空气 4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol组分 摩尔数(mol ) 摩尔分率% CH 3OH 7.672 6.983 HCHO 18.96 17.26 H 2O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.391. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。

反应工程课后习题参考答案1绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:S0.961196.11%(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为2由甲醇的转化率达72%某y某=72%;=69.2%227.4解得某=18.96;y=0.77所以,反应器出口气体组成为:CH3OH:27.4某y100%=6.983%某y10022某3y100%=40.19%空气:某y1002217.81某2y水:100%=34.87%某y10022某HCHO:100%=17.26%某y10022yCO2:100%=0.6983%某y1002254.791.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:CO2H2CH3OH2CO4H2(CH3)2OH2OCO3H2CH4H2O4CO8H2C4H9OH3H2OCOH2OCO2H2由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体Akmol/h原料气和冷凝分离后的气体组成如下:组分原料气冷凝分离后的气体COH2CO226.8268.251.4615.4969.780.82CH40.553.62N22.9210.29粗甲醇的组成为CH3OH89.15%,(CH3)2O3.55%,C3H9OH1.10%,H2O6.20%,均为重量百分率。

第二章化学反应工程基础1.说明聚合反应工程的研究内容及其重要性。
研究内容:①以工业规模的聚合过程为对象,以聚合反应动力学和聚合体系传递规律为基础;②将一般定性规律上升为数学模型,从而解决一般技术问题到复杂反应器设计,放大等提供定量分析方法和手段;③为聚合过程的开发,优化工艺条件等提供数学分析手段。
简而言之:聚合反应工程研究内容为:进行聚合反应器最佳设计;进行聚合反应操作的最佳设计和控制。
2.动力学方程建立时,数据收集方式和处理方式有哪些?收集方式:化学分析方法,物理化学分析方法处理方式:积分法,微分法。
3.反应器基本要求有哪些①提供反应物料进行反应所需容积,保证设备一定生产能力;②具有足够传热面积;③保证参加反应的物料均匀混合4.基本物料衡算式,热量衡算式①物料衡算:反应物A流入速度-反应物A流出速度-反应物A反应消失速度-反应物A积累速度=0(简作:流入量-流出量-消失量-积累量=0)②热量衡算:随物料流入热量-随物料流出热量-反应系统与外界交换热量+反应过程的热效应-积累热量=05.何谓容积效率?影响容积效率的因素有哪些工业上,衡量单位反应器体积所能达到的生产能力称之为容积效率,它等于在同一反应,相同速度、产量、转化率条件下,平推流反应器与理论混合反应器所需总体积比:η=Vp/Vm=τp/τm。
影响因素:反应器类型,反应级数,生产过程中转化率有关6.何为平推流和理想混合流?①反应物料在长径比很大的反应器中流动时,反应器内每一微元体积中流体均以同样速度向前移动,此种流动形态称平推流;②由于反应器强烈搅拌作用,使刚进入反应器物料微元与器内原有物料元瞬时达到充分混合,使各点浓度相等且不随时间变化,出口流体组成与器内相等此流动形态称理想混合流。
7.实现反应器的热稳定操作需满足哪些条件?①Qr=Qc,Qr体系放出热量;②dQc/dT>dQr/dT,Qc 除热量;③△T=T-Tw<RT2/E,E 反应活化能,T 反应器温度,Tw 冷却液温度8.何为返混?形成返混的主要原因有哪些?返混:指反应器中不同年龄的流体微元间的混合;原因:①由于物料与流向相反运动所造成,②由于不均匀的速度分布所引起的,③由于反应器结构所引起死角、短路、沟流、旁路等。


化学反应工程原理第二版课后练习题含答案第一章:化学反应及其动力学1.1 选择题1.在一个二级反应中,反应物消耗的速率是:A. 指数级B. 线性级C. 平方级D. 无法确定答案:A2.在实验室里,观察到以下两个过程:I、反应物浓度显著降低时,反应速率也随之降低;II、加热环境下反应速率明显提高。
从以上两个过程可以推断:A. 反应是随机过程,和反应物数量无关B. 反应是由反应物占据的活性中心引发,活性中心数量随反应物浓度升高而增多C. 反应是由温度升高引起反应物动能升高而加快反应速率D. 反应是由催化剂引发的,加热可提高催化剂效率答案:C1.2 填空题1.在单级分步反应中,反应速率方程为 r=kC_A^m C_B^n ,其中,m+n=……答案:22.在第一级反应中,半衰期的定义为反应物浓度减少到初值的……答案:一半1.3 计算题1.在气相反应 A+B=C 中,当初浓度均为 2mol/L 时,反应速率为0.1mol/L*s,求 5s 后反应物含量(假设反应一级)。
答案:k = r/C_A = r/2 = 0.1/2 = 0.05kt = 0.05 5 = 0.25C_A = C_A0 * e^{-kt} = 2 * e^{-0.25} = 1.22mol/LC_B = C_B0 * e^{-kt} = 2 * e^{-0.25} = 1.22mol/LC_C = C_C0 + (C_A0-C_A) = 2 + (2-1.22) = 2.78mol/L2.在二级反应A+B→C 中,初时只有 A,它以 0.1mol/L的浓度存在;目标是 10min 之后浓度为 0.05mol/L。
反应速率常数为 0.0002L/mol∙min,计算 B 的增长者代表反应物的摩尔量。
答案:k = r/(C_AC_B)r = kC_AC_BdC_A/dt = -r = -kC_AC_BdC_B/dt = -r = -kC_AC_BC_A(t) = C_A0/(1+C_A0C_B0kt)C_B(t) = C_B0/(1+C_A0C_B0kt)10min = 600sC_A(600s) = 0.05mol/L = 0.1mol/L/(1+0.1mol/LC_B00.0002L/mol∙min600s)0.1mol/LC_B00.0002L/mol∙min600s = 1C_B0 = 5mol/L反应物摩尔量 = C_B0t = 5mol/L*600s = 3000mol。
《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。
化学反应工程课后习题答案化学反应工程课后习题答案化学反应工程是化学工程学科中的重要分支之一,它研究的是化学反应在工业生产中的应用。
通过对反应过程的分析和优化,可以提高反应的产率、选择性和经济性。
在学习化学反应工程的过程中,我们经常会遇到一些习题,下面我将为大家提供一些常见习题的解答。
1. 习题一:对于一个一级反应A→B,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
求该反应的速率常数k。
解答:根据一级反应的速率方程,可以得到d[A]/dt = -k[A],其中d[A]/dt表示A的浓度随时间的变化率。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t。
将这两个式子相等,可以得到(Ct - C0)/t = -k[A]。
由于初始浓度为C0的A,所以[A] = C0。
将这个值代入上式,可以得到(Ct - C0)/t = -kC0。
整理一下,就可以得到k = (C0 - Ct)/C0t。
2. 习题二:对于一个二级反应A + B→C,初始浓度分别为C0的A和C1的B,经过一段时间t后,浓度分别为Ct的A和Ct+1的B。
求该反应的速率常数k。
解答:根据二级反应的速率方程,可以得到d[A]/dt = -k[A][B],d[B]/dt = -k[A][B]。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t,d[B]/dt = (Ct+1 - C1)/t。
将这两个式子相等,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -k[A][B]。
由于初始浓度分别为C0的A和C1的B,所以[A] = C0,[B] = C1。
将这两个值代入上式,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -kC0C1。
整理一下,就可以得到k = (C0- Ct)/(C0C1t) = (Ct+1 - C1)/(C0C1t)。
3. 习题三:对于一个零级反应,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩Bkg/h 粗甲醇100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
第二章 均相反应动力学1、有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程3、 在间歇反应器中有一级液相可逆反应P A ⇔,初始反应时C A0=0.5mol/L ,C P0=0反应8min 后,A 的转化率为1/3,而平衡转化率是2/3,求此反应的动力学方程式。
解:p A AC k C k dtdC 21-=-21002122)1(k k x C x C C C K k k Ae A Ae A Ae Pe ==-===即根据一级可逆反应积分式1212121min 08664.082ln 3132ln 18ln1-==+∴+=-+=k k k k x x x k k t AAe Ae 1211m in 02888.0m in 05776.0--==∴k kP A p A AC C C k C k dtdC 02888.005776.021-=-=-5、恒温恒容的气相反应A →3P ,其动力学方程为Vn k dt dn V r A AA =-=-1)(,在反应过程中系统总压p t 及组分A 的分压均为变量,试推导)(A tp f dtdp =的表达式。
解:AtAA AtA A A A AAA A t A A t A A A t kp dtdp RT pk kc V n k dt dp RT dt dp RT dt dp RT dt dc r V n k dt dn v r dtdpdt dp p p p p p p p 221211(1)(22)(3)00======-=-=-=-=--=--=-+=得即8、纯气相组分A 在一等温等容间歇反应器中按计量式P A 5.2⇔进行反应,实验测得如下数据,时间/min 0 2 4 6 8 10 12 14 ∝ 分压p A /MPa 0.1 0.08 0.0625 0.051 0.042 0.036 0.032 0.028 0.020用积分法求此反应的动力学方程式。
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222C H O H O 2H C H O 2H O +→+ 32222C H O H 3O 2C O 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),A P 口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23C O 2H C H O H +⇔23222C O 4H (C H )O H O +⇔+ 242C O 3H C H H O +⇔+24924C O 8H C H O H 3H O +⇔+222C O H O C O H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与Bkg/h 粗甲醇100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg 粗甲醇而言,其溶解量为CO 2 9.82g,CO 9.38g,H 2 1.76g,CH 4 2.14g,N 25.38g 。
若循环气与原料气之比为7.2(摩尔比),试计算:(1) (1) 一氧化碳的单程转换率和全程转化率; (2) (2) 甲醇的单程收率和全程收率。
解:(1)设新鲜原料气进料流量为100kmol/h ,则根据已知条件,计算进料原料其中x i =y i i i i m i iM ’m =∑y i M i =9.554又设放空气体流量为Akmol/h ,粗甲醇的流量为Bkg/h 。
对整个系统的N 2作衡算得:5.38B/28×1000+0.1029A=2.92 (A) 对整个系统就所有物料作衡算得:100×10.42=B+9.554A (B) 联立(A )、(B )两个方程,解之得A=26.91kmol/h B=785.2kg/h 反应后产物中CO 摩尔流量为F CO =0.1549A+9.38B/(28×1000) 将求得的A 、B 值代入得F CO =4.431 kmol/h 故CO 的全程转化率为C O ,0C OC O C O ,0F F 26.82 4.435X 83.48%F 26.82--===由已知循环气与新鲜气之摩尔比,可得反应器出口处的CO 摩尔流量为F ’CO,0=100×0.2682+7.2×100×0.1549=138.4 kmol/h 所以CO 的单程转化率为C O ,0C O'C OC O ,0F F 26.82 4.435X16.18%F 138.4--===产物粗甲醇所溶解的CO 2、CO 、H 2、CH 4和N 2总量D 为(9.829.38 1.76 2.14 5.38)B D 0.02848B km ol /h1000++++==粗甲醇中甲醇的量为(B-D)X 甲/M m =(785.2-0.02848B) ×0.8915/32=21.25 kmol/h 所以,甲醇的全程收率为Y 总=21.25/26.82=79.24% 甲醇的单程收率为Y 单=21.25/138.4=15.36%2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-m ol l h由(2.6)式可知反应物的水解速率为0.125/.-==dC A rm ol l hA dt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+C O H C H H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,改变进口原料气流量Q 0解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX故反应速率可表示为:0000(/)==A AA A A R R dX dX r Q C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R /Q 0)值α。
0.650.04 1.790.34α-==故CO 的转化速率为40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C m ol l R T430 6.38101.79 1.1410/.m in (/)--==⨯⨯=⨯AA A R dX r C m ol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为: 20.850.4/-=⋅w C O C O r k y y km ol kg h式中y CO 和y CO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。
如催化剂的比表面积为30m 2/g ,堆密度为1.13g/cm 3,试计算:(1) (1) 以反应体积为基准的速率常数k V 。
(2) (2) 以反应相界面积为基准的速率常数k g 。
(3) (3) 以分压表示反应物系组成时的速率常数k g 。
(4) (4) 以摩尔浓度表示反应物系组成时的速率常数k C 。
解:利用(2.10)式及(2.28)式可求得问题的解。
注意题中所给比表面的单位换算成m 2/m 3。
33230.450.45330.45(1) 1.13100.053560.46/.6(2) 1.7810/.301011(3)()()0.05350.15080.1013..()8.3110700(4)()(0.05350.333(0.1)ρρρρ-==⨯⨯=-===⨯⨯⨯==⨯=⨯⨯==⨯=v b w bbg w w vb n p w nc w k k km ol m h k k k km ol m ha km ol k k P kg h M P a m R T k k P km 0.45)().km ol ol kg h2.4在等温下进行液相反应A+B →C+D ,在该条件下的反应速率方程为:1.50.50.8/m in =⋅A A B r C C m ol l若将A 和B 的初始浓度均为3mol/l 的原料混合进行反应,求反应4min 时A 的转化率。
解:由题中条件知是个等容反应过程,且A 和B 的初始浓度均相等,即为1.5mol/l ,故可把反应速率式简化,得1.50.522200.80.80.8(1)===-A A B A A A r C C C C X 由(2.6)式可知 00(1)⎡⎤⎢⎥⎣⎦--==-=A A AA A A d C X dC dX r C dtdtdt代入速率方程式2200.8(1)=-AA A A dX C C X dt化简整理得00.8(1)=-AA A dX C dtX 积分得00.81=-AA A X C t X解得X A =82.76%。
2.5氨合成塔入口的气体组成为3.5%NH 3,20.8%N 2,62.6%H 2,7.08%Ar 及5.89CH 4。
该塔是在30MPa 压力下操作。
已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol ),试计算该处的反应速率。
在Fe 催化剂上氨合成反应速率式为:322321.531.512/=-⋅N HHNN HH p p r k p k km ol m hp p逆反应的活化能417.5810/=⨯E J m ol。
450℃时3.522277()/=⋅k m M Pa m h ,且212/=P k k K ,490℃时,Kp 可按下式计算:472log 2047.8/ 2.4943log 1.25610 1.856410 3.206--=--⨯+⨯+p K T T T T 注:m 3为标准立方米。
解:题中给出450℃时的k 2值,而反应是在490℃下,故首先要求出490℃时的k 2值。
利用(2.27)试,求出频率因子A:44217.5810/8.314723162'1617.5810/8.314723430.532exp ()exp ()2277/ 1.14510exp () 1.14510 1.05510()/.-⨯⨯-⨯⨯-=-===⨯-==⨯=⨯E k A R T E A k e R T E k A e m M P a m hR T490℃的Kp 值由题给公式计算出4722log 2047.8/763 2.4943log 763 1.25610763 1.8564107633.206 1.25245.59210---=--⨯⨯+⨯⨯+=-=⨯p p K K 求k 1值:22'112'222431.531(5.59210) 1.0551033()/.--===⨯⨯⨯=pp k Kk K k k k m M Pa m h求各组分的分压值:2233122+↔N H N H5716.0.14160*(-2)*2087.01.14160*2087.0*3-626.0 1y 13y y 1904.0 .14160*(-2)*2087.01)1416.0-(12087.0 1y y y 1416.05.6914.45*(-2)*2087.01*2087.0*211035.010.01y y y 22123211 %87.20P y , 1y y y 1000H H 000A A 00R 0R R 0000000==-)+-(=,+=δ+-==+=δ+-===+--=δ+νν-=δ==δ+νν-=δ+νν-=A A A AA AA A A A AAAAAA A AA AA A i i AA A AA Ai i i AA A AA A i i i Xy XXy X XX XXX y Xy p Xy XX y Xp p pP y i i p =反应速率为:322321.51.541.5121.5333317.15333.0 5.718 1.05510317.154.02310/.(179.6/.)=-=⨯⨯-⨯⨯=⨯N HHNN HH p p r k p k p pm m cat h km ol m cat h2.6下面是两个反应的T-X 图,图中AB 是平衡曲线,NP 是最佳温度曲线,AM 是等温线,HB 是等转化率线。