[课件]大学无机化学与分析化学简介PPT
- 格式:ppt
- 大小:326.50 KB
- 文档页数:10


无机及分析化学概述无机化学研究内容01分析化学研究内容02无机及分析化学的重要性03课程目标与要求课程目标课程要求熟悉无机及分析化学的基本理论和实验技能,了解相关领域的前沿动态,能够运用所学知识解决实际问题。
原子结构与元素周期律原子的核外电子排布、元素周期表的结构与性质递变规律等。
化学键与分子结构离子键、共价键、金属键的形成与特点,分子的极性与空间构型等。
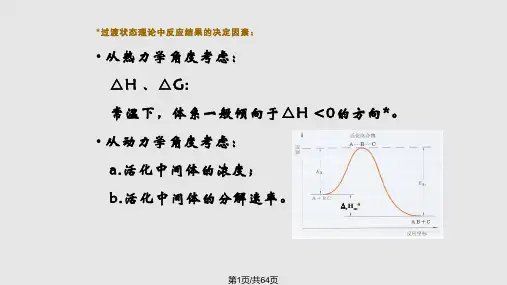
化学反应基本原理化学反应的热力学与动力学基础,化学平衡与反应速率等。
分析化学基础误差与数据处理、滴定分析、重量分析等基本分析方法与原理。
基础知识回顾原子结构模型汤姆生模型卢瑟福模型波尔模型元素周期表与周期律元素周期表将化学元素按照原子序数从小至大排序的化学元素列表。
列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。
周期律元素的性质随着元素原子序数的递增而呈现周期性变化的规律。
非金属性同周期主族元素从左到右逐渐增强,同主族元素从上到下逐渐减弱。
同周期主族元素从左到右逐渐减弱,同主族元素从上到下逐渐增强。
电负性同周期主族元素从左到右逐渐增大,同主族元素从上到下逐渐减小。
原子半径同周期主族元素从左到右逐渐减小,同主族元素从上到下逐电离能原子性质及变化规律离子键的形成离子晶体的特点离子晶体的结构030201共价键的形成通过原子间共用电子对形成共价键。
分子晶体的特点低熔点、硬度小、具有挥发性、导电性差(固态和液态)、溶解性(在水中难溶解,易溶于有机溶剂)。
分子晶体的结构分子晶体中,分子间通过范德华力相互吸引,构成晶体。
金属键的形成金属晶体的特点金属晶体的结构化学反应基本类型及特点合成反应分解反应置换反应复分解反应1 2 3反应速率定义影响反应速率的因素反应速率方程化学反应速率与影响因素化学平衡及移动原理化学平衡定义影响化学平衡的因素分析化学概述及分类方法分析化学定义分析化学分类分析化学的任务滴定分析法原理01滴定分析法的应用举例02滴定分析法的优点03重量分析法原理通过化学反应将被测组分转化为一定的称量形式,然后准确称量该称量形式的重量,从而求得被测组分的含量。







![无机及分析化学[全]ppt课件](https://uimg.taocdn.com/9513af63fd0a79563d1e72ad.webp)
无机与分析化学核心课件无机及分析化学核心内容化学原理无机物与无机反应化学分析原理与方法有哪几个公式是最重要的本课程平时成绩含1平时的课堂练习 2定量分析基础和四大滴定汇总 3 总结一下附录中热力学函数解离常数溶度积稳定常数标准电极电势(是什么有什么用怎么用相互之间有何关联)化学原理化学反应基本理论化学热力学化学动力学化学平衡物质结构原子结构分子结构分子间的相互作用力无机物与无机反应四大类无机物四大类无机反应化学分析原理与方法误差理论有效数字有效数字的运算规则修约规则滴定分析要素滴定分析中的基本量关系四大滴定各论有哪几个公式是最重要的化学原理1 化学反应基本理论化学热力学化学动力学化学平衡物质的标准态在温度T及标准压力p 100kPa 下的状态简称标准态用右上标表示标准态当系统处于标准状态时指该系统中诸物质均处于各自的标准状态标准平衡常数 Ko 表达式的写法气态物种用P Po 溶质用c co 纯固体纯液体溶剂用数值1Q 与 Ko 自发自发性判据由这些标准态物质的热力学函数可以计算反应热计算化学反应的标准平衡常数判断过程是否为自发过程关于自发有进行的倾向在一定条件下不需外界提供能量就可以进行有哪几个公式是最重要的反应历程反应速率理论基元反应质量作用定律反应速率方程反应级数反应速率常数阿累尼乌斯公式阿累尼乌斯活化能Ea 现代酸碱理论酸碱电离理论酸碱质子理论酸碱电子理论用平衡常数研究平衡体系关于用平衡常数的计算找准那个标准平衡常数认准了吗写出相关的化学平衡方程式写对了吧写出平衡常数表达式我想你不会弄错吧 C0Ceq 设x 是否有取近似的必要和可能解方程这就OK 了请注意方法死记公式就OUT了缓冲溶液溶度积溶度积原理什么是溶度积原理关于用平衡常数的计算找准那个标准平衡常数认准了吗写出相关的化学平衡方程式写对了吧写出平衡常数表达式我想你不会弄错吧 C0 Ceq 设x 是否有取近似的必要和可能解方程这就OK 了请注意方法死记公式就OUT了关于用平衡常数的计算解离常数溶度积稳定常数请注意方法死记公式就OUT了氧化还原电极电势标准电极电势简述电极电势的概念标准氢电极参比电极电极电势的的能斯特方程式这种课件实为天下第一丑式中 Q 是电极反应的反应商还原半反应信不信你的心你作主有哪几个公式是最重要的电极电势的应用配位化合物的组成和命名 [Co NH3 2 en 2] NO3 3 硝酸二氨·二乙二胺合钴Ⅲ配位数配位平衡常数稳定常数不稳定常数逐级稳定常数累积稳定常数βn 汇总附录附录中有关内容的意义和应用热力学函数解离常数溶度积稳定常数标准电极电势汇总理论碰撞理论过渡状态理论酸碱电离理论酸碱质子理论酸碱电子理论价键理论杂化轨道理论价层电子对互斥理论分子轨道理论配位化合物的价键理论汇总效应同离子效应盐效应酸效应羟合效应汇总方程定律速率方程能斯特方程热力学第一定律热力学第二定律热力学第三定律质量作用定律稀释定律化学分析原理与方法1 误差理论有效数字有效数字运算规则修约规则化学分析原理与方法2 滴定分析要素滴定分析中的基本量关系四大滴定各论滴定曲线滴定反应和滴定反应的条件 pH加热准确滴定的条件配位滴定中的条件稳定常数配位滴定中准确滴定的条件酸碱滴定中准确滴定的条件酸碱滴定中分步滴定的条件配位滴定中准确滴定的条件 lgKf MY ≥8 由此可确定准确滴定的最小pH 酸碱滴定中准确滴定的条件什么滴定分析中的指示剂指示剂的变色原理指示剂的变色范围指示剂的选用原则滴定分析知识汇总误差理论有效数字及其运算规则修约规则滴定分析要素滴定分析中的基本量关系四大滴定中的标准溶液和基准物质测定对象及典型应用滴定反应及滴定反应的外部条件准确滴定的条件指示剂典型计算本课程的四类计算题热力学问题用平衡常数分析平衡体系的计算题原电池和能斯特方程应用定量分析计算化学原理2 物质结构原子结构分子结构原子结构二象性量子化统计性量子数波函数轨道电子云轨道能级电子轨道排布规律原子的电子构型共价键理论价键理论杂化轨道理论价层电子对互斥理论分子轨道理论配位化合物的化学键理论分子结构成键三原则电子轨道排布三原则分子轨道能级分子的电子构型分子的空间构型杂化价层电子对 4组成有效分子轨道的条件原子轨道必须满足三个条件能量相近轨道最大重叠对称性匹配才可以有效地组成分子轨道形成分子杂化杂化轨道的空间伸展方向 SP3杂化的向正四面体四个顶角方向 SP2杂化的向平面三角形三个顶角方向 SP杂化总为直线形结构我认识你SP3 CH4 正四面体型分子 SP3 等性杂化NH3 三角锥型分子 SP3不等性杂化 H2O V型或角型分子SP3不等性杂化AXmEn n 分子结构成键三原则电子轨道排布三原则分子轨道能级分子的电子构型分子的空间构型杂化价层电子对孤电子对分子的偶极矩瞬诱固有哪几个公式是最重要的有哪几个公式是最重要的 1 2 3 4中心原子的能量相近的不同类型的原子轨道线性组合形成新轨道的过程叫杂化等性杂化不等性杂化反应途径能量变化示意图 Ea1Ea2分别为正逆反应的活化能 rHm为反应的热效应rHm Ea1 Ea2 rHm 0 说明为放热反应rHm 0 说明为吸热反应未知的测定 E φ正极 - φ负极标准氢电极与待测电极组成原电池后测其电池反应的电动势E 当c KCl 为饱和溶液时φ 02412V 使用标准氢电极不方便一般常用易于制备使用方便且电极电势稳定的甘汞电极或氯化银电极等作为电极电势的对比参考称为参比电极如右图的甘汞电极Pt∣Hg∣Hg2Cl2∣Cl- KCl溶液 Hg2Cl2 Hg Pt。