碱的化学性质
- 格式:ppt
- 大小:238.50 KB
- 文档页数:6

碱的化学性质
碱有相同的化学性质是因为不同的碱溶液中都含有相同的。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:
2.由于弱碱不溶于水,所以弱碱使指示剂变色。
3.碱+非金属氧化物→ (复分解反应)
a)反应发生的条件:①
②‘
b)根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:
2NaOH+CO2=Na2CO3+H2O(用氢氧化钠溶液吸收二氧化碳)
2NaOH+SO2=Na2SO3+H2O
2NaOH+SO3=Na2SO4+H2O
Ca(OH)2+CO2=CaCO3↓+ H2O(检验二氧化碳;石灰墙“出汗”)
4.碱+酸→(复分解反应、中和反应)
在碱的通性中,弱碱只有该性质。
5.碱+盐→ (复分解反应)
a)反应发生的条件:
b)铵盐一定能与四大强碱反应。
c)新碱是沉淀:
蓝色沉淀–
红褐色沉淀–
白色沉淀–
新盐是沉淀:
d)波尔多液(注:波尔多液不是溶液):
弱碱在加热的条件下会分解成金属氧化物和水。
如Cu(OH)2
但需要注意的是,强碱没有该性质,该性质不属于碱的通性。

酸碱盐的化学性质酸、碱、盐是化学中三种重要的物质,它们各自具有不同的化学性质。
1. 酸的化学性质酸是一类能够在水或其他溶液中产生氢离子(H+)的化合物。
酸的化学性质通常体现在三个方面:(1)酸与碱反应酸与碱在适当的条件下可以发生酸碱中和反应,生成盐和水。
例如,氢氧化钠(NaOH)和盐酸(HCl)的反应:NaOH + HCl → NaCl + H2O在这里,盐酸是酸,氢氧化钠是碱,它们反应生成氯化钠和水。
(2)酸与金属反应在适当条件下,酸可以与金属反应,生成盐和氢气。
例如,硫酸和锌的反应:H2SO4 + Zn → ZnSO4 + H2在这里,氢气是由锌与酸反应产生的,盐是由硫酸和锌生成的。
(3)酸与碳酸盐反应酸还可以与碳酸盐反应,生成盐、二氧化碳和水。
例如,盐酸和碳酸钙(CaCO3)的反应:2HCl + CaCO3 → CaCl2 + CO2 + H2O在这里,盐是由盐酸和碳酸钙生成的,二氧化碳是由碳酸钙分解而来。
2. 碱的化学性质碱是一类在水或其他溶液中能产生氢氧根离子(OH-)的化合物。
它们的化学性质主要体现在两个方面:(1)碱与酸反应碱与酸在适当条件下可以发生酸碱中和反应,生成盐和水。
例如,在上面的NaOH + HCl → NaCl + H2O的反应中,氢氧化钠是碱,它与盐酸反应生成氯化钠和水。
(2)碱与酸盐反应碱也可以与酸盐反应,生成盐和水。
例如,氢氧化钠和硫酸的反应:NaOH + H2SO4 → Na2SO4 + 2H2O在这里,盐是由氢氧化钠和硫酸生成的,水是由反应产生的。
3. 盐的化学性质盐是由酸和碱中和反应后生成的化合物。
它们有一些特殊的化学性质:(1)盐水的电解性当盐溶解于水中时,它们会分解成正负离子,盐水具有电导性。
例如,氯化钠(NaCl)在水中的电离:NaCl → Na+ + Cl-在这里,Na+和Cl-是离子,它们在水中离解。
(2)盐水的酸碱性质盐溶解于水中会产生酸碱性质,具体取决于其所属的酸或碱的强度。

碱的5个化学性质及方程式
1.电解质性:氯化物具有电解质性,即溶解于水中会产生带有正电荷和负电荷的离子。
方程式:NaCl(s) → Na+(aq) + Cl–(aq)
2.碱性:当氯化物溶解在水中时,有碱性,即能够与酸反应,产生盐和水。
方程式:NaCl(aq) + H2SO4(aq) → NaHSO4(aq) + HCl(aq)
3.结构稳定性:氯化物通常具有极强的结构稳定性,它们的重组受到相当严格的控制。
4.溶解度:T氯化物是溶质,可以在水中完全溶解,但溶解度受温度的影响,随着温度的升高,溶解度也随之增加。
5.易分解:当氯化物受到热、电等刺激时,其分子结构会被破坏,这时就发生氯化物的分解反应,此时其原子发生电子转移,产生气态氯。
方程式:2 NaCl(s) → 2 Na(s) + Cl2(g)。


酸和碱的化学性质酸的化学性质:1、能使指示剂显色(紫色石蕊显红色);2、能和碱反应生成盐和水;3、能和金属氧化物反应生成盐和水;4、能和金属反应生成盐和氢气(非还原性酸和活泼金属);5、能和某些盐反应生成新的盐和新的酸。
碱的化学性质:1、能使指示剂显色(紫色石蕊显蓝色,酚酞显红色);2、能和酸反应生成盐和水;3、能和非金属氧化物反应生成盐和水;4、能和某些非金属反应生成盐和水;5、能和某些盐反应生成新的盐和新的碱。
【知识拓展】1、酸的通性(1)酸溶液能跟酸碱指示剂起反应。
紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色。
注意显色的物质是指示剂。
(2)酸能跟多种活泼金属起反应,通常生成盐和氢气。
只有位于金属活动性顺序表中氢前面的金属才能与稀酸(HCl、H2SO4)反应,产生氢气。
位于氢后的金属不能与稀酸(HCl、H2SO4)反应,但能与浓硫酸和浓硝酸反应。
例如:①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可见,金属和浓硫酸、硝酸反应都没有氢气产生,这就是实验室不能用浓硫酸和硝酸与锌反应制氢气的原因。
(3)酸能跟碱性氧化物反应生成盐和水:H2SO4+CaO==CaSO4+H2O (4)酸能跟某些盐反应生成新酸和新盐:H2SO4+BaCl2===BaSO4↓+2HCl(5)酸跟碱起中和反应生成盐和水:H2SO4+Ba(OH)2===BaSO4↓(白色沉淀)+2H2O常见的酸有盐酸、硫酸和硝酸,它们虽然具有上述五点通性(因为电离出的阳离子都是H+)。
但又各具不同的物理化学性质。
①盐酸是氯化氢的水溶液,是一种混合物。
纯净的盐酸是无色的液体,有刺激性气味。
工业品浓盐酸因含有杂质(Fe3+)带有黄色。
浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。
这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。

常见的碱化学性质及通性Document serial number [NL89WT-NY98YT-NC8CB-NNUUT-NUT108]常见的碱(化学性质及通性)一、碱的定义和分类四大强诚:碱:物质溶于水时,形成的阳离子全部是OK 的化合物。
KOH (氢氧化钾)、NaOH (氢氧化钠)、Ca (OH )c (氢氧化钙)、Ba (OH ):(氢氧化钢)有色沉淀:蓝色沉淀Cu (OH ),(氢氧 化铜)、红褐色沉淀Fe (OH )、(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氮气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH 3 • H :O=XH.>OH\所以氨水也是减c钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H :O=Ca (OH )2 二、常见的碱酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液c氢氧化钠必须密封有两个原因:①吸水性:②能与空气中的二氧化碳反应:2NaOH+CO :=Na =CO 5+H :O :(③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的0H ;1 ,碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石茏溶液变蓝,使无色酚酷溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色。
2,碱+非金属氧化物一盐♦水(豆分解反应)a )反应发生的条件:①域是四大强碱:②非金属氧化物是二氧化碳、二氧化硫、三氧化硫。
b )根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:2NaOH-COr=Na :CO 3-H :O (用氢氧化钠溶液吸收二氧化碳)2NaOH-SO2=Na :SO^H :O2NaOH+SO J =Na :SO l +H :OCa (OH ):+CO :=CaCO 3 I +HQ (检验二 氧化磔:石灰墙“出汗”)3.弑+酸一盐+水(更分解反应、中和反应)在碱的通性中,弱碱只有该性质。

常见的碱碱的通性一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl=NaCl+H2ONaOH+HNO3=NaNO3+H2O2NaOH+H2SO4=Na2SO4+2H2O(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH易与CO2反应而变质。
4、用途氢氧化钠是一种重要的化工原料二、氢氧化钙[Ca(OH)2]1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO2+Ca(OH)2=CaCO3↓+H2O(3)与酸反应2HCl+Ca(OH)2=CaCl2+2H2O此性质在农业上用于改良酸性土壤。

酸、碱、盐的化学性质一、酸、碱、盐的定义1、酸是由氢元素和酸根离子组成的化合物;酸 === H+ + 酸根离子碱是金属离子和氢氧根离子构成的化合物;碱 === OH- + 金属离子盐是由金属离子和酸根离子构成的化合物。
盐 ===金属离子 + 酸根离子2、常见的酸有盐酸、硫酸酸具有相似化学性质的原因:它们的溶液中都含有相同的氢离子。
盐酸、硫酸化学性质不同的原因:它们所含的酸根离子不同。
如:盐酸能和硝酸银反应,而硫酸能和钡盐溶液反应。
3、常见的碱有氢氧化钠、氢氧化钙碱有相似化学性质的原因:它们的溶液中都含有相同的氢氧根离子。
氢氧化钠、氢氧化钙化学性质不同的原因:它们所含的金属离子不同。
如:氢氧化钙溶液能和碳酸钠溶液反应4、常见的盐有碳酸钙、碳酸钠、碳酸氢钠、氯化钠二、酸、碱、盐的化学性质1、酸与指示剂作用酸能使紫色石蕊溶液变红,酚酞溶液不变色2、碱与指示剂作用碱能使无色酚酞溶液变红,紫色石蕊溶液变蓝3、酸 + 金属---- 盐 + 氢气(和酸来反应,氢后难实行)Mg、Al、Zn、Fe4、盐 + 金属----- 新盐 + 新金属(和盐液反应,前金换后金)5、碱 + 非金属氧化物-----盐 + 水(碱可溶)CO2、SO2、SO3分别与NaOH、Ca(OH)2反应6、酸 + 金属氧化物 ------盐 + 水Fe2O3铁锈消失,溶液变黄。
CuO 黑色粉末逐渐溶解,溶液变蓝。
7、酸 + 碱 ------ 盐 + 水氢氧化钠、氢氧化钙、盐酸、硫酸两两反应;中和胃酸;中和硫酸厂污水;硫酸和氢氧化钡8、酸 + 盐----- 新酸 + 新盐(条件:生成物中有气体、沉淀或水生成。
)碳酸钠、碳酸氢钠、碳酸钙和盐酸;硝酸银和盐酸;氯化钡或硝酸钡和硫酸9、碱 + 盐-----新碱 + 新盐(条件:①反应物中碱、盐可溶;②生成物中有气体、水或沉淀)10、盐 + 盐----- 新盐 + 新盐(条件:①反应物中的盐可溶;②生成物中有沉淀)NaCl与AgNO3;Na2CO3与CaCl2、BaCl2反应,Na2SO4与Ba(NO3)2、BaCl2反应四、离子的鉴别(离子的鉴定是相互的)H+试剂:紫色石蕊溶液或活泼金属或碳酸盐现象:溶液变红;有气泡产生OH-试剂:无色酚酞溶液或铜盐或铁盐溶液现象:溶液变红;蓝色沉淀;红褐色沉淀2- 试剂:稀盐酸和石灰水CO3现象:生成气体,石灰水变浑浊Cl-试剂:硝酸银溶液和稀硝酸现象:白色沉淀不溶于稀硝酸2-试剂:氯化钡或硝酸钡溶液和稀硝酸SO4现象:白色沉淀不溶于稀硝酸+ 试剂:氢氧化钠溶液和红色石蕊试纸NH4现象:有刺激性气体生成,红色石蕊试纸变蓝。

碱的化学性质碱是一种常见的化学物质,具有多种独特的化学性质。
了解碱的化学性质对于进行实验和解决实际问题都具有重要的意义。
碱具有强烈的碱性。
这是因为碱在水中解离出氢氧根离子,使得溶液呈现出强烈的碱性。
例如,氢氧化钠(NaOH)在水中解离出氢氧根离子和钠离子,使得溶液的pH值升高。
碱还具有腐蚀性。
这是因为碱在水中解离出的氢氧根离子可以与某些金属离子发生反应,生成金属氢氧化物沉淀,这些金属氢氧化物通常比原来的金属更加脆弱。
因此,许多碱都具有腐蚀性,可以腐蚀玻璃、陶瓷等材料。
碱与酸发生中和反应,生成盐和水。
这是酸和碱的基本反应之一。
例如,盐酸氢氧化钠(NaOH)与盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸盐酸氧气,这个常见的气体,有着怎样的化学性质呢?氧气是氧元素的一种单质,它是一种无色、无味、无臭的气体。
在标准大气压下,氧气的密度是429克/升,比空气的密度略大。
在通常的温度和压力下,氧气是一种化学性质活泼的气体。
助燃性:氧气是一种很好的助燃剂,它可以使可燃物在有氧的环境下燃烧得更剧烈。
例如,在点燃的条件下,氢气和氧气可以反应生成水,同时放出大量的热。
这种反应是燃烧的一种形式,也是氧气的助燃性的体现。
氧化性:氧气可以与许多元素或化合物发生反应,使其被氧化。
例如,铁在空气中会生锈,这是因为铁与氧气和水蒸气反应生成了铁(III)氧化物。
这种反应中,氧气起到了氧化剂的作用,使铁从0价变为+3价。
参与生物呼吸:氧气是大多数生物呼吸作用中的重要元素。
在细胞中,氧气被消耗用于氧化有机物质,为生物体提供能量。
这个过程是生命活动的基础之一。
与金属反应:氧气可以与许多金属反应,生成金属氧化物。
例如,镁在点燃的条件下与氧气反应生成氧化镁。
这种反应通常会放出大量的热。
与非金属反应:氧气也可以与非金属反应,例如与磷反应生成五氧化二磷。
这种反应通常伴随着大量的热产生。
氧气的化学性质使得其在生活中有着广泛的应用。

1.碱的定义:化合物在溶剂水的作用下,电离出来的阴离子全都是氢氧根离子的化合物是碱。
2.碱的分类:⑴.根据溶解性分为可溶性碱[Ba(OH)2、KOH 、NaOH 、Ca(OH)2、NH3•H2O]和不溶性碱[Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2、AgOH ]⑵.可溶性碱分为强碱[Ba(OH)2、KOH 、NaOH 、Ca(OH)2 ]和弱碱[NH3•H2O],不溶性碱全都是弱碱。
⑶.根据电离出来的氢氧根离子数目:一元碱、二元碱、三元碱。
ⅰ.一元碱:KOH 、NaOH 、NH3•H2O、AgOH 。
ⅱ.二元碱:Ba(OH)2、Ca(OH)2、Mg(OH)2、Fe(OH)2、Cu(OH)2。
ⅲ.三元碱:Al(OH)3、Fe(OH)3。
⑷.根据热稳定性:热稳定性碱和热不稳定碱。
ⅰ.热稳定性碱都是强碱:Ba(OH)2、KOH 、NaOH 、Ca(OH)2。
ⅱ.热不稳定的碱全都是弱碱:NH3•H2O、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2、AgOH 。
3.溶液呈碱性的界定方法:⑴.从溶液中溶质的组成判断:ⅰ.溶质是可溶性碱的溶液呈碱性:Ba(OH)2、KOH 、NaOH 、Ca(OH)2、NH3•H2Oⅱ.溶质为强碱弱酸盐的溶液呈碱性:〔以钠盐为例〕Na2CO3、Na2SiO3、Na3PO4、NaNO2、Na2S 、Na2SO3、NaF 、NaClO 。
ⅲ、部分强碱的酸式盐溶液呈碱性:NaHCO3、Na2HPO4、NaHS 。
⑵.从溶液中的c(H+)和c(OH-)的浓度判断:ⅰ.从溶液中c(H+)和c(OH-)的大小关系比较来判断:当c(H+)<c(OH-)时,其水溶液呈碱性。
ⅱ.从溶液中c(H+)的范围判断:通常情况下溶液中c(H+)<10-7mol/L说明溶液呈碱性。
ⅲ.从溶液中c(OH-)的范围判断:通常情况下溶液中c(OH-)>10-7mol/L说明溶液呈碱性。
3. 碱+酸→盐+水(复分解反应、中和反应)在碱的通性中,弱碱只有该性质。
4. 碱+盐→新碱+新盐(复分解反应)a) 反应发生的条件:①反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);②新碱是氨水;③若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b) 铵盐一定能与四大强碱反应。
c) 新碱是沉淀:蓝色沉淀– 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓红褐色沉淀– 3NaOH+FeCl3=3NaCl+Fe(OH)3↓白色沉淀– 2NaOH+MgSO4=Na2SO4+Mg(OH)2↓d) 新盐是沉淀:Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOHCa(OH)2+Na2CO3=CaCO3↓+2NaOHe) 蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓f) 红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓g) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓四、氢氧化钠和氢氧化钙变质1. 氢氧化钠变质氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:a) 取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和Na2CO3+2HCl=2NaCl+H2O+CO2↑b) 取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓c) 取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓或Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓2. 氢氧化钙变质氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2OCaCO3+2HCl=CaCl2+H2O+CO2↑3. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
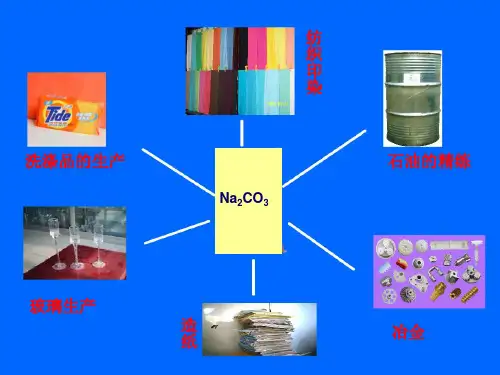
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
碱的化学性质心得体会教师关于碱的化学性质碱是常见的化学物质之一,具有一系列独特的化学性质。
在我多年的教学实践中,我发现学生们对于碱的化学性质理解不深入,因此我特地整理了一些重要的碱的化学性质,并将其写成1000字的心得体会,希望能对学生们的学习有所帮助。
首先,碱可以与酸发生中和反应。
当碱与酸反应时,产生的产物是盐和水。
例如,氢氧化钠与盐酸反应,会产生氯化钠和水。
这个化学反应是非常常见的,我们生活中经常用到的肥皂就是由碱与脂肪酸反应产生的,这也是为什么使用肥皂可以洗掉油污的原因。
其次,碱具有与金属氧化物和金属氢氧化物反应的性质。
碱能与金属氧化物反应产生盐和水,例如氢氧化钠与氧化铜反应,产生的产物是盐(氧化钠)和水。
同时,碱还能与金属氢氧化物反应,产生的产物也是盐和水。
这个特性在工业生产中有广泛的应用,例如石碱的生产过程中,氢氧化钠作为碱与石灰石反应,产生盐和水。
另外,碱还具有与二氧化碳反应的性质。
碱能够与二氧化碳反应产生碳酸盐和水。
这个反应是非常重要的,因为它可以用于二氧化碳的吸收和处理。
我们知道,二氧化碳是一种温室气体,过量的二氧化碳会导致全球气候变暖。
因此,对于二氧化碳的处理变得尤为重要,碱与二氧化碳反应的性质可以应用于捕捉和吸收二氧化碳。
此外,碱还能与酸酐反应,这个反应产生的产物是盐和水。
酸酐是一种无水生物酸,碱与酸酐的反应叫做酸酐化反应。
这个反应在化学合成中有广泛的应用,可以用于制备药物和其他有机物。
酸酐化反应通常需要控制反应条件和反应物的比例,以达到理想的反应结果。
最后,碱还具有与酸酐酯反应的特性。
碱与酸酐酯反应的产物是酸酐盐和醇。
这个特性在有机合成中也有很重要的应用,可以用于合成酸酐盐和醇,这些化合物在药物合成和化学工业中有广泛的应用。
通过对碱的化学性质的了解,我们可以发现碱是一种非常重要的化学物质,具有广泛的应用。
了解碱的化学性质可以帮助我们更好地理解化学反应的原理和过程,同时也可以帮助我们应用化学知识解决实际的问题。
碱的化学组成碱是一类常见化学物质,也是化学学科中重要的基础内容之一。
关于碱的化学组成,我们可以从多个方面来进行阐述。
一、碱的定义碱是指在水溶液中能够与酸发生中和反应的化合物,通常具有苦味、有腐蚀性、可溶于水等特点。
碱可以是钠、钾、钙、铵等金属离子的氧化物、氢氧化物或碱性盐等物质。
二、碱的化学结构碱的化学结构可以按照其物理性质和化学性质进行分类。
例如,按照物理性质可将其分为固体碱和液体碱;按照化学性质可将其分为强碱和弱碱。
固体碱的化学结构通常是一些具有晶体结构的化合物,如氢氧化钠(NaOH)、碳酸钠(Na2CO3)、氢氧化钾(KOH)等。
而液体碱一般是一些含有碱性基团的有机化合物,如乙胺(C2H5NH2)、草酸二甲酯钠(NaOMeCOOH)等。
三、碱的化学组成碱的化学组成与其物理结构和化学性质密切相关。
例如,氢氧化钠和氢氧化钾都是强碱,它们的化学组成为NaOH和KOH。
碳酸钠也是一种常见的碱性化合物,其化学组成为Na2CO3。
碱的化学组成还可以通过实验方法进行测定。
我们可以通过酸碱滴定法来测定某个物质中碱的含量,从而计算出其化学组成。
例如,我们可以用稀硫酸溶液滴定固体氢氧化钠溶液,然后根据滴定过程中所需用到的稀硫酸浓度和体积,计算出氢氧化钠的化学组成。
四、碱的性质和应用碱具有许多重要的化学性质,包括中和酸、水解、加热分解等。
碱还具有广泛的应用,例如用于制作肥皂、纸张、玻璃等工业产品,也可以用于医药、食品等领域。
总之,碱是化学学科中一个重要的概念,我们可以通过理解碱的定义、化学结构、化学组成以及性质和应用等方面,加深对于这一化合物的认识。
碱的主要化学性质化学方程式碱的定义:碱是指在溶液中电离成的阴离子全部是OH-的化合物。
碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。
从元素组成来看,碱一定含有氢元素和氧元素。
碱的化学性质碱 + 非金属氧化物 -------- 盐 + 水苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O碱 + 酸-------- 盐 + 水(中和反应,方程式见上)碱 + 盐 -------- 另一种碱 + 另一种盐氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH碱的命名:一般读作氢氧化某,如:NaOH读作氢氧化钠。
变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:氨气的水溶液俗称氨水,主要成分是NH3·H2O,通常状况下是无色液体,具有挥发性。
浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。
在化学实验中一般可用浓氨水做分子运动的探究实验。
常见的碱:(1)氢氧化钠、氢氧化钙都属于碱。
除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。
氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。