盐类水解--三大守恒关系
- 格式:ppt
- 大小:422.00 KB
- 文档页数:2


备战2020高考化学基础知识点复习专题二十二、盐类水解和溶液的中“三个”守恒附(2019强化题组训练)命题方向点播:溶液中的“三个守恒”,是盐类水解知识的延伸,也会结合离子平衡和溶液PH 一起考察。
该部分知识是同学们比较头疼的地方,通常出现在单项选择题和简答题中,约占12分。
基础知识点回顾一、明确“三个”守恒原理1、电荷守恒:即电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总数。
根据电荷守恒可准确、快速地解决电解质溶液中许多复杂的离子浓度问题。
2、物料守恒:是指物质发生变化前后,有关元素的存在形式不同,但元素的种类和原子数目在变化前后保持不变。
根据物料守恒可准确快速地解决电解质溶液中复杂离子、分子、物质的量浓度或物质的量的关系。
3、质子守恒:是指在电离或水解过程中,会发生质子(H +)转移,但在质子转移过程中其数量保持不变。
二、解题思路剖析。
1、正确理解质子守恒以Na 2CO 3和NaHCO 3溶液为例,可用下图所示帮助理解质子守恒:(1)Na 2CO 3溶液所以c (OH -)=c (HCO -3)+2c (H 2CO 3)+c (H 3O +),即c (OH -)=c (HCO -3)+2c (H 2CO 3)+c (H +)。
2、解题思维模型(1)单一溶液⎩⎪⎨⎪⎧ 酸或碱溶液—考虑电离盐溶液—考虑水解(2)混合溶液⎩⎪⎨⎪⎧不反应—同时考虑电离和水解反应⎩⎪⎨⎪⎧ 不过量—⎩⎪⎨⎪⎧ 生成酸或碱—考虑电离生成盐—考虑水解过量—根据过量程度考虑电离或水解 (3)不同溶液中某离子浓度的变化 若其他离子能促进该离子的水解,则该离子浓度减小,若抑制其水解,则该离子浓度增大。
三、盐类的水解的运用 1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H +或OH -结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H +或OH -结合,破坏水的电离,是平衡向右移动,促进水的电离。
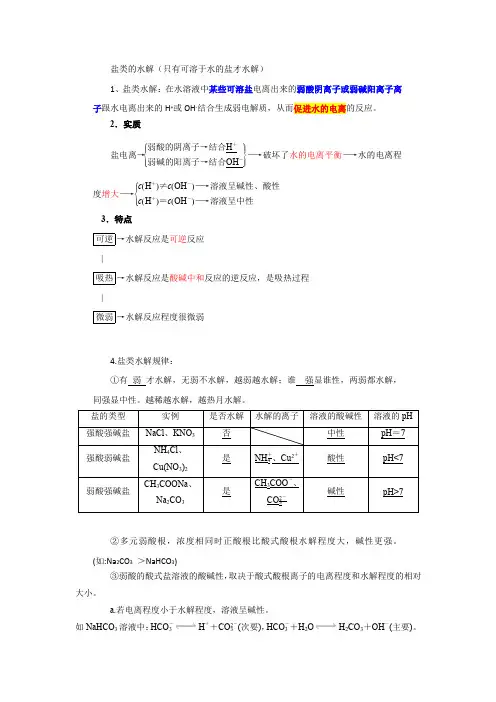
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。

一、盐类的水解 1.定义2.实质酸碱中和反应的逆反应,盐类的水解是 反应。
3.盐类水解离子方程式的书写(1)在书写盐类水解方程式时一般要用“______”号连接,产物不标....“↑”...或.“↓”...,其一般形式为:盐+水酸+碱(2)书写规律○1一般盐类水解程度很小,水解产物很少,即使产物易分解也不写其分解形式,如: NH 4Cl 的水解离子方程式:○2多元弱酸盐的水解分步进行,以第一步为主,如: Na 2CO 3的水解离子方程式: Na 3PO 4的水解离子方程式: ○3多元弱碱阳离子的水解方程式一步完成,如: FeCl 3的水解离子方程式:○4双水解方程式的书写:弱酸弱碱盐中阴、阳离子相互促进水解,称为双水解。
由于阴、阳离子相互促进,水解程度较大,书写时要用“===”、“↑”、“↓” 高中阶段常见的能发生双水解的离子对有: Al 3+与HCO 3-、CO 32-、HS -、S 2-、AlO 2-等; Fe 3+与HCO 3-、CO 32-等;○5弱酸酸式酸根既发生电离,又发生水解;强酸酸式酸根只电离不水解 如HCO 3-既发生电离,又发生水解4.规律(1)有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。
(2)组成盐的酸越弱,水解程度越大如:物质的量浓度相同的两种盐溶液,NaA 和NaB ,其溶液的pH 前者大于后者,则酸HA 和HB 的相对强弱为HB>HA ,这条规律可用于利用盐的pH 值判断酸性的强弱。
酸的强弱顺序:H 2SO 3> H 3PO 4>HF>HNO 2>HCOOH>CH 3COOH>H 2CO 3>苯酚>H 2S>HCN>HClO (亚硫磷酸氢氟酸,亚硝甲酸冰醋酸,碳酸氢硫氢氰酸)(3)同浓度的正盐与其酸式盐相比,正盐的水解程度比酸式盐的水解程度大。
如:同浓度的Na 2CO 3与NaHCO 3相比,的水解程度更大。

教学过程一、复习预习复习电解质的概念和弱电解质的电离二、知识讲解考点1盐类的水解(1)盐类水解的实质:在溶液中,由于盐的离子与水电离出来的H+或OH+结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离方向移动,显示出不同的酸性、碱性或中性。
(2) 盐类水解的特点:有弱才水解、无弱不水解;越弱越水解、都弱都水解;谁强显谁性、同强显中性。
注意:a.弱酸弱碱盐也能水解,如CH3COONH4、(NH4)2S水解程度较NH4Cl、CH3COONa大,溶液中存在水解平衡,但不能水解完全.水解后溶液的酸、碱性由1水解生成酸、碱的相对强弱决定,如CH3COONH4溶液pH=7。
b.酸式盐是显酸性还是显碱性,要看其电离和水解的相对强弱.若电解能力比水解能力强,则水溶液显酸性,如NaHSO3、NaH2PO4,NaHSO4只电离不水解也显酸性.若水解能力超过电离能力,则水溶液显碱性,如NaHCO3、Na2HPO4、NaHS。
考点2 影响盐类水解的因素内因:盐本身的性质外因:温度:盐的水解是吸热反应,因此升高温度,水解程度增大。
浓度:稀释盐溶液,可以促进水解,盐的浓度越小,水解程度越大。
外加酸碱:外加酸碱能促进或抑制盐的水解。
以FeCl3和CH3COONa为例a.Fe3++3H2O Fe(OH)3+3H+条件移动方向H+数pHFe3+水解率现象升高温度向右增降增大颜色变深(黄变红棕)通HCl 向左增降减小颜色变浅加H2O向右增升增大颜色变浅加Mg粉向右减升增大红褐色沉淀,无色气体加NaHCO3向右减升增大红褐色沉淀,无色气体加少量NaF 向右减升增大颜色变深加少量NaOH向右减升增大红褐色沉淀b.CH3COO-+H2OCH3COOH + OH-c(CH3COO-)c(CH3COOHc(OH-) c(H+) pH水解程度1考点3溶液中离子浓度大小比较(1)不同溶液中同一离子浓度的大小比较,要考虑溶液中其他离子对该离子的影响。

一、电离平衡理论和水解平衡理论1.电离理论:⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;⑵多元弱酸的电离是分步的,主要以第一步电离为主;2.水解理论:从盐类的水解的特征分析:水解程度是微弱的(一般不超过2‰)。
例如:NaHCO3溶液中,c(HCO3―)>>c(H2CO3)或c(OH― ) 理清溶液中的平衡关系并分清主次:⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+) > c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。
守恒作为自然界的普遍规律,是人类征服改造自然的过程中对客观世界抽象概括的结果。
在物质变化的过程中守恒关系是最基本也是本质的关系之一,化学的学习若能建构守恒思想,善于抓住物质变化时某一特定量的固定不变,可对化学问题做到微观分析,宏观把握,达到简化解题步骤,既快又准地解决化学问题之效。
守恒在化学中的涉及面宽,应用范围极广,熟练地应用守恒思想无疑是解决处理化学问题的重要方法工具。
守恒思想是一种重要的化学思想,其实质就是抓住物质变化中的某一个特定恒量进行分析,不探究某些细枝末节,不考虑途径变化,只考虑反应体系中某些组分相互作用前后某种物理量或化学量的始态和终态。
利用守恒思想解题可以达到化繁为简,化难为易,加快解题速度,提高解题能力,对溶液中离子浓度大小进行比较可以用守恒法。
有关溶液中离子浓度大小比较的问题是中学化学中常见问题。

【考点精讲】虽然电解质在水溶液中可能发生电离、水解等多种变化,使各种分子、离子浓度的计算和比较变得错综复杂,但只要抓住“电荷守恒”“元素(物料)守恒”“质子守恒”这三个守恒关系,进行准确分析,这些问题就会迎刃而解。
一、电荷守恒是指溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等。
即溶液永远是电中性的,所以阳离子带的正电荷总量=阴离子带的负电荷总量1. 溶液必须保持电中性,即溶液中所有阳离子所带的电荷数等于所有阴离子所带的电荷数。
2. 除六大强酸、四大强碱外都水解,多元弱酸部分水解。
产物中有分步水解产物。
3. 这个离子所带的电荷数是多少,离子前就写几。
例如:Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO3 2-)写这个等式要注意两点:1. 要准确判断溶液中存在的所有离子,不能漏掉。
2. 注意离子自身带的电荷数目。
例如:NaHCO3溶液:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH-)NaOH溶液:c(Na+)+ c(H+)= c(OH-)Na3PO4溶液:c(Na+)+ c(H+)= 3c(PO43-)+ 2c(HPO42-)+ c(H2PO4-)+ c(OH-)注意:(1)正确分析溶液中存在的阴、阳离子是书写电荷守恒式的关键,需要结合电解质电离及盐类的水解知识,尤其是对多级电离或多级水解,不能有所遗漏。
如Na2CO3溶液中存在如下电离和水解平衡:Na2CO3= 2 Na+ +CO32-;CO32-+ H2O HCO3-+OH-;HCO3-+H2O H2CO3 +OH-;H2O H++OH-。
所以溶液中阳离子有:Na+、H+,阴离子有:CO32-、HCO3-、OH-。
(2)结合阴、阳离子的数目及其所带的电荷可以写出:N(Na+)+N(H+)= 2N(CO32-)+ N( HCO3-)+ N(OH-)(3)将上式两边同时除以N A得:n(Na+)+n(H+)=2n(CO32-)+ n(HCO3-)+ n(OH-);再同时除以溶液体积V 得:C(Na+)+C(H+)= 2C(CO32-)+ C(HCO3-)+ C(OH-),这就是Na2CO3溶液的电荷守恒式。


盐类的水解知识点总结1盐类的水解 1(复习重点1(盐类的水解原理及其应用2(溶液中微粒间的相互关系及守恒原理2(难点聚焦(一) 盐的水解实质+— HO H+OH 2n— n+AB== B+ A(n—1)— HBA(OH) nn—n++—当盐AB能电离出弱酸阴离子(B)或弱碱阳离子(A),即可与水电离出的H或OH结合成电解质分子,从而促进水进一步电离.与中和反应的关系: 水解盐+水酸+碱(两者至少有一为弱) 中和由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为:1(正盐溶液强酸弱碱盐呈酸性强碱弱酸盐呈碱性强酸强碱盐呈中性弱酸碱盐不一定如 NHCN CHCONH NHF 43244碱性中性酸性取决于弱酸弱碱相对强弱2(酸式盐2若只有电离而无水解,则呈酸性(如NaHSO) 4?若既有电离又有水解,取决于两者相对大小电离程度,水解程度,呈酸性电离程度,水解程度,呈碱性强碱弱酸式盐的电离和水解:如HPO及其三种阴离子随溶液pH变化可相互转化: 34pH值增大—2—3— HPO HPO HPO PO 342444pH减小常见酸式盐溶液的酸碱性碱性:NaHCO、NaHS、NaHPO、NaHS. 324酸性(很特殊,电离大于水解):NaHSO、NaHPO、NaHSO 3244(三)影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化1)温度不变,浓度越小,水解程度越大. ((2)浓度不变,湿度越高,水解程度越大. (3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的影响.+——— HA H+A—Q A+HO HA+OH—Q 2温度(T)T??α? T??h?加水平衡正移,α? 促进水解,h?+增大[H] 抑制电离,α? 促进水解,h?—增大[OH]促进电离,α? 抑制水解,h?—增大[A] 抑制电离,α? 水解程度,h? 注:α—电离程度 h—水解程度思考:?弱酸的电离和弱酸根离子的水解互为可逆吗,在CHCOOH和CHCOONO的溶液中分别加入少量冰醋酸,对CHCOOH电离程度和3323—CHCOO水解程度各有何影响, 3(五)盐类水解原理的应用考点 1(判断或解释盐溶液的酸碱性例如:?正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、3HZ的酸性强弱的顺序是________________ ?相同条件下,测得?NaHCO ?CHCOONa ?NaAlO三种溶液的pH值相同。
(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
高三化学晚读解题技巧【盐类的水解平衡】1-盐类水解的实质是*盐电离的某种离子与水电离的H*或OIT结合成弱电解质*打破了水的电离平窗,促使水的电离平衡向正方向移动,量后,[in与[6T]发生相对的变化,使溶液分别显酸性或碱性.如果赴的离子不能与水电离的H*或0H■结合成弱电解;S,则这种盐就不能发生水解.(1)盐的水解反应都是微弱的,其过程是可逆的、绝大多数是吸热的。
(2)盐的水解是促进水的电离的。
在常温下*某濬液中由水'电离的阿或[OHpixi(yf ol/L时,该溶液是能水解的盐的溶液.①在水解显酸性的'盐落裁中,闫]〔溶液)叫药(HQ〉:②在水解显礪性的溶液中,[W]■(溶液)=[曲I伽0人<3)水解反应的离子方程式的书写①水解反匯是可逆的"要甬可逆符号表示.②水解是橄弱的,水解生成的难溶物、易挥发的物质,不要标沉淀或气体符号.③水解是酸根离子结合才的过程.可以看作酸电离的逆过程。
多元弱酸的电离是分步进行的,多元弱BS根离子的水解也艇分步进行的.其水鮮的离子方程式也要分步写出.例如,N鲨C0$水解的离子方程式为;CO? 4- HaO^F^HCCh + Off (一级水解)HCOf + H2O^=^H3CO J + OH-(二级水解)(4)多元弱酸弱Mt根离子的水解的程度是逐级减小的。
在Na2CO3 IS液中,各种离子浓度由大到小的关系屋:[NmcWp(OH1 AfHCOjPfH4]・同温同玻度的NajCCh和NaHCCh濬液比较・Na3CO,瘪液的碱性比NaHCOj # 液的破性强*(5)盐的水解与组成盐的酸和橄的强弱有关。
盐水解后溶液的酸碱性要由水解生成的酸和減的相对强弱来决定*若酸的电离平衡常数大于碱的电离平衡常数,溶衆显酸性:若碱的电离平衡常数大于酸的电离平衡常数,溶液显械性:若酸的电离平衡常数等于碱的电离平衡常数, 溶液显中性.CH3COONH4溶蔽显中性,常温下pH=7-<6)常见的能发生双水解的离子有:①A广与S*\ HS\ C0>*\ HC&\ SOA C10\ Alft\ SiOs?":②F』与CO?、HCO,\ C10\ SiGH AlQtt③NH(与SA Si(V\ A1Q、C10\盐Sf和硝酸笹挥发性的弱碱盐(如’ AlCd FtCh、Al(NOi)3. Fe(NO必、CuCi3 等,不能用蒸干溶液的方法得到.2.影响盐的水解的因素(1)影响盐的水解平衡的内因是盐的组成组成盐的酸越弱,其弱酸根离子就越容易水解,含有这种弱酸根离子的盐的水溶液碱性就検强,溶液的pH就越大;组成盐的碱越弱,其弱碱根离子就越容易水解,含有这种弱碱根离子的盐的水洛液酸性就越强,溶液的pH就越小。
高考复习盐类的水解及离子浓度大小比较知识点一、盐类的水解1.越弱越水解:如果生成弱电解质的倾向越大,对水电离平衡的影响越大,则水解程度越大。
如果生成盐的弱酸(或弱碱)越弱,则该盐的水解程度越大,碱性(或酸性)越强,如碳酸钠和醋酸钠。
2.水解反应是吸热反应,越热越水解。
3.越稀越水解。
4.应用:(1)判断盐溶液的酸碱性时要考虑盐类的水解(2)判断溶液中离子种类和浓度大小(3)判断溶液中离子能否大量共存时,有时要考虑盐类的水解,如Al3+、Fe3+与HCO3-、CO32-、AlO2-、SO32-、S2-、SiO32-不能大量共存,还有NH4+不能和AlO2-、S2-、SiO32-,因为发生双水解。
但是NH4+和CO32-可以大量共存。
(4)加热浓缩某些盐溶液时,要考虑水解:①考虑盐是否分解,如加热蒸干Ca(HCO3)2溶液,因为其受热分解,所得固体应该是CaCO3。
②考虑氧化还原反应,如加热蒸干Na2SO3溶液,所得固体应该是Na2SO4。
③盐水解生成挥发性酸时,蒸干后一般得到弱碱。
如蒸干AlCl3溶液,但是蒸干Al2(SO4)2时,得到原物质。
延伸:如何从AlCl3溶液中得到AlCl3结晶?④盐水解得到强碱时,蒸干后得到原物质,如Na2CO3溶液。
⑤有时要多方面考虑,加热蒸干NaClO溶液时,发生歧化反应,得到NaCl和NaClO3两种固体的混合物。
(5)生活中的应用,如明矾净水,泡沫灭火器原理:Al3++3HCO3-二、酸式盐溶液酸碱性的判断1.强酸的酸式盐只电离不水解。
2.弱酸的酸式盐:(1)电离程度<水解程度,则以水解为主(2)电离程度>水解程度,则以电离为主:NaH2PO4NaHSO3三、离子浓度大小比较方法1.考虑水解因素,如Na2CO32.综合分析:相同浓度的NH4Cl和NH3·H2O的混合溶液,因为NH3·H2O 的电离>NH4Cl的水解,所以离子浓度NH4+>Cl->OH->H+3.电解质溶液中的离子之间存在着三种定量关系:(1)物料守恒:以Na2CO3、NaH2PO4为例。