无机化学6.2 电极电势的应用
- 格式:ppt
- 大小:1.91 MB
- 文档页数:2


电极电势的应用电极电势是分析电性物质在电场环境中表现特性的重要工具,电极电势的应用在电化学研究中发挥着重要作用。
1.极电势的基本概念电极电势是指某一特定电极处的电位,是衡量电解质的基本概念,可以用数字表示。
它是一种特定电极对一定电解质含量环境下所产生的电动势差,它反映着电极间的电荷转移,可以用于分析电化学反应的热力学和动力学性质。
2.极电势的应用(1)确定电极的电动势电极电势可以用来测量电极的电动势,并可以确定电极的工作电势,从而可以使用正确的电动势对电解质进行电解。
(2)诊断电化学反应的热力学电极电势可以用来检测电化学反应的热力学动力学特性,可以用来确定电荷转化的活化能,可以用来研究电解质的析出率,以及与其他电解质相关的反应活性等。
(3)诊断电化学反应的动力学电极电势也可以用来检测电化学反应的动力学特性,可以用来研究电解质的析出速率,以及与其他电解质相关的反应动力学过程。
(4)研究电解质的迁移电极电势可以用来研究电解质的迁移过程,比如在载体电极介质中测量电解质的迁移动力,从而诊断其对载体材料的特性,从而得出该载体对电解质的适宜性。
3.极电势的影响因素电极电势受诸多因素影响,若想准确测量电极电势,就应注意以下几点:(1)电极材料的选择,应根据所测量的物质种类选择合适的电极材料,以减小错误的影响。
(2)操作方法,在操作时要避免电极光滑,以防止极电势发生改变。
(3)环境条件,应在室温和正常压强下操作,以减小环境因素对实验结果的影响。
(4)电极电路的结构,在测量测试时,电极电路的结构也是十分重要的,应特别注意电极的结构特性,以准确测量出电极电势。
4.论电极电势是分析电性物质在电场环境中表现特性的重要工具,在电化学研究中发挥着重要作用。
电极电势的应用包括:确定电极的电动势、诊断电化学反应的热力学和动力学特性、研究电解质的迁移。
在测量电极电势时,应特别注意电极材料的选择、操作方法、环境条件、电极电路的结构等因素,以减小误差,得出准确测试结果。


电极电势在很多领域中都有应用。
下面是一些例子:1 在电化学分析中,电极电势可以用来测量物质的还原性或氧化性。
例如,在电解质溶液中,可以测量电极电势来确定溶液中的某些物质是否还原或氧化。
2 在工业生产中,电极电势可以用来控制化学反应的速度和方向。
例如,在镀银工艺中,可以通过调整电极电势来控制镀银的速度,从而获得理想的镀银质量。
3 在医疗设备中,电极电势也被广泛应用。
例如,心电图仪和脑电图仪都使用电极来测量人体内电活动的电势差,从而确定健康状况。
4 在动力电池中,电极电势也起着重要作用。
例如,在锂离子电池中,电极电势的差异可以决定电池的充电速度和放电速度。
5在环境监测中,电极电势也被用来测量环境中的某些化学物质的浓度。
例如,可以使用电极测定水中的溶解氧浓度,从而确定水的生态状态。
6 6 在食品加工中,电极电势也可以用来检测食品中的某些物质的浓度。
例如,在酿造过程中,可以使用电极测定果汁中的糖浓度,从而确定果汁的发酵程度。
7 在农业生产中,电极电势也被用来测量土壤中的某些养分的浓度。
例如,可以使用电极测定土壤中氮的浓度,从而决定土壤的肥力水平。
8 在钢铁加工中,电极电势也可以用来控制电弧焊接过程。
例如,在电弧焊接钢管时,可以通过调整电极电势来控制焊接速度和焊接质量。
9 在电力系统中,电极电势也起着重要作用。
例如,在变压器中,电极电势的差异可以决定电流的变化率。
10在半导体制造中,电极电势也被用来控制化学反应的速度和方向。
例如,在半导体晶体管的制造过程中,可以通过调整电极电势来控制化学蚀刻过程,从而获得理想的半导体晶体管尺寸和形状。


电极电势在无机化学中的应用(共2篇)本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意!第1篇:电极电势在无机化学中的应用氧化还原反应是化学中的重要反应。
原电池中,两个电极用导线连接,并用盐桥将电解液连接,导线中就有电流通过,这说明两个电极上具有电势存在,并且两极之间具有电势差,这种电极上所具有的电势就称电极电势,用渍厮表示。
电极电势可用来衡量金属在水溶液中失去电子能力的大小,金属电极电势的高低主要决定于金属的种类、金属离子的浓度和溶液的温度。
当外界条件一定时,对金属电极,其电势高低决定于金属活泼性的大小,金属越活泼,达到平衡时,电极的金属片单位面积上积累的负电荷就越多,电极相对于溶液的电势就越负,电极电势就越低;相反,金属越不活泼,溶解倾向则越小,电极电势就越高。
一、电极电势在氧化还原反应中的应用1.判断氧化剂和还原剂的相对强弱由金属电极电势的产生可知,标准电极电势数值越小,表明还原态越易失去电子,即其还原态的还原性越强,氧化态的氧化性越弱;渍厮值越大,表明氧化态越易得电子,即氧化剂是越强的氧化剂,还原剂就是越弱的还原剂。
例如,渍■■=-,渍■■=∵>-∴Cu2+的氧化性大于Zn2+.∵-Cu2.判断氧化还原反应进行的方向[1]例1.试用标准电极电势判断Zn+Cu2+=Zn2++Cu 反应能否自发向右进行。
已知渍■■=-渍■■=解:要使反应能自发向右进行,必须其标准电动势E厮>0,否则E厮0∴反应能自发向右进行。
或按氧化剂和还原剂的相对强弱判断。
氧化还原反应发生在较强的氧化剂和较强的还原剂之间。
例2.试用标准电极电势判断I2+2Fe2+=2Fe3++2I-反应进行的方向。
已知:渍■■=,渍■■=解:E厮=渍■■-渍■■==<0,∴反应向左进行。
3.选择氧化剂和还原剂例如,含有Cl-、Br-和I-三种离子的混合溶液,欲使I-氧化为I2又不致使Br-、Cl-氧化,在常用的氧化剂Fe2(SO4)3和KMnO4中选择哪一种能符合上述要求?解:查表知:渍■■=,渍■■=,渍■■=,渍■■=,渍■■=可见,渍■■值最大,是最强的氧化剂,可将I-、Br-、Cl-分别氧化成I2,Br2、Cl2,∴KNMO4不符合上述要求。
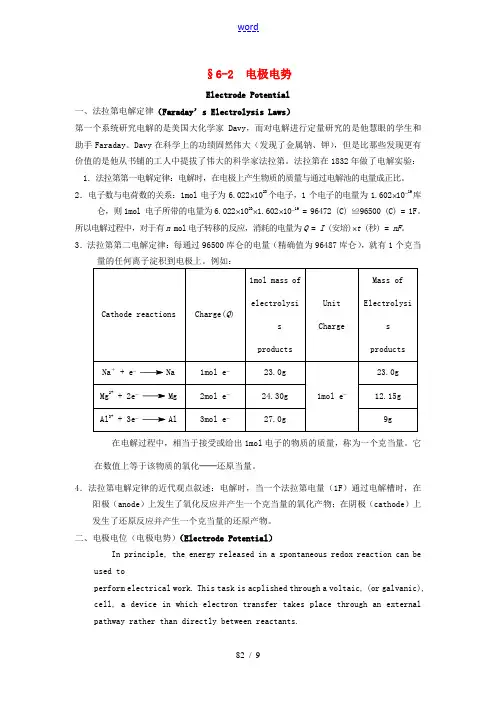
§6-2 电极电势Electrode Potential一、法拉第电解定律(Faraday’s Electrolysis Laws)第一个系统研究电解的是美国大化学家Davy,而对电解进行定量研究的是他慧眼的学生和助手Faraday。
Davy在科学上的功绩固然伟大(发现了金属钠、钾),但是比那些发现更有价值的是他从书铺的工人中提拔了伟大的科学家法拉第。
法拉第在1832年做了电解实验:1.法拉第第一电解定律:电解时,在电极上产生物质的质量与通过电解池的电量成正比。
2.电子数与电荷数的关系:1mol电子为6.022⨯1023个电子,1个电子的电量为1.602⨯10-19库仑,则1mol 电子所带的电量为6.022⨯1023⨯1.602⨯10-19= 96472 (C) ≌96500 (C) = 1F。
所以电解过程中,对于有n mol电子转移的反应,消耗的电量为Q = I (安培)⨯t (秒) = nF。
3.法拉第第二电解定律:每通过96500库仑的电量(精确值为96487库仑),就有1个克当在电解过程中,相当于接受或给出1mol电子的物质的质量,称为一个克当量。
它在数值上等于该物质的氧化──还原当量。
4.法拉第电解定律的近代观点叙述:电解时,当一个法拉第电量(1F)通过电解槽时,在阳极(anode)上发生了氧化反应并产生一个克当量的氧化产物;在阴极(cathode)上发生了还原反应并产生一个克当量的还原产物。
二、电极电位(电极电势)(Electrode Potential)In principle, the energy released in a spontaneous redox reaction can be used toperform electrical work. This task is acplished through a voltaic, (or galvanic), cell, a device in which electron transfer takes place through an external pathway rather than directly between reactants.1.原电池(Galvanic cell )(1)组成(position ):原电池的负极(negative pole )──氧化反应(oxidation ),原电池的正极(positive pole )──还原反应(reduction )a .金属──金属离子电极:Zn 2+── Zn Cu 2+── Cu ,选择金属本身作电极; b .气体──离子电极:Cl 2── Cl -,选择惰性金属或碳棒作电极; c .金属──金属难溶盐或氧化物──阴离子电极:Hg -Hg 2Cl 2| Cl -,Ag -AgCl | Cl -。


《无机化学》各章小结第一章绪论平衡理论:四大平衡理论部分原子结构1.无机化学结构理论:,分子结构,晶体结构元素化合物2.基本概念:体系,环境,焓变,热化学方程式,标准态古代化学3.化学发展史:近代化学现代化学第二章化学反应速率和化学平衡1.化学反应速率υ=Δc(A)Δt2.质量作用定律元反应aA + Bb Yy + Zzυ = k c (A) c (B)a b3.影响化学反应速率的因素: 温度, 浓度, 催化剂, 其它.温度是影响反应速率的重要因素之一。
温度升高会加速反应的进行;温度降低又会减慢反应的进行。
浓度对反应速率的影响是增加反应物浓度或减少生成物浓度,都会影响反应速率。
催化剂可以改变反应速率。
其他因素,如相接触面等。
在非均匀系统中进行的反应,如固体和液体,固体和气体或液体和气体的反应等,除了上述的几种因素外,还与反应物的接触面的大小和接触机会有关。
超声波、紫外线、激光和高能射线等会对某些反应的速率产生影响4.化学反应理论: 碰撞理论, 过渡态理论碰撞理论有两个要点:恰当取向,足够的能量。
过渡态理论主要应用于有机化学。
5.化学平衡: 标准平衡常数, 多重平衡规则, 化学平衡移动及其影响因素(1)平衡常数为一可逆反应的特征常数,是一定条件下可逆反应进行程度的标度。
对同类反应而言,K值越大,反应朝正向进行的程度越大,反应进行的越完全(2)书写和应用平衡常数须注意以下几点a. 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。
生成物为分子项,反应物为分母项,式中各物质浓度或分压的指数,就是反应方程式中相应的化学计量数。
气体只可以用分压表示,而不能用浓度表示,这与气体规定的标准状态有关。
b.平衡常数表达式必须与计量方程式相对应,同一化学反应以不同计量方程式表示时,平衡常数表达式不同,其数值也不同。
c.反应式中若有纯故态、纯液态,他们的浓度在平衡常数表达式中不必列出。
在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必出现在平衡关系式中。


第二节电极电势第六章 氧化还原反应电化学基础无机化学多媒体电子教案第四节 电极电势的应用6-4 电极电势的应用1.1.判断原电池的正、负极计算原电池的判断原电池的正、负极计算原电池的电动势2.2.判断氧化剂、还原剂的相对强弱判断氧化剂、还原剂的相对强弱3.3.判断氧化还原反应的方向判断氧化还原反应的方向4.4.判断氧化还原反应的限度判断氧化还原反应的限度5.5.计算难溶电解质溶度积计算难溶电解质溶度积计算难溶电解质溶度积((Ksp Ksp ))原电池中原电池中,,E (+)>E (-);电动势E =E (+)-E (-)例1:1:由电对由电对Fe 3+/Fe 2+、Sn 4+/Sn 2+构成原电池构成原电池,, 判断原电池正判断原电池正、负极负极,,计算其标准电动势(1)(1)在标准态下:只需比较在标准态下:只需比较E (+)极 (-)极∨电动势电动势 E =E (+)-E (-)= 0.771V -0.154V = 0.617V解:E (Fe 3+/Fe 2+)=+0.771 V E (Sn 4+/Sn 2+)=+0.154 V )=+0.154 V 原电池符号: (-)Pt | (-)Pt | SnSn 2+(1mol ⋅L -1), Sn 4+(1mol ⋅L - 1) Fe 3+(1mol ⋅L -1), Fe 2+(1mol ⋅L-1) | Pt (+)原电池中原电池中,,E (+)>E (-); 电动势E =E (+)-E (-)(1)(1)在标准态下:只需比较在标准态下:只需比较E (2)(2)非标准态:先根据非标准态:先根据Nernst 方程计 算出算出E , , 然后再比较两个然后再比较两个E 值例2:试比较:试比较KMnO 4、Cl 2、FeCl 3 在酸性介质中的氧化能力在酸性介质中的氧化能力氧化能力:KMnO 4 > Cl 2 > FeCl 3越大,电对中氧化型物质的氧化能力越强 还原型物质的还原能力越弱 越小,电对中还原型物质的还原能力越强 氧化型物质的氧化能力越弱 EE 解:0.7711.35831.51E /V Fe 3+/Fe 2+Cl 2/Cl -MnO 4 /Mn 2+电对>>-例3:试比较:试比较SnCl 2、Zn 、H 2S 在酸性 介质中的还原能力介质中的还原能力还原能力:Zn > H 2S > SnCl 2越大,电对中氧化型物质的氧化能力越强 还原型物质的还原能力越弱 越小,电对中还原型物质的还原能力越强 氧化型物质的氧化能力越弱 E E 解:0.1540.144-0.7626E /V Sn 4+/Sn 2+S/S/ H H 2S Zn 2+/Zn 电对<<化学反应自发进行的判据 ∆r G m < 0 而 ∆r G m = -nFE电池反应中转移的电子数法拉第常数1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据化学反应自发进行的条件 ∆r G m < 0∆r G m < 0E > 0 或 E (氧化剂)>E (还原剂)∆r G m = -nFE1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据E > 0 ;E (氧化剂)>E (还原剂)氧化还原反应的规律:氧化剂氧化剂 还原剂 还原剂还原剂还原剂氧化剂较强较强 较强 较弱较弱较弱 较弱++反应自发向右进行>E > 0 ;E (氧化剂)>E (还原剂)1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据Sn 2+/Sn-0.136V-0.126V Pb 2+/Pb 电对E /V 例1 1 试判断下列反应试判断下列反应试判断下列反应::Pb 2++ + Sn Sn Sn Pb Pb Pb + Sn + Sn 2+ 在标准态时反应自发进行的方向只需比较E ( (氧化剂氧化剂氧化剂))和E ( (还原剂还原剂还原剂))大小(1) (1) 标准态时标准态时(1) 标准态时先根据先根据先根据Nernst Nernst Nernst方程求出方程求出E (电对电对),),),再比较再比较E (氧化剂)和E (还原剂)(2) (2) 非非标准态时(2) (2) 非非标准态时E > 0 ;E (氧化剂)>E (还原剂)c (Pb 2+) 0.0010c (Sn 2+) 1.0例2 2 试判断下列反应试判断下列反应试判断下列反应::Pb 2++ + Sn Sn Sn Pb Pb Pb + Sn+ Sn 2+ 在 = = 时反应自发进行的方向 1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据0.0592V 2= -0.126V + = -0.126V + lg lg lg 0.00100.0010= -0.215VE (Pb 2+/Pb)=E (Pb 2+/Pb)+ /Pb)+ lg lg lg [[c (Pb 2+)/c ]0.0592V 2先根据先根据先根据Nernst Nernst Nernst方程求出方程求出E (电对电对),),),再计算电动势再计算电动势E 或比较E (电对)(2) (2) 非非标准态时(2) (2) 非非标准态时c (Pb 2+) 0.0010c (Sn 2+) 1.0-0.136-0.215-0.126 E (Sn 2+/Sn)/VE (Pb 2+/Pb)/V E (Pb 2+/Pb)/V E > 0 ;E (氧化剂)>E (还原剂)例2 2 试判断下列反应试判断下列反应试判断下列反应::Pb 2++ + Sn Sn Sn Pb Pb Pb + Sn + Sn 2+ 在 = = 时反应自发进行的方向 1.1.氧化还原反应自发进行的判据氧化还原反应自发进行的判据反应自发向左进行<反应首先发生在电极电势差值较大的两个电对之间电极电势差值较大的两个电对之间 反应首先发生在电极电势差值较大的两个电对之间在在Br - 和I - 的混合溶液中加入Cl 2 ,哪种离子先被氧化哪种离子先被氧化??反应首先在Cl 2 和I -之间进行2. 2. 氧化还原反应进行的次序氧化还原反应进行的次序0.53551.0651.3583I 2/ I -Br 2/Br -Cl 2/Cl -电对E解{E (Cl 2/Cl -) -E (Br 2/Br -)}<{E (Cl 2/Cl -)-E (I 2/ I -)}例从氧化剂Fe 2(SO 4)3和KMnO 4中选择一种合适的氧化剂一种合适的氧化剂,,使含有使含有ClCl -、Br - 和I -混合溶液中的合溶液中的I I -被氧化被氧化,,而Cl -、Br -不被氧化3. 3. 选择合适的氧化剂或还原剂选择合适的氧化剂或还原剂KMnO 4不可采用<<<E (MnO 4 /Mn 2+)解E 1.51MnO 4 /Mn 2+0.771Fe 3+/Fe 2+1.3583Cl 2/Cl - 1.065Br 2/Br -0.5355I 2/ I - /V/V 电对--例从氧化剂Fe 2(SO 4)3和KMnO 4中选择一种合适的氧化剂一种合适的氧化剂,,使含有使含有ClCl -、Br - 和I -混合溶液中的合溶液中的I I -被氧化被氧化,,而Cl -、Br -不被氧化例4. 4. 选择合适的氧化剂或还原剂选择合适的氧化剂或还原剂243可采用Fe 2(SO 4)3<>>E (Fe 3+/Fe 2+)解E 1.51MnO 4 /Mn 2+0.771Fe 3+/Fe 2+1.3583Cl 2/Cl - 1.065Br 2/Br -0.5355I 2/ I - /V/V 电对-∆r G m -n FE lg K = - = -2.303RT 2.303RT RTR = 8.314 J ⋅ K -1 ⋅mol -1 , T = 298.15 = 298.15 KK F = 96485 J ⋅ V -1 6-4-4 判断氧化还原反应的限度氧化还原反应的平衡常数( )只与标准电动势只与标准电动势( )( )( )有关有关有关,,与物质浓度无关E K E lg lg = = = = K 0.0592V 0.0592V n { (+)- (-)}E E n 氧化还原反应中转移电子数 值越大值越大值越大, , , 值越大值越大值越大,,正反应进行得越完全E Klg lg = = = = K 0.0592V 0.0592V反应:Pb 2++Sn +Sn Pb Pb Pb +Sn+Sn 2+ , 计算平衡常数;若平衡常数;若反应开始时反应开始时(Pb 2+)=2.0mol ⋅L -1,计算达平衡时Pb 2+和Sn 2+的浓度。
《无机化学》各章小结第一章绪论平衡理论:四大平衡理论部分原子结构1.无机化学,分子结构,晶体结构元素化合物2.基本概念:体系,环境,焓变,热化学方程式,标准态古代化学3.化学发展史:近代化学现代化学第二章化学反应速率和化学平衡1.化学反应速率υ=Δc(A)Δt2.质量作用定律元反应aA + Bb Yy + Zzυ = k c (A) c (B)a b3.影响化学反应速率的因素: 温度, 浓度, 催化剂, 其它.温度是影响反应速率的重要因素之一。
温度升高会加速反应的进行;温度降低又会减慢反应的进行。
浓度对反应速率的影响是增加反应物浓度或减少生成物浓度,都会影响反应速率。
催化剂可以改变反应速率。
其他因素,如相接触面等。
在非均匀系统中进行的反应,如固体和液体,固体和气体或液体和气体的反应等,除了上述的几种因素外,还与反应物的接触面的大小和接触机会有关。
超声波、紫外线、激光和高能射线等会对某些反应的速率产生影响4.化学反应理论: 碰撞理论, 过渡态理论碰撞理论有两个要点:恰当取向,足够的能量。
过渡态理论主要应用于有机化学。
5.化学平衡: 标准平衡常数, 多重平衡规则, 化学平衡移动及其影响因素(1)平衡常数为一可逆反应的特征常数,是一定条件下可逆反应进行程度的标度。
对同类反应而言,K值越大,反应朝正向进行的程度越大,反应进行的越完全(2)书写和应用平衡常数须注意以下几点a. 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。
生成物为分子项,反应物为分母项,式中各物质浓度或分压的指数,就是反应方程式中相应的化学计量数。
气体只可以用分压表示,而不能用浓度表示,这与气体规定的标准状态有关。
b.平衡常数表达式必须与计量方程式相对应,同一化学反应以不同计量方程式表示时,平衡常数表达式不同,其数值也不同。
c.反应式中若有纯故态、纯液态,他们的浓度在平衡常数表达式中不必列出。
在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必出现在平衡关系式中。
电极电势的应用
电极电势是电化学实验中经常使用的量,它与测量物质在一定条件下的电子迁移特性
有关。
它可以用于研究物质间的交互作用,广泛应用在电学传感器、电磁技术、电化学传
感器、仪器仪表等行业中。
首先,电极电势主要用于氧化还原反应的相关应用。
在溶液中,还原剂和氧化剂之间
存在电位差,可以利用电极电势来直接测量反应活性和稳定性。
电极电势测量也可以用于
电催化反应的研究,它可以用来解释催化剂的电子成份和活性中心的变化。
电催化反应过
程中,催化剂的电子结构会不断发生变化,改变电极电势就可以说明这种变化剂。
此外,电极电势还被用于研究电磁性能,尤其是多金属器件的磁性能。
对于这类器件,比如电容器、变压器和线圈等,需要考虑它们的电磁耦合问题,调节电极电势就可以改变
这些器件的电磁性能。
此外,电极电势也可以用于无线传感器和无线通讯系统的研究,调
节这些系统的电极电势可以改善传输距离或其他性能。
最后,电极电势也可以用于计量学和电动机研究。
电极电势可用来衡量各种测量介质
的电子状态,如液体、气体、溶液等。
此外,在研究电动机时,需要电极电势来定义绝缘
两端的电压差,以便进行电流测量和调节电动机。
因此,电极电势在电化学分析、计量学以及电子和电动机研究中都有广泛的应用,它
可以反映物质的内部结构和物理性质,十分重要。