9.3平衡蒸馏和简单蒸馏
- 格式:ppt
- 大小:3.13 MB
- 文档页数:83

化工原理陈敏恒第三版上册答案【篇一:化工原理答案第三版思考题陈敏恒】lass=txt>传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持f,q,xf,d不变,(1)若采用回流比r小于最小回流比rmin,则xd减小,xw增大(2)若r增大,则xd增大, xw减小 ,l/v增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态f,xf,q不变,则l/v变小,xd变小,xw变小。
10、精馏塔设计时采用的参数f,q,xf,d,xd,r均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为f,xf,要求塔顶为xd,塔底为xw,设计时若已定的塔釜上升蒸汽量v’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数nt 增加,精馏段上升蒸汽量v 减少,精馏段下降液体量l 减少,提馏段下降液体量l’ 不变。
(增加、不变、减少)不变,增大xf,,则:d 12、操作中的精馏塔,保持f,q,xd,xw,v’,变大,r变小,l/v变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离?萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。

简单蒸馏与平衡蒸馏比较的一种定性分析方法万惠萍;尉志苹【摘要】简单蒸馏和平衡蒸馏是蒸馏操作的两种方法,用定量的计算来进行这两种蒸馏方法的比较很繁琐,而将t—x(y)相图应用在两者的定性分析比较中,则可以很直观地描述出各过程。
本文通过具体的实例进行分析,从而得知,在相同条件下,简单蒸馏总是优于平衡蒸馏。
%Simple distillation and equilibrium distillation were two methods of distillation operations. Quantitative cal- culation for this comparison of two distillation methods was cumbersome. But applying the phase diagram t -x (y)in both in the comparison of qualitative analysis, description was very intuitive to processe. From analysis of specific instances, it showed that under the same conditions, simple distillation was always better than equilibrium distillation.【期刊名称】《广州化工》【年(卷),期】2012(040)009【总页数】3页(P35-37)【关键词】简单蒸馏;平衡蒸馏;比较;定性分析【作者】万惠萍;尉志苹【作者单位】大连工业大学,辽宁大连116034;大连工业大学,辽宁大连116034【正文语种】中文【中图分类】TQ02蒸馏操作是化工生产中分离液体均相混合物的一种单元操作,它是利用液体混合物各组分在一定压强下挥发度或沸点的不同使各组分得到分离.液体混合物加热部分汽化时,挥发度大的组分在气相中的浓度将大于在液相中的浓度,从而使得混合物得到部分分离.蒸馏可以按不同方法分类,最基本的有简单蒸馏、平衡蒸馏及精馏.若待处理物料中两组分的相对挥发度差异较大或分离提纯程度要求不高时,常常采用简单蒸馏或平衡蒸馏的方法.简单蒸馏的基本流程如图1所示.一定量的原料液投入蒸馏釜中,在恒定压力下加热汽化,陆续产生的蒸气进入冷凝器,经冷凝后的液体(又称馏出液)根据不同要求放入不同的产品罐中,最终将釜液一次排出.在简单蒸馏过程中,随着液体的逐渐蒸出,釜液中易挥发组分含量不断降低,温度也相应升高,与之相平衡的气相浓度也随之降低,因此简单蒸馏是一个不稳定的间歇过程,产品罐中收集到的液体浓度是一个时间段内的平均值[1].平衡蒸馏又称闪蒸,系连续定态过程,其流程如图2所示.原料连续地加入加热炉,在炉内被加热至一定温度,然后经节流阀减压至预定压强,由于压强的突然降低,过热液体发生自蒸发,液体部分汽化.气、液两相在分离器中分开,气相为顶部产物,其中易挥发组分较为富集;液相为底部产物,其中难挥发组分获得了增浓[2].因为简单蒸馏和平衡蒸馏都是达到组分的部分增浓,使混合物得到有限的分离,那么哪一种蒸馏效果会更好一些呢?关于这两种蒸馏的比较,几乎所有的《化工原理》教材中都是通过计算来进行的[3-6],而很多情况下我们只需要进行它们的定性比较,而定量的计算要求掌握公式,计算比较繁琐,并涉及到非线性方程的计算,求解还容易出错.因此,掌握一种定性分析的方法显得尤为重要.对溶液加热即产生气相,气液间的平衡是蒸馏的热力学基础,是进行蒸馏分析和计算的基本依据,两组分的气、液平衡可用t-x(y)函数关系或相图来表示.t-x(y)相图表示在总压P一定的条件下,相平衡时气(液)相组成与温度的关系[7].其中t表示温度,x,y分别表示易挥发组分在液相及气相中的摩尔分数.将t-x(y)相图应用到简单蒸馏和平衡蒸馏的定性分析比较中,是一种非常简单、方便又易懂的好方法.对于某双组分混合液,分别用简单蒸馏与平衡蒸馏方法进行分离,操作压力P、原料液量F、组成xF均相同.(1)若气相馏出物组成(或平均组成)相同,即y平=简,试比较残液(或液相产品)组成xW简与xW平、气相馏出物流率D简与D平.分析:在t-x(y)相图中,简单蒸馏过程和平衡蒸馏过程如图3所示.简单蒸馏过程:用11'22'表示.1表示原料液组成,1'表示第一个气泡组成;2'表示最后一个气泡组成,2表示残液组成xW简.由于在简单蒸馏过程中,蒸出的气相组成是不断降低的,即是从1'降至2',因此气相馏出物平均组成简定在1'2'之间,图中用点D 示意表示.平衡蒸馏过程:由于平衡蒸馏系定态过程,所得到的馏出物组成与塔釜液相组成成平衡关系,根据已知条件y平=简,故该过程可用水平线WD表示,W点对应的组成即为残液组成xW平.从图3中很容易看出:xW简<xW平,即简单蒸馏残液组成较小.下面分析气相馏出物流率的大小:对简单蒸馏作物料衡算:得对平衡蒸馏作物料衡算:式(1)、(2)相减,并整理得:因xW简<xW平,所以式(3)>0,即D简>D平,简单蒸馏气相馏出物流率较大. (2)若残液组成相同xW简=xW平,试比较气相馏出物的组成简与y平.分析:在图3中,保持简单蒸馏过程不变,2表示残液组成xW简,因xW简=xW平,则平衡蒸馏过程变为22'线,2'对应的组成即为平衡蒸馏气相馏出物的组成y平;而根据简单蒸馏的原理可知简单蒸馏气相馏出物平均组成简介于1'2'之间,即一定大于2'对应的组成,故简>y平,简单蒸馏气相馏出物的平均组成较大.(3)若气相馏出物流率相同,即D简=D平,试比较残液组成xW简与xW平,气相馏出物组成简与y平.分析:已知D简=D平,由简单蒸馏和平衡蒸馏的物料衡算可知:F=D简+W简=D平+W平因此得到W简=W平.又因为FxF=D简简+W简xW简=D平y平+W平xW平得式(4)难以断定各参数的大小,现采用反证法来解决.假设xW简≥xW平,根据式(4)必有y平≥简.但由图4可知:若xW简≥xW平,必有y 平<简,与假设的结果矛盾.由此可见,xW简≥xW平不成立,也就是说,xW简<xW平,代入式(4)得简>y平.即简单蒸馏残液组成较小,气相馏出物的平均组成较大.通过以上分析可知,无论是在气相馏出物浓度相等还是气相馏出物流率相等的情况下,简单蒸馏的液相产品浓度都小于平衡蒸馏;无论是在液相产品浓度相等还是气相馏出物流率相等的情况下,简单蒸馏的馏出物平均浓度都大于平衡蒸馏;而在气相馏出物浓度相等的情况下,简单蒸馏的气相馏出物流率也比平衡蒸馏的大.由以可见,可以得到一个结论:在相同条件下,简单蒸馏总是优于平衡蒸馏.将t-x(y)相图应用在简单蒸馏和平衡蒸馏中,可以很直观地描述出各过程的变化,各浓度的大小,对于两种蒸馏的定性比较来说,是一种通俗易懂而又简便可行的好工具、好方法.【相关文献】[1] 冯霄,何潮洪.化工原理[M].北京:科学出版社,2007:82-82.[2] 陈敏恒,丛德滋,方图南,等.化工原理[M].北京:化学工业出版社,2008:49-49.[3] 黄少烈,邹华生.化工原理[M].北京:高等教育出版社,2008: 260-261.[4] 夏清,陈常贵.化工原理[M].天津:天津大学出版社,2005:12-13.[5] 蒋维钧,余立新.化工原理化工分离过程[M].北京:清华大学出版社,2005:113-114.[6] 马晓迅,夏素兰,曾庆荣.化工原理[M].北京:化学工业出版社, 2010:254-254.[7] 叶世超,夏素兰,易美桂.化工原理[M].北京:科学出版社,2006: 64-64.。



第六章蒸馏蒸馏定义:蒸馏分类:易挥发组分难挥发组分有回流蒸馏(精馏)无回流蒸馏:简单蒸馏(间歇操作)平衡蒸馏(连续操作)特殊蒸馏:萃取蒸馏、恒沸蒸馏按操作压力可分为加压、常压和减压蒸馏两组分精馏和多组分精馏第一节双组分溶液的气液相平衡一、溶液的蒸汽压与拉乌尔定律纯组分的蒸汽压与温度的关系:拉乌尔定律:在一定温度下,理想溶液上方气相中任意组分的分压等于纯组分在该温度下的饱和蒸气压与它在溶液中的摩尔分数的乘积。
p=p A0x AA(6-2)p=p B0x B=p B0(1-Bx) (6-3)A式中p A、p B——溶液上方A,B组分的平衡分压,Pa;p0——在溶液温度下纯组成的饱和蒸汽压,随温度而变,其值可用安托尼(Antoine)公式计算或由相关手册查得,Pa;x、x B——溶液中A,B组分的摩尔分数。
A二、理想溶液气液平衡(一)t-y-x图1.沸点-组成图(t- x- y图)(1)结构以常压下苯-甲苯混合液t- x- y图为例,纵坐标为温度t,横坐标为液相组成x A和汽相组成y A(x,y均指易挥发组分的摩尔分数)。
下曲线表示平衡时液相组成与温度的关系,称为液相线,上曲线表示平衡时汽相组成与温度的关系,称为汽相线。
两条曲线将整个t- x- y图分成三个区域,液相线以下称为液相区。
汽相线以上代表过热蒸汽区。
被两曲线包围的部分为汽液共存区。
t- x- y图数据通常由实验测得。
对于理想溶液,可用露点、泡点方程计算。
(2)应用在恒定总压下,组成为x,温度为t1(图中的点A)的混合液升温至t2(点J)时,溶液开始沸腾,产生第一个汽泡,相应的温度t2称为泡点,产生的第一个气泡组成为y1(点C)。
同样,组成为y、温度为t4(点B)的过热蒸汽冷却至温度t3(点H)时,混合气体开始冷凝产生第一滴液滴,相应的温度t3称为露点,凝结出第一个液滴的组成为x1(点Q)。
F、E两点为纯苯和纯甲苯的沸点。
图苯-甲苯物系的t- x- y图图苯-甲苯物系的y- x图应用t- x- y图,可以求取任一沸点的气液相平衡组成。




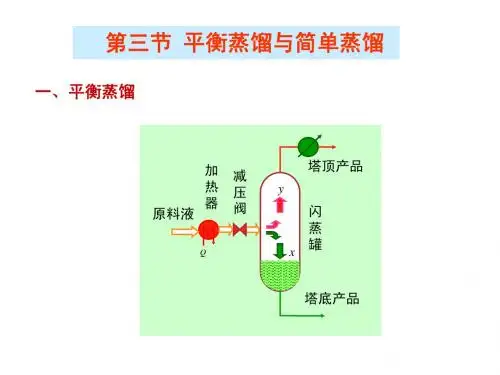
三、平衡蒸馏与简单蒸馏平衡蒸馏(闪蒸)是液体的一次部分气化的蒸馏操作。
1、流程2. 原理:将原料液加热到泡点温度以上,再经节流阀减压后进入闪蒸室,因压力下降原料液变为过热而使液体发生部分气化,形成气液两相,气化耗热使得液体温度下降,最后气、液两相温度趋于一致,两相组成趋于平衡。
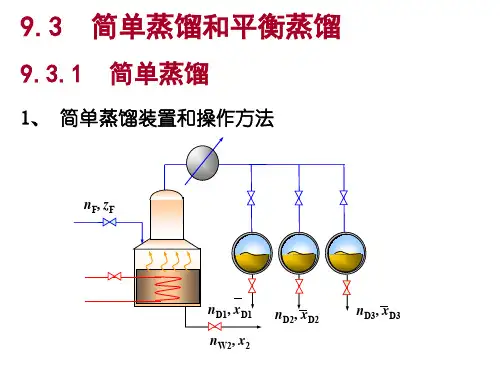
简单蒸馏也称微分蒸馏,在蒸馏过程中系统的温度和气液相组成均随时间而改变,属于间歇非定态操作。
闪蒸罐塔顶产品yAxA加热器原料液塔底产品Q减压阀1. 流程2. 原理:原料液一次加入釜中,将其加热至泡点,使之不断的气化,产生的蒸气由釜顶连续引入冷凝器得馏出液产品。
釜内任一时刻的气液两相组成互成平衡。
由于 y ,随着蒸气的不断引出,釜液中易挥发组分的组成不断减少,泡点逐渐升高,与之相应的气化蒸气中的易挥发组分的含量也不断降低,故常设有几个接受器,按时间的先后,分别得到不同组成的馏出液。
四、精馏精馏:把液体混合物进行多次部分气化,同时把产生的蒸气多次部分冷凝,使混合物分离为所要求组分的操作过程称为精馏 1. 精馏流程y原料液x蒸气xD1xD2xD3冷凝器预热到一定温度的原料液送入精馏塔的进料板,在每层塔板上, 回流液体与上升蒸气互相接触, 进行热和质的传递.塔顶冷凝器的作用: 获得塔顶产品及保证有适宜的液相回流。
再沸器的作用: 提供一定量的上升蒸蒸气。
精馏段:加料板以上的塔段.上升气相中重组分向液相传递,液相中轻组分向气相传递,完成上升蒸气轻组分精制。
提馏段:加料板及其以下的塔段.下降液体中轻组分向气相传递,气相中重组分向液相传递,完成下降液体重组分提浓。
2. 精馏原理任意第n 块塔板上的精馏过程混合蒸汽多次部分冷凝,蒸汽组成沿 t-x(y) 相图的露点线变化,可得到易挥发组分含量很高而难挥发组分含量很低的蒸汽。
混合液体多次部分汽化,釜液组成沿 t-x(y) 相图的泡点线变化,可得难挥发组分含量很高而易挥发组分含量很低的釜液。