第章ds区元素
- 格式:doc
- 大小:891.50 KB
- 文档页数:7



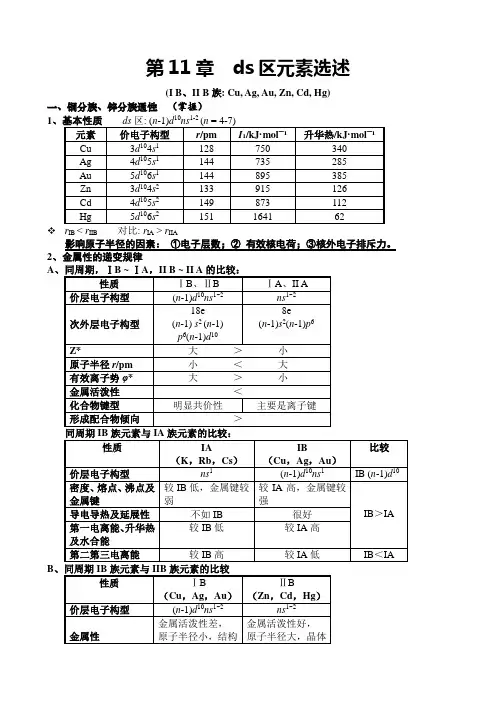
第11章ds区元素选述(I B、II B族: Cu, Ag, Au, Zn, Cd, Hg)一、铜分族、锌分族通性(掌握)101-21、影响原子半径的因素:①电子层数;②有效核电荷;③核外电子排斥力。
2、ABIVB …… VIII IB IIB IIIAAlZ* 显著↗,主导Ti Cu Zn Ga r↗,次要Zr Ag Cd In ∴金属性渐弱Hf Au Hg Tl(周期性)副族(IVB ~ VIII)和IIIA主族(铝分族)金属性由上到下依次减弱(Z*因素占主导地位),与其它主族和IIIB族(Sc,Y,镧系,锕系)( r因素占主导地位)规律相反!主族(除IIIA外)和IIIB族金属性、:上→下金→。
3、熔沸点与升华热、颜色的比较:A、熔沸点与升华热熔沸点:IB >IIB IB>IA IIB<IIA升华热:IB >IIB IB>IA IIB<IIAB、颜色(d-d跃迁引起)IB(+1) :3d104d10 5d10 Cu +,Ag +,Au + 均无色IB(+2) :Cu2+ 3d9,Ag3+ 4d8,Au3+ 5d8 有色蓝色棕色棕色IIB:Zn2+ 3d10 、Cd2+ 4d10 、Hg2+ 5d10 均无色d1 - d9化合物或配离子有颜色(d-d跃迁引起);d0和d10化合物或配离子多数无色。
特例:HgI2黄色:O2—→ Hg2+ 电荷迁移跃迁引起。
[Hg(II) d10]金属性:同周期:IB<IIB同族:上→下:渐弱(有效核电荷Z*因素占优)1、与酸反应A、非氧化性酸(如HCl,H3PO4,稀H2SO4……)Zn ZnCl 2+H 2↑+ HCl =Cd CdCl 2+H 2↑而Cu 、Ag 、Au 、Hg 不反应。
B 、氧化性酸(如HNO 3, 浓H 2SO 4……)M + HNO 3→M(NO 3)2+NO 2、NO 、NH 4+ (M=Zn)M + H 2SO 4∆−−→MSO 4 + SO 2↑+ H 2O (M =Cu 、Ag 、Zn 、Cd 、Hg ,但Au 不反应。

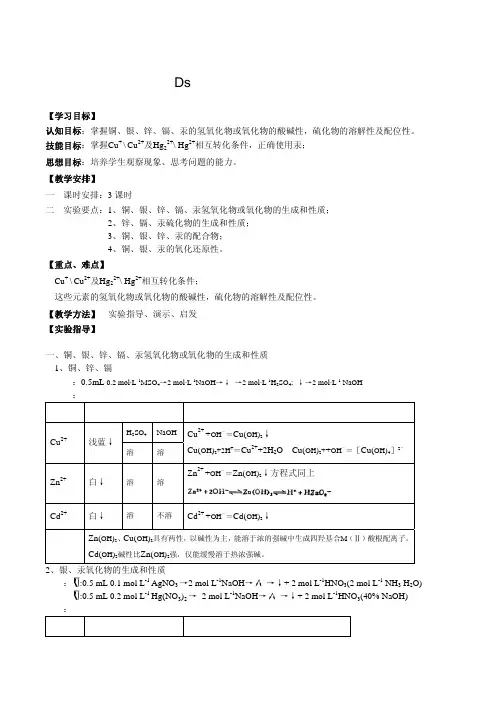

第十一章副族元素化学第十章ds区元素第节素概述第一节ds区元素概述ds 区元素是指元素周期表中的ⅠB 、ⅡB 两族元素包括族元素,包括铜、银、金、锌、镉、汞等6种自然形成的金属元素及两种人工合成元素。
ds 区的名称是因为它们的外层电子构型:ⅠB : (n-1)d 10s 1或ⅡB :(n-1)d 10s 2从广义的角度看,ds区实际上是d区的一部分。
因本区元素次外层(n-1)d轨道已填满电子,而最外电子层构型和区相同,所以满电子,而最外电子层构型和s区相同,所以将此区域元素称为ds区元素。
ds区元素都是过渡金属。
但由于其d层电子是全充满的,所以体现的性质与其他过渡金属有所不同。
如:最高氧化态只能达到+3如:最高氧化态只能达到+3。
3第二节铜族元素(一)铜族元素的单质1.物理性质(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)(2) 溶、沸点较其它过渡金属低(3) 导电性、导热性好,且Ag>Cu>Au(3)导电性导热性好且(4)延展性好铜族元素2.化学性质(1)与O 2作用)2CuO(O 2Cu 2黑⎯→⎯+∆)(CO (OH)Cu CO O H O 2Cu 322222绿⎯→⎯+++∆碱式碳酸铜Au 、Ag O 发生反应,当有沉淀剂或g 不与2发生反应,有沉淀剂或配合剂存在时,可发生反应。
5=铜族元素−−−+⎯→⎯+++4OH]4[M(CN)8CN O 2H O 4M AuAg Cu M 222,,−++⎯→⎯+++OH)(])4[Cu(NH 8NH O 2H O 4Cu 23322无色)(])[Cu(NH 243蓝+不可用铜器盛氨水O 2→O2H S 2Ag O S 2H 2Ag 2222+⎯→⎯++6银器年久变黑(2) 与酸作用铜族元素c Cu、Ag、Au不能置换稀酸中的H +d 若生成难溶物或配合物,单质还原能力则增强()2A I 2A (g)H S(s)Ag S H 2Ag 222+⎯→⎯+(g)H 2AgI 4I 2H 2Ag 2-2+⎯→⎯++−+③Cu 、Ag 、Au 可溶于氧化性酸7(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O + 2H +→Cu 2++ Cu + H 2OC O +2HCl 2C Cl +H Cu 2O + 2HCl →2CuCl + H 2O 10004CuO Cu O +O C (白色)CuO + 2H +→Cu 2++ H 2O4CuO Cu 2O + O 28(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235 熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O+4NH 3+H 2O →2[Cu(NH 3)2]++2OH -在空气中被氧化4[Cu(NH 3)2]++O 2+8NH 3+2H 2O →蓝94[Cu(NH 3)4]2+(深蓝)+4OH -CuOH 不稳定,至今尚未制得为浅蓝色难溶于水2-Cu(OH)2为浅蓝色,难溶于水1.受热易脱水2[Cu(OH)4]+C 6H 12O 6(葡萄糖)→Cu 2O +C 6H 12O 7+4OH -+2H 2O Cu(OH)2 CuO + H 2O 80~90C 两性以碱性为主(葡萄糖酸)2.两性:以碱性为主+2H + →2+ O (用此反应可检查尿糖Cu(OH)2+ 2H Cu +H 2O (浅兰色)Cu(OH)2+ 2OH -→[Cu(OH)4]2-(亮兰色)3. 溶于氨水2++2OH-10Cu(OH)2+4NH 3→[Cu(NH 3)4]2 + 2OH制取:1.,Cu 2+ + Cu + 4Cl -→2[CuCl 2]-1. 在热、浓HCl 溶液中, 用Cu 粉还原CuCl 2(无色)2. 用水稀释-→2CuCl ()+2Cl -总反应:Cu 2+ + Cu + 2Cl -→ 2CuCl2[CuCl 2]2CuCl (白色) + 2Cl 应用:CuCl + CO + HCl →[CuCl(CO)] ·H 2O 11(测CO )2无水CuCl 2为棕黄色固体,是共价化合物易溶于水和有机溶剂(如乙醇、丙酮)CuCl 2溶液随c (Cl -)不同而呈不同颜色[C Cl 24H O [C (H 2+4Cl [CuCl 4]2-+ 4H 2O [Cu(H 2O)4]2+ + 4Cl -)(12(黄色) (浅蓝色)无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色,可检验有机液体中的微量水分。




1 ds区元素1.1 本章学习要求(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。
这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)n。
由于它们的次d10s1~2外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质1.2.1 概述ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。
铜族元素原子的价电子构型为(n-1)n。
最外层与碱金属相似,只有1个电子,d10s1而次外层却有18个电子(碱金属有8个电子)。
因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2-1 碱金属与铜族元素比较性质铜族元素碱金属最外层电子数11次外层电子数188氧化值有+1、+2、+3三种只有+1一种高氧化值水合离子都有特征颜色(由于外层有成单d电子),如水合为蓝色,水合Cu2+为红黄色。
Au3+无色化合物类型多为共价型都是离子型形成配合物易形成配位化合物,较少形成配位化合物自然界的铜、银主要以硫化矿存在,如辉铜矿(S),黄铜矿(CuFe),孔Cu2S2Cu2(OH)2O3Ag2雀石[C]等;银有闪银矿(S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。
1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。
第十二章ds区元素12。
1 铜族元素 (1)12。
2 锌族元素 (10)12.1 铜族元素12。
1.1 铜族元素通性铜族元素1。
铜族元素通性铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。
有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高.对于Cu、Ag、Au,Δ(I2—I1)Au 〈Δ(I2—I1)Cu < Δ(I2-I1)Ag所以常见氧化态物+3,+2,+1。
铜、银、金的标准电势图如下所示:12.1.2 铜族元素金属单质2。
铜族元素金属单质(1).物理性质铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。
这可能与d电子也参与形成金属键有关。
由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。
铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。
(2)。
化学性质铜族元素的化学活性远较碱金属低,并按Cu—-Ag-—Au的顺序递减.在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。
铜绿可防止金属进一步腐蚀,其组成是可变的。
银和金不会发生该反应。
空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。
()在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。
但当有空气存在时,铜可缓慢溶解于这些稀酸中:浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3—,使Cu == Cu++e-的平衡向右移动:铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:铜、银、金在强碱中均很稳定。
12。
1。
3 铜族元素重要化合物3。
ds区元素(铜、银、锌、镉、汞)的性质【摘要】ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和Rg、Uub2种人工合成元素。
ds区的名称是因为它们的电子构型都是d10s1(ⅠB)或d10s2(ⅡB)。
ds区是d区元素的一部分,ds区元素都是过度金属。
但由于它们的d层是满的,所以体现的性质与其他过渡金属有所不同(比如说最高的氧化态只能达到+3)。
【关键字】元素过渡酸碱性;一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质;6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3)Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I -= 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
第11章ds区元素【11-1】试从下表所列的几个方面去比较ⅠA和ⅠB族元素的性质:ⅠA ⅠB 价电子构型原子半径电离能化学活泼性同族元素化学活泼性变化趋势氧化态与水作用氢氧化无的碱性及稳定性形成配合物的能力解:【11-2】试从习题1所列的几个方面去比较ⅡA和ⅡB族元素的性质。
解:ⅡA (碱金属)和ⅡB (铜族)族元素原子最外层只有一个电子,但铜族元素原子次外层为18电子,ⅠA 原子次外层为8个电子。
由于18电子结构的屏蔽效应小于8电子结构,使铜族元素原子有效核电荷数大,因而对最外层的一个s 电子吸引比碱金属强;原子半径、离子半径小而电离能大,金属活动性弱。
【11-3】解释下列现象并写出反应式: (1)埋在湿土中的铜线变绿。
(2)银器在含H 2S 的空气中发黑。
(3)金不溶于浓HCl 或HNO 3中,却溶于此两种酸的混合液中。
解:(2) 4Ag + 2H 2S + O 2 === 2Ag 2S(黑色) + 2H 2O3. (1) 2Cu + O 2 + CO 2 + H 2O === Cu 2(OH)2CO 3(绿色)(3) Au + 4HCl + HNO 3 === H[AuCl 4] + NO ↑ + 2H 2O【11-4】以CuSO 4为原料制取下列物质: [Cu(NH 3)4]2+ Cu(OH)2CuOCu 2ONa 2[Cu(OH)4]CuI解:CuSO 4 + 4NH 3 === [Cu(NH 3)4]SO 4CuSO 4 +2 NaOH === Cu(OH)2↓ + H 2OCu(OH)2 + 2NaOH === Na 2[Cu(OH)4]2CuSO 4 + 4KI === 2CuI ↓ + I 2 + K 2SO 44CuO === 2Cu 2O + O 2Cu(OH)2 === CuO + H 2O△△4.【11-5】以Hg(NO3)2为原料制取下列物质:HgO HgCl2Hg2Cl2Hg2(NO3)2K2[HgI4]解:5. Hg(NO3)2 + 2NaOH- === HgO↓(黄色) + 2NaNO3 + H2OHgO + 2HCl === HgCl2 + H2OHgCl2 + Hg === Hg2Cl2Hg(NO3)2 + Hg === Hg2(NO3)2Hg(NO3)2+ 4KI === K2[HgI4]【11-6】用适当的方法区别下列物质:(1)镁盐和锌盐(2)AgCl和Hg2Cl2(3)升汞和甘汞(4)锌盐和铝盐解:(1)加入NaOH溶液,出现白色沉淀,随后又溶解的是锌盐,不溶解的是镁盐。
(2)分别取三种盐放入试管中,向各试管中加入氨水放置一断时间,有黑色沉淀出现的是Hg2Cl2,溶解得到无色溶液的氯化银反应如下:Hg2Cl2+2NH3 == HgNH2Cl↓+NH4Cl+Hg↓AgCl+2NH3 == 〔Ag(NH3)2〕+ + Cl-(3)加入KI溶液,出现黄绿色沉淀的是甘汞,溶解成无色溶液的是升汞。
Hg2Cl2 + 2I- == Hg2I2↓ + 2Cl-HgCl2+4I- == 〔HgI4〕2-+2Cl-(4)加入氨水,出现白色沉淀,随后又溶解的是锌盐,不溶解的是铝盐。
【11-7】Cu和Zn能否分别与稀HCl溶液,浓H2SO4溶液,浓HNO3溶液及NaOH溶液反应?若能反应,试写出反应式。
解:7. 3Cu + 8HNO3(稀) === 3Cu(NO3)2 + 3NO↑ + 4H2OCu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2OCu + 2 H2SO4(浓) === CuSO4 + SO2↑ + 2H2O3Cu+ 8HNO3(稀) === 3Cu(NO3)2 + 2NO↑+ 4H2OZn + 2HCl(稀) === ZnCl2 + H2↑4Zn + 10HNO3(稀) === 4Zn(NO3)2 + N2O↑ + 5H2OZn+HNO3(浓) === Zn(NO3)2+NO2↑+H2OZn + 2NaOH + 2H2O === Na2Zn(OH)4 + H2↑【11-8】碱能否分别与Cu2+、Ag+、Zn2+、Hg2+和Hg22+反应?若能反应,试指出反应产物及现象。
解:Hg 22+ +2OH - ===Hg ↓+HgO ↓+H 2O Hg 2+ + 2OH - === HgO ↓ (黄色) + H 2O 8. Cu 2++2OH - === Cu(OH)2↓ 2Ag + + 2OH - === Ag 2O ↓(黑色) + 2H 2O Zn 2+ + 2OH - === Zn(OH)2↓(白色)(蓝)【11-9】氨水能否分别与Cu 2+、Ag +、Zn 2+、Hg 2+和Hg 22+反应?若能反应,试指出产物及现象。
解:Zn 2+ + 4NH 3 === [Zn(NH 3)4]2+ (无色)Hg 2Cl 2 + 2NH 3 === Hg(NH 2)Cl ↓ + Hg ↓(黑色) + NH 4Cl (观察为灰色)HgCl 2 + 2NH 3 === Hg(NH 2)Cl ↓(白色) + NH 4Cl9. Cu 2+ + 4NH 3 === [Cu(NH 3)4]2+ (蓝色) Ag + + 4NH 3 === [Ag(NH 3)4]+ (无色)【11-10】I -能否分别与Cu 2+、Ag +、Zn 2+、Hg 2+和Hg 22+反应?若能反应,试指出产物及现象。
解:0. 2Cu 2+ + 4I - === 2CuI ↓(白色) + I 2Ag + + I - === AgI ↓(黄色)2I-HgI 42-(无色)Hg 22+ + === Hg I ↓(淡绿色)Hg 2+ + 2I - === HgI 2(血红色)2I-HgI 42- + Hg ↓ 0. 2Cu 2+ + 4I - === 2CuI ↓(白色) + I 2 Ag + + I - === AgI ↓(黄色)2I-HgI 42-(无色)Hg 22+ + === Hg I ↓(淡绿色)Hg 2+ + 2I - === HgI 2(血红色)2I-HgI 42- + Hg ↓【11-11】完成下列反应方程式: (1)2HgCl 2 + SnCl 2(2)Cu(OH)2+C 6H 12O 6(3)HgS + 12 HCl + 2 HNO 3 (4)AgBr + 2Na 2S 2O 3 (5)Hg 2Cl 2 + H 2S (6)Cu 2O + H 2SO 4解:1. HgCl 2 + SnCl 2 === Hg + SnCl 42Cu(OH)2 + C 6H 12O 6 === Cu 2O + C 6H 12O 7 + 2H 2O3HgS + 12HCl + 2HNO 3 === 3H 2[HgCl 4] + 3S +2NO + 4H 2O AgBr + 2Na 2S 2O 3(过量) === Na 3[Ag(S 2O 3)2] + NaBr Hg 2Cl 2 + H 2S === Hg + HgS + 2HCl Cu 2O + H 2SO 4 === CuSO 4 + Cu + H 2O【11-12】找出实现下列变化所需的物质,并写出反应方程式:解:△△12. (1) Zn + OH - + H 2O === [Zn(OH)4]2- + H 2↑ [Zn(OH)4]2- + 4H + === Zn 2+ + 4H 2O Zn 2+ + 4NH 3 === [Zn(NH 3)4]2+[Zn(NH 3)4]2+ + S 2- === ZnS ↓ + 4NH 3Cu(OH)2 === CuO + H 2OCuO + 2HCl === CuCl 2 + H 2OCuCl 2 + Cu + 2HCl(浓) === 2[CuCl 2]- + 2H +(2) Cu + 2H 2SO 4(浓) === CuSO 4 + SO 2↑ + 2H 2O CuSO 4 + 2NaOH === Cu(OH)2↓ + Na 2SO 4[CuCl 2]- === CuCl ↓ + Cl -稀释【11-13】试用简便方法将下列混合离子分离: (1)Ag+ 和 Cu2+(2)Zn2+和Mg2+(3)Zn2+ 和 Al3+(4)Hg2+ 和 Hg22+解:Cu 2+Ag +HClCu 2+AgCl↓13. (1)(2)Zn2+Mg 2+过量NaOH [Zn(OH)4]2-Mg(OH)2↓(3)Zn 2+Al 3+ 3.2[Zn(NH 3)4]2+Al(OH)3↓(4) Hg2+ Hg 22+Hg 2+Hg 2Cl 2↓【11-14】试将Cu2+、Ag +、Zn 2+及Hg 2+混合离子分类。
解:Cu 2+Ag +Zn 2+Hg 2+AgCl ↓Cu 2+Zn 2+Hg 2+Hg(NH 2)Cl ↓Cu(NH 3)42+Zn(NH 3)42+CuS ↓Zn 2+Cl -过量NH 3H +(0.3M),H 2S15.【11-15】利用配位反应分别将下列物质溶解,并写出有关的反应方程式。
CuClCu(OH)2Ag 2OAgBrAgIZn(OH)2HgI 2解:Ag 2O + 4NH 3H 2O === 2[Ag(NH 3)2]+ + OH - + 3H 2O Cu(OH)2 + 2OH - (6M) === [Cu(OH)4]2-Zn(OH)2 + 2OH - === [Zn(OH)4]2-AgBr + S 2O 32- === [Ag(S 2O 3)2]3- + Br -HgI 2 + 2I - === [HgI 4]2-CuI + I -(饱和) === [CuI 2]-16.【11-16】有一白色硫酸盐A ,溶于水得蓝色溶液。
在此溶液中加入NaOH 得浅蓝色沉淀,加热B 变成黑色物质C 。
C 可熔于H 2SO 4,在所得的熔于中逐渐加入KI ,先有棕色沉淀D 析出,后又变成红棕色溶液E 和白色沉淀F 。
问A 、B 、C 、D 、E 、F 各为何物?写出有关反应式。
解:7. A: CuSO 4; B: Cu(OH)2; C: CuO; D: I 2 + CuI; E: KI 3; F: CuI CuSO 4 + 2NaOH === Cu(OH)2↓ + Na 2SO 4 Cu(OH)2 === CuO + H 2OCuO + H 2SO 4 === CuSO 4 + H 2O2CuSO 4 + 4KI === 2K 2SO 4 + 2CuI ↓ + I 2↓ 2KI + 3I 2 === 2KI 3【11-17】解释下列现象:(1)当SO 2通入CuSO 4和NaCl 的浓溶液中,析出白色沉淀。