第二十二章 ds区金属课后习题参考答案
- 格式:doc
- 大小:61.50 KB
- 文档页数:3


ds 元素 答案一、选择题:1. (1588) (C)2. (4372) (C)3. (4588) (D)4. (4532) (C)5. (1570) (D)6. (1562) (A)7. (3683) (B)8. (4599) (C)9. (4513) (A) 10. (4422) (A)11.(4548) (B) 12. (1516) (D)二、填空题:13. (4512) Hg 2Cl 2见光分解为有毒物Hg 和HgCl 2:Hg 2Cl 2−−→−νh Hg + HgCl 214. (7645) >,<,<,>15. (1687) 从上至下容易出现较稳定的低氧化态(或从上到下高氧化态稳定性下降) 从上至下容易出现较稳定的高氧化态 IB IIB16. (4589)先有蓝色沉淀生成,H 2SO 4过量则沉淀溶解得蓝色溶液。
2[Cu(NH 3)4]SO 4 + 3H 2SO 4 + 2H 2O = Cu(OH)2·CuSO 4↓ + 4(NH 4)2SO 4Cu(OH)2·CuSO 4 + H 2SO 4 = 2CuSO 4 + 2H 2O17. (4585) Cu + 2CN - + H 2O =Cu(CN)2- +1H 2 + OH - ;4Cu + 8CN - + O 2 + 2H 2O = 4Cu(CN)2- + 4OH -18. (1502) Cu(OH)2和Ga(OH)319. (1551) 4+23)Cu(NH + O 2 + 8NH 3 + 2H 2O = 4+243)Cu(NH + 4OH -深蓝色20. (4580) Hg 2Cl 2,HgNH 2Cl ,Hg ,灰黑21. (4503) Hg 2(NO 3)2 + 4KCN = K 2[Hg(CN)4] + Hg ↓+ 2KNO 3无色溶液,同时试管底部有灰黑色Hg ↓。
22. (1553) +22Hg + 4I - = [HgI 4]2- + Hg(灰黑)↓23. (1596) Ag 2O ,HgO 和Hg ,-24Zn(OH),Cd(OH)2三、计算题:24. (4539) (1) ϕ(Hg 2Cl 2/Hg) = ϕ(+22Hg /Hg) +20591.0 lg K sp (Hg 2Cl 2)所以 ϕ(+22Hg /Hg) = ϕH g 2Cl 2/Hg) - 20591.0 lg 4.0 ⨯ 10-18= 0.2829 - 20591.0⨯ (-17.40) = 0.797 (V)Hg 2+ ──────── +22Hg ──────── Hg0.905 V 0.797 V│ │?所以 ϕ(Hg 2+/Hg) =2/Hg)(Hg )/Hg (Hg 22222++++ ϕϕ= 0.851 (V) lg K 稳 =0591.0)370.0851.0(2059.0/Hg))(Hg(CN)-/Hg)(Hg (-242+=+ ϕϕz = 41.3 K 稳 = 2 ⨯ 1041(2) K = [Hg]][Hg 22+ Hg 2+ + Hg =Hg E = 0.108 V lg K =0591.0108.010591.0⨯=⨯ E z = 1.83 K = 67.2 (3) 四面体形。


第22章ds区金属一、选择题1.废弃的溶液不能倒入()。
A.含的废液中B.含的废液中C.含的酸性废液中D.含的碱性废液中【答案】C2.长久暴露于潮湿空气中的铜,表面会有一层蓝色的铜锈,其组成是()。
【答案】C3.胆矾的化学式是()。
【答案】B4.在晶体中,中心离子铜的配位数是()。
A.4B.5C.6D.8【答案】C5.能较好地解释离子是平面四方构型的理论是()。
A.VSEPRB.杂化轨道C.晶体场D.姜-泰勒效应【答案】D6.在AgSCN中,Ag+离子的配位数是()。
A.2B.3C.4D.6【答案】A7.将过量的KCN加入溶液中,其生成物是()。
【答案】B8.下列电极反应,标准电极电势代数值最小的是()。
【答案】A9.在标准状态下,反应达平衡时的温度是()。
A.71KB.548KC.656KD.1236K【答案】D10.在下列银的配阴离子中,最稳定的是()。
【答案】D11.铜与许多金属形成合金,制作康铜热电偶的主要成分是()。
A.Cu-ZnB.Cu-NiC.Cu-SnD.Cu-Be【答案】B12.与的反应中,离子的作用为()。
A.还原B.配位C.还原、配位D.氧化【答案】C13.与汞不能生成汞齐合金的金属是()。
A.CuB.AgC.ZnD.Fe【答案】D14.在亚汞的卤化物水溶液中,最不稳定的是()。
【答案】A15.在下列硫化物中,溶于溶液的是()。
A.CuSB.C.ZnSD.HgS【答案】D16.下列化合物中,电离度最小的是()。
【答案】D17.下列氮化物,性质最不安定(易爆炸)的是()。
【答案】D18.分离,应选用的最佳试剂为()。
【答案】A19.在最稳定的配离子中,Xˉ应为()。
【答案】D20.解释上述稳定性大小的理论为()。
A.价层电子对互斥理论B.惰性电子对效应C.软硬酸碱理论D.对角线规则【答案】C21.在下列离子中,加入离子后产生白色沉淀,继而在加入氨水后又变成灰色的是()。
【答案】A22.在酸度较大的水溶液中也不溶解的盐是()。

第二十二章ds区金属预习提纲第22章ds区金属第一节铜族元素(ds区)I B II B价电子结构(n-1)d10ns1(n-1)d10ns2第四周期Cu (copper)Zn (zinc)第五周期Ag (silver)Cd (cadmium)第六周期Au (Aurum)Hg (mercur)(n-1)d10ns1。
2.铜族元素在水溶液中的金属活泼性远小于碱金属,而且按铜-银-金的顺序降低。
碱金属是非常活泼的,铜族金属是不活泼的。
值都比氢从电势图可以看出,铜、银、金的的大,所以铜族元素在水溶液中的金属活泼性远小于碱金属,而且金属活泼性按铜、银、金的顺序降低。
这与碱金属从钠到铯金属活泼性增强恰好相反。
问题1:铜族元素的金属活泼性远小于碱金属,而且按铜-银-金的顺序降低原因: 铜族与碱金属元素性质不同的内在原因在于它们电子构型的不同。
铜族元素次外层比碱金属多10个d电子。
由于d电子屏蔽核电荷的作用较小,致使铜族元素的有效核电荷比相应的碱金属元素增大,核对价电子吸引力增强,第一电离能增大,活泼性比碱金属差。
铜族金属是不活泼的,且由Cu→Ag→Au活泼性递减。
热力学角度从固体金属形成一价水合阳离子全部过程的能量变化来解释.该过程的能量包括:升华能是由固体金属升华为气体原子所吸收的能量;电离能是由气态原子电离为气态M+所吸收的能量;水化能是气态M+与水结合成水合离子M+(aq)所释放出的能量。
应用玻恩一哈伯循环计算得到整个过程所需的总能量见表22-2。
从总能量看出,由M(s)→M+(aq)所需总能量按铜、银、金顺序越来越大,即单质形成M+(aq)的活性依次降低,所以铜、银、金的金属性质愈来愈不活泼。
3、铜族元素其价电子构型为(n-1)d10ns1。
铜族元素的氧化态有+I、+II、+III三种。
常见的是:Cu为+II、Ag为+I、Au为+III。
Cu、Ag、Au的氧化态的变化趋势没有规律性问题2:Cu、Ag、Au的氧化态的变化趋势为什么没有规律性?b. 金比铜和银更易实现高氧化态,如:AuF5和AuF74、铜族元素容易形成共价化合物,形成配合物的倾向也很显著。


习题一、选择题1.下列金属中,最不活泼的是()(吉林大学《无机化学例题与习题》)A.CuB. AgC. ZnD.Hg2.与银反应能置换出氢气的的稀酸是()(吉林大学《无机化学例题与习题》)A. 硫酸B. 盐酸C. 硝酸D.氢碘酸3.为除去铜粉中少量氧化铜,应采取的操作是()(吉林大学《无机化学例题与习题》) A. 浓盐酸洗 B. KCN溶液洗C. 稀硝酸洗D. 稀硫酸洗4.下列化合物,在硝酸和氨水中都能溶解的是()(吉林大学《无机化学例题与习题》)A. AgClB. Ag2CrO4C.HgCl2D. CuS5.下列化合物中颜色最浅的是()(吉林大学《无机化学例题与习题》)A. Ag3PO4B.CuIC.AuClD. HgO6.下列化合物中,在氨水、盐酸、氢氧化钠溶液中均不溶解的好是( ) (吉林大学《无机化学例题与习题》)A. ZnCl2B. CuCl2C. Hg2Cl2D. AgCl7.关于CuCl2性质的叙述,错误的是()(吴成鉴《无机化学学习指导》) A.是离子型化合物 B.是链状结构C. 与HCl反应可生成配合物D. 不论晶体还是水溶液均有颜色8.向CuSO4入氨水的过程中,可能得到()(吴成鉴《无机化学学习指导》)A. Cu(OH)2.B.Cu2(OH)2SO4C. [Cu(NH3)4]2+D.[Cu(H2O)4]2+9.下列物质不能产生黑色物质的是( ) (吴成鉴《无机化学学习指导》)A.Cu在干燥的空气中加热至773KB. Ag与含H2S的空气接触C. AgBr见光D. ZnO在H2S气流中加热10.往含有Ag+、Cd2+、Al3+、Hg22+的溶液中滴加稀盐酸能析出沉淀的是()(吴成鉴《无机化学学习指导》)A.Al3+和Cd2+B.Ag+和Hg22+C.Ag+和Cd2+D只有.Ag+11. 能区分Zn2+和Al3+的下列试剂是()(吴成鉴《无机化学学习指导》)A. NaOHB. HClC. Na2CO3D. NH3.H2O12.AgX的颜色随卤素原子序数的增大而加深,可解释这一现象的理论是()黑龙江A. 杂化轨道B. 分子间作用力.C.溶剂化D. 离子极化13.下列氢氧化物最不稳定的是()(吴成鉴《无机化学学习指导》)A.Cu(OH)2B.Zn(OH)2C.Cd(OH)2D.AgOH14.锌比铜化学活泼性强,从能量变化角度分析是因为()(吴成鉴《无机化学学习指导》)A. 锌的电离势比铜的电离势小B.锌的升华热比铜的升华热较小C. 锌的升华热比铜的升华热大D. 锌的水合热比铜的水合热大15.下列分子中,具有顺磁性的是()(吉林大学《无机化学例题与习题》)A. CuClB. CuCl2C. Hg2Cl2D. HgCl216.除去ZnSO4溶液中所含的少量CuSO4,最好选用下列试剂中的()(大连理工大学《无机化学习题详解》)A.NH3.H2OB.NaOHC.ZnD.H2S17.下列离子与过量的KI溶液反应只得到澄清的无色溶液的是()(大连理工大学《无机化学习题详解》)A.Cu2+B.Ag+C.Hg2+D.Hg22+18.下列离子在水溶液中最不稳定的是()(大连理工大学《无机化学习题详解》)A.Cu2+B.Cu+C.Hg2+D.Hg22+19.下列电对的标准电极电势最大的是()(大连理工大学《无机化学习题详解》)A.Cu2+/Cu+B.Cu+/CuC.CuCl2/CuD.CuI/Cu20.下列金属与相应的盐可以发生反应的是()(大连理工大学《无机化学习题详解》)A.Fe与Fe3+B.Cu与Cu2+C.Hg与Hg2+D.Zn与Zn2+21.下列配离子空间构型为正四面体的是()(大连理工大学《无机化学习题详解》)A.Zn(NH3)42+B.Cu(NH3)42+C.Ni(CN)42-D.Hg(NH3)42+22.下列配合物属于反磁性的有()(大连理工大学《无机化学习题详解》)A.Mn(CN)64-B.Cd(NH3)42+C.Fe(CN)63-D.Co(CN)63-二、填空题1.铜副族和锌副族金属中,密度最小的是,密度最大的是. (吉林大学《无机化学例题与习题》)2.给出组成合金的金属:黄铜,青铜,康铜,(吉林大学《无机化学例题与习题》)3.向CuSO4溶液中加入适量氨水,生成的沉淀组成为,沉淀的颜色是,Hg2Cl2分子构型为,中心原子采取的杂化类型为,用氨水处理Hg2Cl2得到的沉淀是.4. 欲将Ag+从Pb2+,Sn2+,Al3+,Hg2+混合溶液中分离出来,可加入的试剂为,(吉林大学《无机化学例题与习题》)5. Hg2Cl2是利尿剂。

1-1. 为什么说钢中的S、P杂质元素在一般情况下是有害的?答:S容易和Fe结合形成熔点为989℃的FeS相,会使钢在热加工过程中产生热脆性;P与Fe结合形成硬脆的Fe3P相,使钢在冷变形加工过程中产生冷脆性。
1-2. 钢中的碳化物按点阵结构分为哪两大类?各有什么特点?答:可以分为简单点阵结构和复杂点阵结构,简单点阵结构的特点:硬度较高、熔点较高、稳定性较好;复杂点阵结构的特点:硬度较低、熔点较低、稳定性较差。
1-3. 简述合金钢中碳化物形成规律。
答:①当r C/r M>0.59时,形成复杂点阵结构;当r C/r M<0.59时,形成简单点阵结构;②相似者相溶:完全互溶:原子尺寸、电化学因素均相似;有限溶解:一般K都能溶解其它元素,形成复合碳化物。
③强碳化合物形成元素优先与碳结合形成碳化物。
④N M/N C 比值决定了碳化物类型⑤碳化物稳定性越好,溶解越难,析出难越,聚集长大也越难。
1-4. 合金元素对Fe –Fe3C 相图的S、E 点有什么影响?这种影响意味着什么?答:凡是扩大γ相区的元素均使 S、E点向左下方移动;凡是封闭γ相区的元素均使S、E 点向左上方移动。
S点左移,意味着共析碳量减少; E点左移,意味着出现莱氏体的碳含量减少。
1-19. 试解释40Cr13已属于过共析钢,而Cr12钢中已经出现共晶组织,属于莱氏体钢。
答:①因为Cr属于封闭y相区的元素,使S点左移,意味着共析碳量减小,所以钢中含有Cr12%时,共析碳量小于0.4%,所以含0.4%C、13%Cr的40Cr13不锈钢就属于过共析钢。
②Cr使E点左移,意味着出现莱氏体的碳含量减小。
在Fe-C相图中,E点是钢和铁的分界线,在碳钢中是不存在莱氏体组织的。
但是如果加入了12%的Cr,尽管含碳量只有2%左右,钢中却已经出现了莱氏体组织。
1-21. 什么叫钢的内吸附现象?其机理和主要影响因素是什么?答:合金元素溶入基体后,与晶体缺陷产生交互作用,使这些合金元素发生偏聚或内吸附,使偏聚元素在缺陷处的浓度大于基体中的平均浓度,这种现象称为内吸附现象。


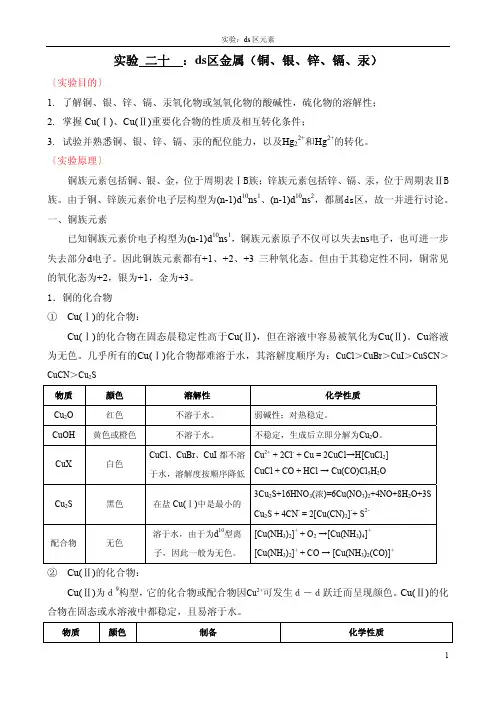
实验二十:ds区金属(铜、银、锌、镉、汞)〔实验目的〕1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2.掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件;3.试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
〔实验原理〕铜族元素包括铜、银、金,位于周期表ⅠB族;锌族元素包括锌、镉、汞,位于周期表ⅡB 族。
由于铜、锌族元素价电子层构型为(n-1)d10ns1、(n-1)d10ns2,都属ds区,故一并进行讨论。
一、铜族元素已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅可以失去ns电子,也可进一步失去部分d电子。
因此铜族元素都有+1、+2、+3三种氧化态。
但由于其稳定性不同,铜常见的氧化态为+2,银为+1,金为+3。
1.铜的化合物①Cu(Ⅰ)的化合物:Cu(Ⅰ)的化合物在固态晨稳定性高于Cu(Ⅱ),但在溶液中容易被氧化为Cu(Ⅱ)。
Cu溶液为无色。
几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S物质颜色溶解性化学性质Cu2O 红色不溶于水。
弱碱性;对热稳定。
CuOH 黄色或橙色不溶于水。
不稳定,生成后立即分解为Cu2O。
CuX 白色CuCl、CuBr、CuI都不溶于水,溶解度按顺序降低Cu2+ + 2Cl- + Cu = 2CuCl→H[CuCl2] CuCl + CO + HCl → Cu(CO)Cl5H2OCu2S 黑色在盐Cu(Ⅰ)中是最小的3Cu2S+16HNO3(浓)=6Cu(NO3)2+4NO+8H2O+3SCu2S + 4CN- = 2[Cu(CN)2]-+ S2-配合物无色溶于水,由于为d10型离子,因此一般为无色。
[Cu(NH3)2]+ + O2→[Cu(NH3)4]+ [Cu(NH3)2]+ + CO → [Cu(NH3)2(CO)]+②Cu(Ⅱ)的化合物:Cu(Ⅱ)为d9构型,它的化合物或配合物因Cu2+可发生d-d跃迁而呈现颜色。
第二十二章ds区金属课后习题参考答案4解:取一定量混合物配成溶液后,滴加入过量的HCl使Ag+完全沉淀后,离心分离。
沉淀用稀HNO3加热溶解即得AgNO3溶液.滤液中含有硝酸铜.5解:溶液中含Cu2+为5/63.55=0.0787mol/L 对于反应:Cu2+ + H2S == CuS↓+ 2H+K平=[H+]2/[Cu2+][H2S]= [H+]2[S2-]/[Cu2+][S2-][H2S]=K a1K a2/K sp=5.7×10-8×1.2×10-15/1.27×10-36=5.386×1013设达到平衡时,溶液中[Cu2+]=x mol/L 代入平衡常数表达式得:(0.2+2×0.0787)2/x×0.1= 5.386×1013∴x=2.37×10-14(mol/L)= 1.51×10-12mg/ml6解:(1) 2Cu + O2 + H2O + CO2 == Cu(OH)2·CuCO3(2) Au + 4HCl + HNO3 == HAuCl4 + NO + 2H2O(3) CuCl42-(黄棕) + 4H2O == [Cu(H2O)4] 2+(蓝) + 4Cl-(4) CuCl42- + SO2 + 2H2O == 2CuCl + SO42- + 6Cl- + 4H+(5) Ag+ + CN- == AgCN(白)↓AgCN + CN- == Ag(CN)2-Ag(CN)2- + Cl-→不反应2Ag(CN)2- + S2- == Ag2S↓+ 4CN-(6) 2CuCl2·2H2O == Cu(OH)2·CuCl2 + 2HCl↑7解:A:CuO;B:CuCl2+Cu(H2O)42+;C:HCuCl2;D:CuCl;E:Cu(NH3)2+;F:Cu(NH3)42+;G:Cu(CN)43-;H:Cu;I:Cu2+;J:Cu(OH)2.2CuO + 4HCl + 2H2O==CuCl42- + Cu(H2O)42+CuCl2 + Cu + 2HCl == 2HCuCl2HCuCl2HCl + CuCl↓CuCl + 2NH3 == [Cu(NH3)2]Cl2[Cu(NH3)2]+ + 4 NH3·H2O + 1/2O2 == 2[Cu(NH3)4]2+ + 2OH- + 3H2O2[Cu(NH3)4]2+ + 10CN- == 2[Cu(CN)4]3- + (CN)2↑+ 8NH32[Cu(CN)4]3- + Zn == 2Cu + [Zn(CN)4]2- + 4CN-3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+ 4H2OCu2+ + 2OH- == Cu(OH)2↓Cu(OH)2CuO + H2O8解:(1) 已知ψθ(Cu2+/Cu)=0.345V; ψθ(Fe2+/Fe)= -0.440V; ψθ(Fe3+/Fe2+)=0.770V. 因ψθ(Cu2+/Cu)>ψθ(Fe2+/Fe), 则Cu2+可把Fe氧化,反应: Fe + Cu2+ == Cu + Fe2+ .而ψθ(Fe3+/Fe2+)>ψθ(Cu2+/Cu),所以Cu又能使Fe3+还原为Fe2+,反应: Cu+2Fe3+==Cu2++2Fe2+.(2) 用浓ZnCl2处理表面是为了除去金属表面的氧化物,同时又不损害金属表面,且高温下水分蒸发后,熔化的盐覆盖在金属表面防止其氧化,可保证金属与金属的直接接触.反应式如下: ZnCl2 + H2O == H[ZnCl2(OH)] FeO + H[ZnCl2(OH)] == Fe[ZnCl2(OH)]2 + H2O(3) HgS由于溶解度非常小,所以不溶于HCl,HNO3中.(NH4)2S中虽然含有S2-,但由于其水解较严重,导致自由的[S2-]大大低于同浓度的Na2S溶液,所以HgS在(NH4)2S中不溶. HgS溶于浓的Na2S溶液中是因为可形成HgS22-配离子的缘故.(4) HgC2O4因Ksp小难溶于水,但在Cl-中因形成配离子HgCl42-而溶解.HgC2O4 + 4Cl- == HgCl42- + C2O42-(5) 在Cl-存在时,Hg2+可形成稳定的HgCl42-配离子,这时加入NH3水也不能使HgCl42-转化为HgNH2Cl. 9解:反应的△rGθ=△f Gθ(Ag+,aq)+△f Gθ(Cl-,aq)-△f Gθ(AgCl,s)=77.11-131.17+109.72= 55.66(kJ/mol)由△rGθ=-RTlnK得: lnK=-△rGθ/RT= -55.66×103/8.314×298 = -22.47 K=1.75×10-10而K=Ksp 则AgCl的Ksp为1.75×10-10.13解:在Zn2+为0.01mol/L的溶液中通H2S,在pH≥1时,[H+]=0.1mol/L。
ds 区元素1、试从原子结构方面说明铜族元素和碱金属元素在化学性质上的差异。
解:铜族元素价电子层结构为(n -1)d 10ns 1,与碱金属元素相比,最外层电子数相同,都是ns 1,而次外层电子数目不同,铜族元素次外层为18电子,而碱金属次外层8个电子,18电子的屏蔽比8电子要小得多,铜族的有效核电荷多,最外层s 电子受核的引力强,不易失去,相应的电离势高,原子半径小。
故与碱金属元素在化学性质上有很大的差异。
2、简述:(1)怎样从闪锌矿冶炼金属锌?(2)怎样从辰砂制金属汞?解:(1)闪锌矿通过浮选法得到含有ZnS 40—60%的精矿后,加以焙烧使它转化为氧化锌再把氧化锌和焦碳混合,在鼓风机中加热至1473—1573K ,使锌蒸馏出来,主要反应为:2ZnS + 3O 2 == 2ZnO + 2SO 22C + O 2 == 2COZnO + CO == Zn(g) + CO 2(2)辰砂在空气中焙烧与铁或氧化钙共热都可以得到汞:HgS + O 2 Hg + SO 2↑HgS + Fe == FeS + Hg4HgS + 4CaO == 4Hg + 3CaS + CaSO 44、利用金属的电极电势值,说明铜、银、金在碱性氰化物水溶液中被溶解的原因,空气中的氧对溶解过程有何影响,CN -离子在溶解液中的作用是什么?答: θϕCu/Cu 2+= 0.3402V θϕCu /Cu += 0.522V θϕAg /Ag + = 0.799V θϕA u /A u +=1.68V O 2 + 4H +(10-7mol ·L -1) + 4e == 2H 2OθϕO H /O 22= 0.814V 当溶解液中存在NaCN 时,CN -能与Cu +、Ag +、Au +形成稳定的配离子,Cu +、Ag +、Au +浓度大大降低,使它们的电势也降低很多,它们的还原能力大为提高,这时空气中的氧就能将它们氧化为配离子而溶解:[Cu(CN)2]-+ e == Cu + + 2CN - θE = -0.43V [Ag(CN)2]- + e == Ag + 2CN -θE = -0.31V [Au(CN)2]- + e == Au + 2CN - θE = -0.6VO 2 + 2H 2O + 4e == 4OH -θE = 0.401V溶液中[H +]应根据CN -水解计算,当[CN -]=1mol ·L -1时,水解得到溶液中的[H +]=10-12 mol ·L -1,故下面的溶解反应能进行。
简明无机化学第二版答案【篇一:《无机化学》习题解析和答案】》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章 s区元素(4学时)第二十一章 p区金属(4学时)第二十二章 ds区元素(6学时)第二十三章 d区元素(一)第四周期d区元素(6学时)第二十四章 d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?● 化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)● 化学研究的是化学物质 (chemicals) 。
● 化学研究分子的组成、结构、性质与变化。
● 化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
● 化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
第二十二章ds区金属课后习题参考答案4解:取一定量混合物配成溶液后,滴加入过量的HCl使Ag+完全沉淀后,离心分离。
沉淀用稀HNO3加热溶解即得AgNO3溶液.滤液中含有硝酸铜.5解:溶液中含Cu2+为5/63.55=0.0787mol/L 对于反应:Cu2+ + H2S == CuS↓+ 2H+K平=[H+]2/[Cu2+][H2S]= [H+]2[S2-]/[Cu2+][S2-][H2S]=K a1K a2/K sp=5.7×10-8×1.2×10-15/1.27×10-36=5.386×1013设达到平衡时,溶液中[Cu2+]=x mol/L 代入平衡常数表达式得:(0.2+2×0.0787)2/x×0.1= 5.386×1013∴x=2.37×10-14(mol/L)= 1.51×10-12mg/ml6解:(1) 2Cu + O2 + H2O + CO2 == Cu(OH)2·CuCO3(2) Au + 4HCl + HNO3 == HAuCl4 + NO + 2H2O(3) CuCl42-(黄棕) + 4H2O == [Cu(H2O)4] 2+(蓝) + 4Cl-(4) CuCl42- + SO2 + 2H2O == 2CuCl + SO42- + 6Cl- + 4H+(5) Ag+ + CN- == AgCN(白)↓AgCN + CN- == Ag(CN)2-Ag(CN)2- + Cl-→不反应2Ag(CN)2- + S2- == Ag2S↓+ 4CN-(6) 2CuCl2·2H2O == Cu(OH)2·CuCl2 + 2HCl↑7解:A:CuO;B:CuCl2+Cu(H2O)42+;C:HCuCl2;D:CuCl;E:Cu(NH3)2+;F:Cu(NH3)42+;G:Cu(CN)43-;H:Cu;I:Cu2+;J:Cu(OH)2.2CuO + 4HCl + 2H2O==CuCl42- + Cu(H2O)42+CuCl2 + Cu + 2HCl == 2HCuCl2HCuCl2HCl + CuCl↓CuCl + 2NH3 == [Cu(NH3)2]Cl2[Cu(NH3)2]+ + 4 NH3·H2O + 1/2O2 == 2[Cu(NH3)4]2+ + 2OH- + 3H2O2[Cu(NH3)4]2+ + 10CN- == 2[Cu(CN)4]3- + (CN)2↑+ 8NH32[Cu(CN)4]3- + Zn == 2Cu + [Zn(CN)4]2- + 4CN-3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+ 4H2OCu2+ + 2OH- == Cu(OH)2↓Cu(OH)2CuO + H2O8解:(1) 已知ψθ(Cu2+/Cu)=0.345V; ψθ(Fe2+/Fe)= -0.440V; ψθ(Fe3+/Fe2+)=0.770V. 因ψθ(Cu2+/Cu)>ψθ(Fe2+/Fe), 则Cu2+可把Fe氧化,反应: Fe + Cu2+ == Cu + Fe2+ .而ψθ(Fe3+/Fe2+)>ψθ(Cu2+/Cu),所以Cu又能使Fe3+还原为Fe2+,反应: Cu+2Fe3+==Cu2++2Fe2+.(2) 用浓ZnCl2处理表面是为了除去金属表面的氧化物,同时又不损害金属表面,且高温下水分蒸发后,熔化的盐覆盖在金属表面防止其氧化,可保证金属与金属的直接接触.反应式如下: ZnCl2 + H2O == H[ZnCl2(OH)] FeO + H[ZnCl2(OH)] == Fe[ZnCl2(OH)]2 + H2O(3) HgS由于溶解度非常小,所以不溶于HCl,HNO3中.(NH4)2S中虽然含有S2-,但由于其水解较严重,导致自由的[S2-]大大低于同浓度的Na2S溶液,所以HgS在(NH4)2S中不溶. HgS溶于浓的Na2S溶液中是因为可形成HgS22-配离子的缘故.(4) HgC2O4因Ksp小难溶于水,但在Cl-中因形成配离子HgCl42-而溶解.HgC2O4 + 4Cl- == HgCl42- + C2O42-(5) 在Cl-存在时,Hg2+可形成稳定的HgCl42-配离子,这时加入NH3水也不能使HgCl42-转化为HgNH2Cl. 9解:反应的△rGθ=△f Gθ(Ag+,aq)+△f Gθ(Cl-,aq)-△f Gθ(AgCl,s)=77.11-131.17+109.72= 55.66(kJ/mol)由△rGθ=-RTlnK得: lnK=-△rGθ/RT= -55.66×103/8.314×298 = -22.47 K=1.75×10-10而K=Ksp 则AgCl的Ksp为1.75×10-10.13解:在Zn2+为0.01mol/L的溶液中通H2S,在pH≥1时,[H+]=0.1mol/L。
这时:对于解离平衡:H2S == 2H+ + S2-[H+]2[S2-]/[H2S]=K a1·K a2[S2-]=K a1·K a2[H2S]/ [H+]2=10 K a1·K a2而ZnS沉淀析出时的[S2-]=Ksp/[ Zn2+]=Ksp/0.01=100Ksp,即当10 K a1·K a2=100Ksp 刚好有ZnS析出∴0.1K a1·K a2= Ksp设pH=9时,刚析出ZnS沉淀,这时[H+]=10-9mol/L。
[S2-]=K a1·K a2[H2S]/ [H+]2= K a1·K a2×0.1/(10-9)2=1017 K a1·K a2[Zn2+]= Ksp/[ S2-]=Ksp/1017 K a1·K a2=0.1K a1·K a2/1017 K a1·K a2=10-18(mol/L)Zn(CN)42-的不稳定常数K不稳=[ Zn2+][CN-]4/[ Zn(CN)42-]=10-18×1.04/0.01=10-1614解:(1) 已知Cu2+ +0.158V Cu+ +0.522V Cu Hg2+ +0.920V Hg22+ +0.7973V Hg∵ψθ(Cu+/Cu)>ψθ(Cu2+/Cu+) ∴反应: 2Cu+ == Cu2+ + Cu可自发向右进行,即Cu+不稳定.ψθ(Hg2+/Hg22+)>ψθ(Hg22+/Hg) ∴反应: Hg2+ + Hg ==Hg22+可自发向右进行,即Hg22+稳定.(2) 要使Cu2+转化为Cu+,可使Cu+形成难溶物,如: 2Cu2+ + 4I- == 2CuI + I2或使Cu+形成配合物,如: 2Cu2+ + 10CN- == 2[Cu(CN)4]3- + (CN)2↑(3) 要使Hg2+转化为Hg22+,可使用还原剂与Hg2+反应来得到.如: Hg2+ + Hg ==Hg22+2 Hg2+ + Sn2+(适量) ==Hg22+ + Sn4+ 2 Hg2+ + SO32- + H2O == Hg2SO4↓+ 2H+而使Hg22+转化为Hg2+,可使用沉淀剂或配位剂.如: Hg22+ + H2S == HgS↓+ Hg↓+ 2H+Hg2Cl2 + 2NH3 == HgNH2Cl↓+Hg↓+NH4Cl Hg22+ + 4CN-(过量)==Hg(CN)42- + Hg↓18解:(1) 先酸化,后加入Na2S至沉淀完全.离心分离,沉淀为CuS,溶液中含有Zn2+,可达分离目的.(2) 加入过量Na2S使其沉淀完全.离心分离后的沉淀中加入浓HCl,则CdS溶解进入溶液相,而CuS不溶而达到分离.(3) 加入浓HCl, CdS溶解而HgS不溶而分离(或用浓Na2S, HgS溶解而CdS不溶).(4) 加入过量HCl,HgCl2溶解为HgCl42-,而Hg2Cl2不溶解而得以分离.20解:21解:22解:该原电池组成为: (-)Zn│Zn(NH3)42+,NH3‖H2S│Aa2S│Ag(+) 其△E=0.852V负极反应: Zn(NH3)42+ + 2e == Zn + 4 NH3ψ(-)=ψθ(Zn2+/Zn) + 0.0592/2lg[Zn2+]又: Zn2+ + 4 NH3 == Zn(NH3)42+ K稳=[Zn(NH3)42+]/[Zn2+][NH3]4[Zn2+]=[Zn(NH3)42+]/ K稳[ NH3]4=0.1/3.8×108×(0.1)4=2.63×10-6∴ψ(-)= -0.76+0.0592/2lg(2.63×10-6) = -0.925V正极反应: Ag2S + 2H+ + 2e == 2Ag + H2Sψ(+)=ψθ(Ag+/Ag) + 0.0592lg[Ag+]=ψθ(Ag+/Ag) + 0.0592lg(Ksp/[S2-])0.5又平衡: H2S == 2H+ + S2-[H+]2[S2-]/[H2S]=K a1·K a2[S2-]=K a1·K a2[H2S]/ [H+]2=8.9×10-8×1.2×10-13×0.1/0.22=2.67×10-20代入ψ(+)得: ψ(+)=0.80+0.0592/2lg(Ksp/2.67×10-20)=1.379+0.0296lgKsp∵ψ(+)-ψ(-)=1.379+0.0296lgKsp-(-0.925)=0.852 ∴Ksp=8.58×10-5023解:(1) 加入过量氨水,Zn2+形成无色溶液[Zn(NH3)42+],而Al3+产生白色胶状沉淀.(2) 方法一: 分别加入过量NaOH, Zn2+形成无色溶液[Zn(OH)42-],而Cd2+形成白色沉淀[Cd(OH)2];方法二: 加入Na2S溶液,Zn2+产生白色沉淀ZnS,而Cd2+形成黄色沉淀CdS.(3) 方法一: 加入过量NaOH,Mg2+产生白色沉淀,Zn2+为无色溶液;方法二: 加入过量氨水,Mg2+产生白色沉淀,Zn2+为无色溶液;方法三: 加入Na2S溶液,无现象的为Mg2+,有白色沉淀的为Zn2+.。