高二化学分子晶体和原子晶体知识点梳理(Word版)
- 格式:doc
- 大小:29.00 KB
- 文档页数:4

第2课时原子晶体[学习目标定位] 1.知道原子晶体的概念,能够从原子晶体的结构特点理解其物理特性。
2.学会晶体熔、沸点比较的方法。
一、原子晶体的概念、结构及其性质1.概念及组成(1)概念:相邻原子间以共价键相结合形成的具有空间立体网状结构的晶体,称为原子晶体。
(2)构成微粒:原子晶体中的微粒是原子,原子与原子之间的作用力是共价键。
2.两种典型原子晶体的结构(1)金刚石的晶体结构模型如图所示。
回答下列问题:①在晶体中每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状结构。
②晶体中相邻碳碳键的夹角为109°28′,碳原子采取了sp3杂化。
③最小环上有6个碳原子,晶体中C原子与C—C键个数之比为1∶2。
④晶体中C—C键键长很短,键能很大,故金刚石的硬度很大,熔点很高。
(2)二氧化硅晶体结构模型如图所示。
回答下列问题:①每个硅原子都采取sp3杂化,以4个共价单键与4个氧原子结合,每个氧原子与2个硅原子结合,向空间扩展,构成空间网状结构。
②晶体中最小的环为6个硅原子、6个氧原子组成的12元环,硅、氧原子个数比为1∶2。
3.特性由于原子晶体中原子间以较强的共价键相结合,故原子晶体:①熔、沸点很高,②硬度大,③一般不导电,④难溶于溶剂。
4.常见的原子晶体:常见的非金属单质,如金刚石(C)、硼(B)、晶体硅(Si)等;某些非金属化合物,如碳化硅(SiC)、氮化硼(BN)、二氧化硅(SiO2)等。
原子晶体的结构特点(1)构成原子晶体的微粒是原子,其相互作用力是共价键。
(2)原子晶体中不存在单个分子,化学式仅仅表示的是物质中的原子个数比关系,不是分子式。
例1下列物质的晶体直接由原子构成的一组是()①CO2②SiO2③晶体Si④白磷⑤氨基乙酸⑥固态HeA.①②③④⑤⑥B.②③④⑥C.②③⑥D.①②⑤⑥【考点】原子晶体【题点】原子晶体的一般性质及判断答案C解析CO2、白磷、氨基乙酸、固态He是分子晶体,其晶体由分子构成,稀有气体He由单原子分子构成;SiO2、晶体Si属于原子晶体,其晶体直接由原子构成。

晶体的常识分子晶体与原子晶体【学习目标】1、初步了解晶体的知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图;2、知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成;3、了解分子晶体和原子晶体的特征,能以典型的物质为例描述分子晶体和原子晶体的结构与性质的关系;4、知道分子晶体与原子晶体的结构粒子、粒子间作用力的区别。
【要点梳理】要点一、晶体与非晶体1、概念:①晶体:质点(分子、离子、原子)在空间有规则地排列成的、具有整齐外型、以多面体出现的固体物质。
晶体具有的规则的几何外形源于组成晶体的微粒按一定规律周期性的重复排列。
②非晶体:非晶态物质内部结构没有周期性特点,而是杂乱无章地排列,如:玻璃、松香、明胶等。
非晶体不具有晶体物质的共性,某些非晶态物质具有优良的性质要点诠释:晶体与非晶体的区分:晶体是由原子或分子在空间按一定规律周期性地重复排列构成的固体物质。
周期性是晶体结构最基本的特征。
许多固体的粉末用肉眼是看不见晶体的,但我们可以借助于显微镜观察,这也证明固体粉末仍是晶体,只不过晶粒太小了。
晶体的熔点较固定,而非晶体则没有固定的熔点。
区分晶体和非晶体最可靠的科学方法是对固体,进行X—射线衍射实验,X射线透过晶体时发生衍射现象。
特别注意:一种物质是否晶体,是由其内部结构决定的,而非由外观判断。
2、分类:说明:①自范性:晶体能自发性地呈现多面体外形的性质。
所谓自范性即“自发”进行,但这里要注意,“自发”过程的实现仍需一定的条件。
例如:水能自发地从高处流向低处,但若不打开拦截水流的闸门,水库里的水不能下泻;②晶体自范性的条件之一:生长速率适当;③晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象。
4、晶体形成的途径:①熔融态物质凝固,例:熔融态的二氧化硅,快速冷却得到玛瑙,而缓慢冷却得到水晶。
②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。

高中化学物质结构知识点引言物质结构是化学的核心内容之一,它涉及到原子、分子以及晶体等不同层面的结构特征。
掌握物质结构对于理解化学反应的本质、预测物质的性质以及指导实验操作都具有重要意义。
第一部分:原子结构与元素周期表1.1 原子的构成原子核:质子和中子的组成及其特性。
电子云:电子的排布规律和电子云模型。
1.2 元素周期表周期性:元素周期表的周期性和族的划分。
元素性质:元素周期律及其对元素性质的预测。
第二部分:化学键与分子结构2.1 离子键与共价键离子键:形成机制、特点及离子化合物。
共价键:形成机制、饱和性和方向性。
2.2 分子的极性极性分子:分子极性的判断和影响因素。
非极性分子:分子结构和极性的关系。
第三部分:晶体结构3.1 晶体的类型晶体与非晶体:区别和识别方法。
晶体类型:原子晶体、分子晶体、离子晶体和金属晶体。
3.2 晶体的物理性质熔沸点:晶体类型与熔沸点的关系。
导电性:金属晶体的导电机制。
第四部分:有机化合物的结构4.1 有机分子的骨架碳原子的杂化:sp、sp2、sp3杂化轨道。
同分异构体:构造异构和立体异构。
4.2 官能团与反应活性官能团:有机分子中的反应中心。
反应机理:官能团在有机反应中的作用。
第五部分:物质结构的表征方法5.1 光谱分析紫外-可见光谱:分子结构与光谱的关系。
红外光谱:化学键振动与红外光谱。
5.2 核磁共振(NMR)NMR原理:核磁共振现象及其在结构分析中的应用。
谱图解读:通过NMR谱图分析分子结构。
第六部分:物质结构与性质的关系6.1 结构对性质的影响硬度与脆性:晶体结构对物理性质的影响。
溶解性:分子极性与溶解性的关系。
6.2 结构对反应性的影响反应位点:分子结构中的反应活性区域。
催化作用:催化剂对反应途径的影响。
结语物质结构是化学学科的基石,它影响着物质的稳定性、反应性和多样性。
通过本文档的学习,学生将能够深入理解原子、分子和晶体的结构特征,掌握化学物质结构的基本知识,为进一步的化学学习和研究打下坚实的基础。

高考化学分子晶体和原子晶体知识点梳理(一)分子晶体:构成晶体的微粒间经过火子间作用力相互作用所构成的晶体,称为分子晶体。
分子晶体中存在的微粒是分子,不存在离子。
较典型的分子晶体有非金属氢化物,局部非金属单质,局部非金属氧化物,简直一切的酸,绝大少数无机物的晶体等。
分子晶体中存在的相互作用力主要是分子间作用力,它是分子间存在着一种把分子聚集在一同的作用力,叫做分子间作用力,也叫范?曰?力。
分子间作用力只影响物质的熔沸点、硬度、密度等物理性质,分子晶体普通都是绝缘体,熔融形状不导电。
关于某些含有电负性很大的元素的原子和氢原子的分子,分子间还可以经过氢键相互作用。
氢键的构成条件:它是由曾经与电负性很强的原子构成共价键的氢原子与另一分子中电负性很强的原子之间的作用力构成,(它不属于化学键)普通表示为X?DH…Y。
这种静电吸引作用就是氢键。
氢键异样只影响物质的熔沸点和密度,对物质的化学性质没有影响分子晶体的结构特征:没有氢键的分子密堆积陈列,如CO2等分子晶体,分子间的作用力主要是分子间作用力,以一个分子为中心,每个分子周围有12个紧邻的分子存在。
还有一类分子晶体,其结构中不只存在分子间作用力,同时还存在氢键,如:冰。
此时,水分子间的主要作用力是氢键,每个水分子周围只要4个水分子与之相邻。
称为非密堆积结构。
说明:1、分子晶体的构成微粒是分子,分子中各原子普通以共价键相结合。
因此,大少数共价化合物所构成的晶体为分子晶体。
如:局部非金属单质、非金属氢化物、局部非金属氧化物、简直一切的酸以及绝大少数的无机物等都属于分子晶体。
但并不是一切的分子晶体中都存在共价键,如:由单原子构成的稀有气体分子中就不存在化学键。
也不是共价化合物都是分子晶体,如二氧化硅等物质属于原子晶体。
2、由于构成晶体的微粒是分子,因此分子晶体的化学式可以表示其分子式,即只要分子晶体才存在分子式。
3、分子晶体的微粒间以分子间作用力或氢键相结合,因此,分子晶体具有熔沸点低、硬度密度小,较易熔化和挥发等物理性质。

高中化学知识点:晶体结构与性质晶体结构与性质是高中化学中重要的知识点之一。
晶体是由原子、分子或离子等微观粒子沿着空间做周期性重复排列所形成的固体物质,具有规则的几何外形和固定的熔点。
晶体结构与其性质有着密切的关系,了解晶体结构可以帮助我们更好地理解晶体的性质和特征。
一、晶体结构晶体结构是指晶体中原子或离子的排列方式以及它们之间的相互作用。
根据晶体中微观粒子的种类和排列方式,可以将晶体分为离子晶体、分子晶体、原子晶体等不同类型。
其中,离子晶体是最常见的晶体之一,其基本结构单元是正负离子,这些离子通过离子键相互结合。
分子晶体则是由分子通过范德华力相互结合形成的,而原子晶体则是原子通过共价键相互结合形成的。
在晶体结构中,晶胞是最基本的结构单元,它是一个重复单位,可以代表整个晶体结构。
晶胞具有规则的几何外形,并且具有对称性。
晶胞中的原子或离子的排列方式以及它们之间的相互作用,决定了晶体的物理和化学性质。
二、晶体的性质1、晶体的导电性晶体的导电性是指晶体在电场的作用下能够导电的能力。
离子晶体具有较好的导电性,因为离子晶体中存在可以自由移动的离子。
而分子晶体和原子晶体由于分子或原子之间的相互作用比较强,其导电性相对较差。
2、晶体的热稳定性晶体的热稳定性是指晶体在温度变化时保持其结构的稳定性和物理性质的能力。
离子晶体具有较高的热稳定性,因为离子键的键能较大,而分子晶体和原子晶体由于分子或原子之间的相互作用比较弱,其热稳定性相对较差。
3、晶体的还原性晶体的还原性是指晶体在化学反应中失去电子的能力。
离子晶体具有较强的还原性,因为离子晶体中的离子容易失去电子。
而分子晶体和原子晶体由于分子或原子之间的相互作用比较强,其还原性相对较差。
此外,晶体的光学性质、磁性、机械性质等也是晶体性质的重要组成部分。
不同的晶体结构对应不同的物理和化学性质,理解和掌握晶体结构和性质之间的关系对于我们更好地认识化学世界具有重要的意义。
三、晶体结构与性质的关系晶体结构和性质之间存在着密切的关系。

第三章晶体结构与性质课标要求1.了解化学键和分子间作用力的区别;2.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质;3.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系;4.理解金属键的含义,能用金属键理论解释金属的一些物理性质;5.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别;要点精讲一.晶体常识1.晶体与非晶体比较2.获得晶体的三条途径①熔融态物质凝固;②气态物质冷却不经液态直接凝固凝华;③溶质从溶液中析出;3.晶胞晶胞是描述晶体结构的基本单元;晶胞在晶体中的排列呈“无隙并置”;4.晶胞中微粒数的计算方法——均摊法如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞;中学中常见的晶胞为立方晶胞立方晶胞中微粒数的计算方法如下:注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状二.四种晶体的比较2.晶体熔、沸点高低的比较方法1不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体;金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低;2原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金刚石>碳化硅>硅3离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高;4分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高;②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高;③组成和结构不相似的物质相对分子质量接近,分子的极性越大,其熔、沸点越高;④同分异构体,支链越多,熔、沸点越低;5金属晶体金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高;三.几种典型的晶体模型。

高中化学必修二知识点总结第一单元1——原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2——元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价3——单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4——元素的金属性与非金属性(及其判断)(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
判断金属性强弱金属性(还原性)1,单质从水或酸中置换出氢气越容易越强2,最高价氧化物的水化物的碱性越强非金属性(氧化性)1,单质越容易与氢气反应形成气态氢化物2,氢化物越稳定3,最高价氧化物的水化物的酸性越强(1—20号,F最强;最体一样)5——单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数。
阴阳离子的半径大小辨别规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子6——周期与主族周期:短周期(1—3);长周期(4—6,6周期中存在镧系);不完全周期(7)。
主族:ⅠA—ⅦA为主族元素;ⅠB—ⅦB为副族元素(中间包括Ⅷ);0族(即惰性气体)所以, 总的说来(1) 阳离子半径<原子半径(2) 阴离子半径>原子半径(3) 阴离子半径>阳离子半径(4 对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
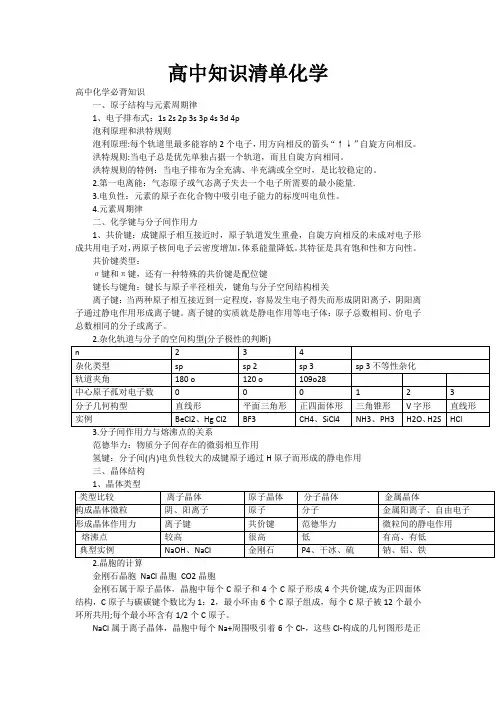
高中知识清单化学高中化学必背知识一、原子结构与元素周期律1、电子排布式:1s 2s 2p 3s 3p 4s 3d 4p泡利原理和洪特规则泡利原理:每个轨道里最多能容纳2个电子,用方向相反的箭头“↑↓”自旋方向相反。
洪特规则:当电子总是优先单独占据一个轨道,而且自旋方向相同。
洪特规则的特例:当电子排布为全充满、半充满或全空时,是比较稳定的。
2.第一电离能:气态原子或气态离子失去一个电子所需要的最小能量.3.电负性:元素的原子在化合物中吸引电子能力的标度叫电负性。
4.元素周期律二、化学键与分子间作用力1、共价键:成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间电子云密度增加,体系能量降低。
其特征是具有饱和性和方向性。
共价键类型:σ键和π键,还有一种特殊的共价键是配位键键长与键角:键长与原子半径相关,键角与分子空间结构相关离子键:当两种原子相互接近到一定程度,容易发生电子得失而形成阴阳离子,阴阳离子通过静电作用形成离子键。
离子键的实质就是静电作用等电子体:原子总数相同、价电子总数相同的分子或离子。
范德华力:物质分子间存在的微弱相互作用氢键:分子间(内)电负性较大的成键原子通过H原子而形成的静电作用三、晶体结构2.晶胞的计算金刚石晶胞NaCl晶胞CO2晶胞金刚石属于原子晶体,晶胞中每个C原子和4个C原子形成4个共价键,成为正四面体结构,C原子与碳碳键个数比为1:2,最小环由6个C原子组成,每个C原子被12个最小环所共用;每个最小环含有1/2个C原子。
NaCl属于离子晶体,晶胞中每个Na+周围吸引着6个Cl-,这些Cl-构成的几何图形是正八面体,每个Cl-周围吸引着6个Na+,Na+、Cl-个数比为1:1,每个Na+与12个Na+等距离相邻,每个氯化钠晶胞含有4个Na+和4个Cl-。
干冰属于分子晶体。
晶胞中每个CO2分子周围最近且等距离的CO2有12个。
1个晶胞中含有4个CO2金属晶体:金属Na、K、Cr、Mo(钼)、W等中金属原子堆积方式是体心立方堆积,原子的`配位数为8,一个晶胞中含有2个原子。

高中化学晶体知识点高中化学教材中的晶体内容是微观分子、原子结构与宏观物质产生联系的桥梁。
为了帮助高中生掌握晶体知识点,下面小编为高中生整理化学晶体知识点,希望对大家有所帮助。
高中化学晶体知识点石墨――混合型晶体石墨晶体为层状结构,层与层之间的作用力为范德华力,每一层内C 原子间以共价键形成正六边形结构(见图8)。
由于层内C原子以较强的共价键相结合,所以石墨有较高的熔点。
但由于层间的范德华力较弱,层间可以滑动,故石墨的硬度较小。
因此石墨晶体又称为过渡型晶体或混合型晶体。
石墨品体中每个C原子只拥有其所连接的3个C-C键的1/2(3/2个),因此晶体中C原子与C-C键数之比为2:3。
干冰――分子晶体干冰晶体中的CO2分布在立方体的顶点和面心上,分子间由分子间作用力结合形成晶体(见图7)。
C02分子内存在共价键,因此晶体中既有分子间作用力,又有共价键,但熔、沸点的高低由分子间的作用力决定,影响分子间作用力的主要因素是相对分子质量,从晶胞的结构可知与一个CO2分子距离最近且相等的CO2分子共有12个。
金刚石、二氧化硅—原子晶体(1)金刚石是一种具有空间网状结构的原子晶体。
每个C原子以共价键与其他4个C原子紧邻,由5个碳子形成正四面体的结构单元,由共价键构成的最小环结构中有6个碳原子(见图4),由于每个C原子拥有所连4个C-C键的1/2(2个),所以碳原子个数与C-C键数之比为1:2。
(2)二氧化硅晶体可以看成是金刚石结构中,C原子被Si原子代替,且在C-C键之间插入O原子后形成的,即每个硅原子与周围的四个氧原子构成一个正四面体,构成二氧化硅晶体结构的最小环是由12个原子构成椅式环,键角(O-Si-O)=1O928(见图5)。
每个Si原子拥有所连4个O原子的1/2(2个)(见图6),因此si、O原子个数比为1:2,即化学式表示为SiO2。
氯化钠、氯化铯晶体离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。


原子晶体相关知识点总结一、晶体结构的基本概念1. 晶体的定义和特点晶体是由原子、离子或分子按一定的规律排列而成的固体结构。
晶体的特点包括:具有有序的、周期性的结构;具有长程的周期性和短程的无规则性;具有固定的晶格结构。
2. 晶体结构的基本要素晶体结构的基本要素包括:元胞、晶格、晶体结构。
3. 元胞元胞是晶体的最小重复单元,具有晶体的全部结构信息。
元胞可以是点阵、面阵或体阵。
4. 晶格晶格是由全部元胞排列而成的三维空间点阵。
晶格可以由晶体的离散转移对称元素所生成。
5. 晶体结构晶体结构是指晶体中原子、离子或分子的排列方式和排列规律。
根据晶体结构的不同,晶体可以分为简单晶体、复合晶体和混合晶体。
6. 点阵和晶体结构的关系晶体结构是由晶格和晶胞所共同决定的。
晶格提供了晶体结构的周期性和可重复性,晶胞提供了晶体结构的具体排列方式。
二、晶体的分类1. 晶体的分类方法晶体可以按照结构、成分和形态等不同特征进行分类。
2. 按照结构分类按照结构分类可以分为金属晶体、离子晶体、共价晶体、分子晶体和简单晶体等类型。
3. 按照成分分类按照成分分类可以分为单组分晶体和多组分晶体。
4. 按照形态分类按照形态分类可以分为正方晶体、六方晶体、菱形晶体、正四面体晶体、八面体晶体等类型。
三、晶体的性质1. 光学性质晶体的光学性质是指晶体对不同波长和振动方向的入射光产生的吸收、散射、透射和偏振现象。
晶体的光学性质和晶体结构之间具有密切的联系。
2. 电学性质晶体的电学性质是指晶体在不同的电场和电磁场作用下产生的电极化、介电常数和电导率等现象。
晶体的电学性质和晶体结构之间具有密切的联系。
3. 热学性质晶体的热学性质是指晶体在不同的温度和热量作用下产生的热膨胀、热导率和比热容等现象。
晶体的热学性质和晶体结构之间具有密切的联系。
4. 磁学性质晶体的磁学性质是指晶体在外部磁场作用下产生的磁化、磁导率和磁畴等现象。
晶体的磁学性质和晶体结构之间具有密切的联系。
高二化学下册《离子晶体》知识点归纳在学习新知识的同时,既要及时跟上老师步伐,也要及时复习巩固,知识点要及时总结,这是做其他练习必备的前提,下面为大伙儿总结了离子晶体知识点归纳,认真阅读哦。
1.什么是分子晶体、原子晶体和金属晶体?
2.下列物质的固体中哪些是分子晶体?哪些是原子晶体?哪些是金属晶体?
干冰? 金刚石?? 冰?? 铜?? 水晶? 碳化硅?? NaCl?? CsCl
讲述:明显,氯化钠、氯化铯固体的构成微粒不是前面所讲的分子、原子,离子之间的作用力也不一样,这确实是我们今天要学习的一种新的晶体类型。
一、离子晶体
1.离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
活动1:展现氯化钠、氯化铯晶体结构,摸索这两种晶体的构成微粒、离子之间的作用力是什么?
归纳小结:
(1)离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
(2)离子晶体的构成微粒是离子,离子间的作用力为离子键。
2.离子晶体的类别
活动2:摸索我们学过的物质中哪些类型的物质是离子晶体?
归纳:强碱、爽朗金属氧化物、绝大多数盐
有了上文为大伙儿总结的离子晶体知识点归纳,大伙儿及时提早复习,在考试中一定能取得好成绩。
高三化学晶体知识点总结晶体是由具有一定规律的结构排列所构成的,是我们在化学学习中经常接触到的重要概念。
本文将对高三化学晶体知识点进行总结,帮助同学们更好地理解和应用相关知识。
一、晶体的概念及特点晶体是由大量相同的基本微粒按照一定的排列方式而形成的固体物质。
它具有以下特点:1. 有规则的几何外形:晶体一般具有规则的几何外形,比如矩形、立方体等。
2. 有一定的硬度和脆性:晶体通常具有一定的硬度,但也容易在外力作用下发生断裂。
3. 固定的熔点和热稳定性:晶体在特定的温度下具有固定的熔点,且在高温下热稳定性较好。
4. 具有高度有序的结构:晶体内部的原子、离子或分子具有高度有序的排列方式,呈现出周期性的结构。
二、晶体的分类根据晶体内部原子、离子或分子的排列方式,晶体可以分为以下几种类型:1. 离子晶体:由正负离子按照一定比例排列而成的晶体,如氯化钠晶体。
2. 分子晶体:由分子按照一定方式排列而成的晶体,如冰晶体。
3. 原子晶体:由单质原子或相同元素原子按照一定方式排列而成的晶体,如金刚石晶体。
三、晶体的晶格晶体的内部结构由晶格和晶胞组成。
晶格是指晶体中的周期性排列,而晶胞是具有这种周期性结构的基本单位。
常见的晶格结构有:1. 简单立方晶格:每个晶胞内只有一个晶体微粒,其顶点处分别有六个相邻立方晶胞。
2. 面心立方晶格:每个晶胞内有一个晶体微粒位于晶胞的每个面的中心,其顶点处有八个相邻面心立方晶胞。
3. 体心立方晶格:每个晶胞内有一个晶体微粒位于晶胞的中心,其顶点和晶胞中心共有八个相邻体心立方晶胞。
四、晶体的性质晶体具有多种特殊的物理性质,其中包括:1. 折射性:晶体对光有较强的折射作用,即出射光线的传播方向发生偏折。
2. 双折射性:某些晶体在特定方向上具有双折射现象,即将一束入射光分为两束独立的出射光。
3. 压电效应:某些晶体在受到外力作用时会产生电荷分离,表现出压电效应。
4. 热膨胀性:晶体在受热后会发生体积膨胀,热膨胀系数一般与晶向有关。
离子晶体、分子晶体和原子晶体[学法指导]在学习中要加强对化学键中的非极性键、极性键、离子键、晶体类型及结构的认识与理解;在掌握粒子半径递变规律的基础上,分析离子晶体、原子晶体、分子晶体的熔点、沸点等物理性质的变化规律;并在认识晶体的空间结构的过程中,培养空间想象能力及思维的严密性和抽象性。
同时,关于晶体空间结构的问题,很容易与数学等学科知识结合起来,在综合题的命题中具有广阔的空间,因此,一定要把握基础、领会实质,建立同类题的解题策略和相应的思维模式。
[要点分析]一、晶体固体可以分为两种存在形式:晶体和非晶体。
晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。
气体、液体和非晶体在一定条件下也可转变为晶体。
晶体是经过结晶过程而形成的具有规则的几何外形的固体。
晶体中原子或分子在空间按一定规律周期性重复的排列,从而使晶体内部各个部分的宏观性质是相同的,而且具有固定的熔点和规则的几何外形。
NaCl晶体结构食盐晶体金刚石晶体金刚石晶体模型钻石C60分子二、晶体结构1.几种晶体的结构、性质比较2.几种典型的晶体结构:(1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。
(2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。
(3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展,键角都是109°28',最小的碳环上有六个碳原子。
(4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有两个碳原子。
片层间存在范德华力,是混合型晶体。
熔点比金刚石高。
(5)干冰(如图6):分子晶体。
(6)SiO2:原子晶体,空间网状结构,Si原子构成正四面体,O原子位于Si-Si键中间。
高二化学分子晶体和原子晶体知识点梳理
(2021最新版)
作者:______
编写日期:2021年__月__日
(一)分子晶体:构成晶体的微粒间通过分子间作用力相互作用所形成的晶体,称为分子晶体。
分子晶体中存在的微粒是分子,不存在离子。
较典型的分子晶体有非金属氢化物,部分非金属单质,部分非金属氧化物,几乎所有的酸,绝大多数有机物的晶体等。
分子晶体中存在的相互作用力主要是分子间作用力,它是分子间存在着一种把分子聚集在一起的作用力,叫做分子间作用力,也叫范?曰?力。
分子间作用力只影响物质的熔沸点、硬度、密度等物理性质,分子晶体一般都是绝缘体,熔融状态不导电。
对于某些含有电负性很大的元素的原子和氢原子的分子,分子间还可以通过氢键相互作用。
氢键的形
成条件:它是由已经与电负性很强的原子形成共价键的氢原子与另一分子中电负性很强的原子之间的作用力形成,(它不属于化学键)一般表示为X?DH…Y。
这种静电吸引作用就是氢键。
氢键同样只影响物质的熔沸点和密度,对物质的化学性质没有影响分子晶体的结构特征:没有氢键的分子密堆积排列,如CO2等分子晶体,分子间的作用力主要是分子间作用力,以一个分子为中心,每个分子周围有12个紧邻的分子存在。
还有一类分子晶体,其结构中不仅存在分子间作用力,同时还存在氢键,如:冰。
此时,水分子间的主要作用力是氢键,每个水分子周围只有4个水分子与之相邻。
称为非密堆积结构。
说明:1、分子晶体的构成微粒是分子,分子中各原子一般以共价键相结合。
因此,大多数共价化合物所形成的晶体为分子晶体。
如:部分非金属单质、非金属氢化物、部分非金属氧化物、几乎所有的酸以及绝大多数的有机物等都属于分子晶体。
但并不是所有的分子晶体中都存在共价键,如:由单原子构成的稀有气体分子中就不存在化学键。
也不是共价化合物都是分子晶体,如二氧化硅等物质属于原子晶体。
2、由于构成晶体的微粒是分子,因此分子晶体的化学式可以表示其分子式,即只有分子晶体才存在分子式。
3、分子晶体的微粒间以分子间作用力或氢键相结合,因此,分子晶体具有熔沸点低、硬度密度小,较易熔化和挥发等物理性质。
4、影响分子间作用力的大小的因素有分子的极性和相对分子质量的大小。
一般而言,分子的极性越大、相对分子质量越大,分子间作用力越强。
5、分子晶体的熔沸点的高低与分子的结构有关:在同样不存在氢键时,组成与结构相似的分子晶
体,随着相对分子质量的增大,分子间作用力增大,分子晶体的熔沸点增大;对于分子中存在氢键的分子晶体,其熔沸点一般比没有氢键的分子晶体的熔沸点高,存在分子间氢键的分子晶体的熔沸点比存在分子内氢键的分子晶体的熔沸点高。
6、分子晶体的溶解性与溶剂和溶质的极性有关:一般情况下,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂?D?D这就是相似相溶原理。
(二)原子晶体:相邻原子间以共价键相结合而形成的空间网状结构的晶体称为原子晶体。
构成原子晶体的微粒是原子,微粒间的相互作用力是共价键,由于共价键的键能比分子间作用力要大得多,因此原子晶体具有很高的熔沸点和硬度,一般不导电(硅属于半导体材料),一般不溶于溶剂等性质。
常见的原子晶体有:金刚石、晶体硅、二氧化硅和碳化硅等。
2、原子晶体中原子间以共价键相互连接,但并不是存在共价键的晶体就是原子晶体。
如:水、干冰等晶体都存在共价键,但它们属于分子晶体。
3、判断晶体类型的依据:(1)看构成晶体的微粒种类及微粒间的相互作用。
对分子晶体,构成晶体的微粒是分子,微粒间的相互作用是分子间作用力;对于原子晶体,构成晶体的微粒是原子,微粒间的相互作用是共价键。
(2)看物质的物理性质(如:熔、沸点或硬度)。
一般情况下,不同类晶体熔点高低顺序是原子晶体比分子晶体的熔、沸点高得多,硬度、密度也要大得多。
(3)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电; 原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(4)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
5、CO2、SiO2都属于第ⅣA
族的氧化物,但两者的熔沸点、硬度等物理性质存在较大的差异,但CO2却比SiO2稳定得多:主要是因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而SiO2是破坏化学键。
所以SiO2熔沸点高。
而破坏CO2分子与SiO2时,都是破坏共价键,而C-O 键能>Si-O键能,所以CO2分子更稳定。