定量荧光资料
- 格式:ppt
- 大小:1.20 MB
- 文档页数:8




荧光定量PCR之绝对定量分析——标准曲线的绘制1.绝对定量定义绝对定量是用已知浓度的标准品绘制标准曲线来推算未知样品的量。
将标准品稀释至不同浓度,作为模板进行PCR反应。
以标准品拷贝数的对数值为横坐标,以测得的CT值为纵坐标,绘制标准曲线,对未知样品进行定量时,根据未知样品的CT值,即可在标准曲线中得到样品的拷贝数。
______________ _____ _♦ Log(起始浓度)与循环数呈线性关系,通过已知起始拷贝数的标准品可作出标准曲线,即得到该扩增反应存在的线性关系CT值,就可以计算出样品中所含的模板量♦由样品厂闻w I it 厂Of”他 *标准品的一些标准*必须用与扩增目的基因相同的引物进行扩增,并且扩增效率相同♦标准品必须是经过准确定量的(我们通常用的是ASP-3700紫外光/可见光微量分光光度计)*标准品必须是标准化的(例如,同一化的细胞数)*在每组实验时,必须用相同的阈值设定来确定CT值 _____标准品可以是含有目的基因的线性化的质粒DNA,也可以是比扩增片段长的纯化后的PCR产物,当然也可以是基因组DMA,甚至cDNA,但前提是所有的作为标准品的核酸都必须保证稳定。
3.标准品的制备RNA-cDNAPCR<一般一条标准曲线取四到五个点,浓度围要能覆盖样品的浓度区间,以保证定量的准确性。
一般一个点重复三至五次,对于常期稳定使用的标准品可以适当减少重复 的次数。
倍比梯度稀释方法:1V 原液(标准品i) +9v 稀释缓冲液,得标准品ii lv 标准品ii+9v 稀释缓冲液,得标准品iii lv 标准品iii+9v 稀释缓冲液,得标准品iv lv 标准品iv+9v 稀释缓冲液,得标准品v 依次倍比稀释拷贝数的计算:详见核酸拷贝数的计算4. ________________________________________________________________________ 实例 ________________________________________________________________________________ 标准品的制作:将标准品依次进行10倍稀释,ASP-3700测得其拷贝数1.55X 108copy /ul 标准曲线的绘制(lcycle=lmin)设置对照:浓度为 1.55X107, 1.55X106、1.55X105, 1.55X104、1.55X103, 1.55X 102. 1.55X101的标准样品各一个,设空白对照PCR 反应:以不同浓度标准品作为模板标准品的扩增曲线半学半 g 购hi 上fola&kLdn 丄胡叶.型 _LLii?并吃 I 025SD0 4IK4 D.2Q51F oo )wo- MSI”?.8 门&&2 0592D1 WWb♦ ・bioask +cn+山5"叽6), J-n-sspdocs)' —HFi —-HrH空白対腮训3叽cnB 1512 i<1« 2D 22 Z< 2623 JD 12 洌 3(- J8 -It 农仏僱伦 W %54 M 5B W<yii»标准品的溶解曲线n>o o o o*J.1 t 9 |L 广 制.T_ 1玉 75£s £s s £7.寰57養45.S 92M .S SM SJ a J 201.S Zo.nBRD ・i583s君a £22s£s須34.293.23 代5 M S I593650O b -・6 2・8s 5・2 6」7・6 ogunma- copyrulmbera^rw勢盖扩增效率(E)计算E二10-1/斜率=10-1/-3. 23-2. 04, E%= (2. 04-1) X100%= 104%若未知样本的CT值为19.11,将CT值代入线性方程: 即19. 11=34.29-3. 23X,所以X=(19. 11-34. 29)/(-3. 23)-4. 7 Quantityunknow-104. 7-50118 copies。

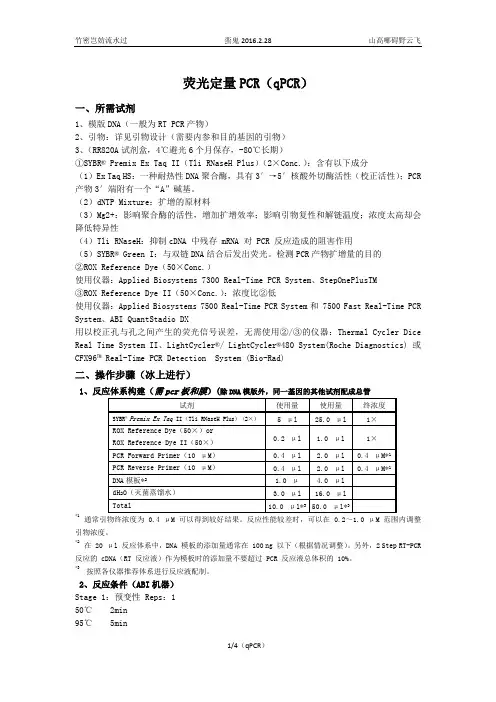
荧光定量PCR(qPCR)一、所需试剂1、模版DNA(一般为RTPCR产物)2、引物:详见引物设计(需要内参和目的基因的引物)3、(RR820A试剂盒,4℃避光6个月保存,-80℃长期)①SYBR® Premix Ex Taq II(TliRNaseH Plus)(2×Conc.):含有以下成分(1)Ex Taq HS:一种耐热性DNA聚合酶,具有3′→5′核酸外切酶活性(校正活性);PCR 产物3′端附有一个“A”碱基。
(2)dNTP Mixture:扩增的原材料(3)Mg2+:影响聚合酶的活性,增加扩增效率;影响引物复性和解链温度;浓度太高却会降低特异性(4)TliRNaseH:抑制cDNA 中残存 mRNA 对 PCR 反应造成的阻害作用(5)SYBR® Green I:与双链DNA结合后发出荧光。
检测PCR产物扩增量的目的②ROX Reference Dye(50×Conc.)使用仪器:Applied Biosystems 7300 Real-Time PCR System、StepOnePlusTM③ROX Reference Dye II(50×Conc.):浓度比②低使用仪器:Applied Biosystems7500 Real-Time PCR System和 7500 Fast Real-Time PCR System、ABI QuantStadio DX用以校正孔与孔之间产生的荧光信号误差,无需使用②/③的仪器:Thermal Cycler Dice Real Time System II、LightCycler®/ LightCycler®480 System(Roche Diagnostics) 或CFX96™ Real-Time PCR Detection System (Bio-Rad)二、操作步骤(冰上进行)1、反应体系构建()(除DNA模版外,同一基因的其他试剂配成总管*1通常引物终浓度为 0.4 μM 可以得到较好结果。

荧光定量PCR手册一、什么是荧光定量 PCR荧光定量 PCR(Quantitative Realtime PCR,qPCR)是一种在 DNA 扩增反应中,通过荧光信号的实时监测来定量分析特定核酸序列的技术。
简单来说,它能告诉我们样本中特定基因的数量有多少。
这一技术在生物学、医学、农学等众多领域都发挥着重要作用。
比如,在医学诊断中,能检测病毒或细菌的感染量;在基因研究中,可分析基因的表达水平。
二、荧光定量 PCR 的原理荧光定量 PCR 的原理基于传统的 PCR 技术,但增加了荧光检测的环节。
在 PCR 反应中,DNA 会被不断复制。
我们会在反应体系中加入一种特殊的荧光探针或荧光染料。
这些荧光物质的荧光强度会随着 PCR 反应的进行而发生变化。
当 PCR 反应开始时,荧光信号很弱。
随着反应的进行,DNA 不断扩增,荧光信号逐渐增强。
通过检测荧光信号的强度变化,我们就能实时了解 PCR 反应的进程,并计算出初始样本中目标 DNA 的含量。
三、荧光定量 PCR 的实验流程(一)样本准备首先,需要从待检测的生物样本(如血液、组织、细胞等)中提取出 DNA 或 RNA。
提取的质量和纯度对后续实验结果至关重要。
(二)引物和探针设计设计合适的引物和探针是关键步骤。
引物是一小段能与目标 DNA 序列特异性结合的寡核苷酸,它们决定了 PCR 反应扩增的区域。
探针则用于检测扩增产物,通常带有荧光标记。
(三)PCR 反应体系配置将提取的核酸模板、引物、探针、酶、缓冲液、dNTPs 等试剂按照一定的比例混合,配置成 PCR 反应体系。
(四)PCR 反应将配置好的反应体系放入荧光定量 PCR 仪中,设置好反应程序,进行 PCR 反应。
(五)数据分析PCR 反应结束后,仪器会给出荧光信号的变化曲线。
通过对这些曲线进行分析,可以得出目标基因的初始含量。
四、荧光定量 PCR 的关键要素(一)引物和探针的设计引物和探针的特异性、长度、GC 含量等都会影响 PCR 反应的效率和特异性。


荧光定量PCR实验及数据分析一、概述荧光定量PCR(Quantitative Realtime PCR,简称qPCR)是一种结合了PCR技术的高灵敏度和荧光探针技术的实时定量特性的分子生物学分析方法。
该方法通过实时监测PCR反应过程中荧光信号的变化,对模板DNA或RNA的初始浓度进行定量分析。
荧光定量PCR技术在基因表达研究、病原体检测、基因突变分析以及药物疗效评估等领域具有广泛的应用价值。
在荧光定量PCR实验中,通常使用特异性引物和荧光探针来识别并扩增目标序列。
荧光探针的设计是关键步骤之一,它必须能够与目标序列特异性结合并在PCR过程中产生可检测的荧光信号。
实验过程中还需严格控制反应条件,包括温度、时间、引物和探针的浓度等,以确保实验的准确性和可重复性。
数据分析是荧光定量PCR实验不可或缺的一部分。
通过对实验数据的收集、整理和分析,可以获取目标序列的初始浓度信息,进而对实验结果进行解读和评估。
数据分析方法包括相对定量和绝对定量两种,前者通过比较不同样本间目标序列的相对表达量来评估差异,后者则通过标准曲线法或质粒拷贝数法等方法来确定目标序列的绝对浓度。
荧光定量PCR技术是一种高效、灵敏且特异的分子生物学分析方法,对于研究基因表达、病原体检测等领域具有重要意义。
通过不断优化实验操作和数据分析方法,可以进一步提高荧光定量PCR实验的准确性和可靠性,为科学研究和临床实践提供有力支持。
1. 荧光定量PCR技术的概述荧光定量PCR技术,是一种基于DNA聚合酶链式反应的分子生物学技术,它通过引入荧光标记,实时监测PCR过程中目标DNA片段的扩增情况,从而实现对特定基因拷贝数的精确量化。
该技术结合了PCR的高效扩增能力与荧光信号的灵敏检测,使得微量DNA分子的检测成为可能,并在遗传学、分子生物学、医学诊断等领域中发挥着重要作用。
荧光定量PCR技术主要依赖于特异性引物和探针的设计,使得PCR扩增过程具有高度的特异性。

荧光定量报告单背景荧光定量是一种常用的实验技术,用于测量样品中特定分子的浓度。
这种技术利用荧光染料的特性,通过测量样品中荧光信号的强度来推断目标分子的浓度。
荧光定量广泛应用于生物医学研究、环境监测、食品安全等领域。
分析实验设计本次荧光定量实验旨在测量样品中某特定分子的浓度。
实验过程包括以下几个步骤:1.样品制备:收集待测样品,并进行必要的前处理步骤,如离心、过滤等。
2.荧光标记:使用特定的荧光染料对目标分子进行标记,使其发出荧光信号。
3.荧光测量:将标记后的样品置于荧光分析仪中,测量荧光信号的强度。
4.标准曲线绘制:准备一系列已知浓度的标准溶液,分别测量其荧光信号强度,绘制标准曲线。
5.浓度计算:根据标准曲线,通过插值或拟合的方法,计算出待测样品中目标分子的浓度。
结果根据实验设计,我们成功测量了待测样品中目标分子的浓度,并得到了如下结果:样品编号荧光信号强度目标分子浓度1 100 22 200 43 300 64 400 8通过测量标准曲线上的标准溶液,我们得到了如下的标准曲线方程:荧光信号强度 = 50 * 目标分子浓度讨论根据标准曲线方程,我们可以计算出待测样品中目标分子的浓度。
比如,样品5的荧光信号强度为250,代入标准曲线方程,可以计算出样品5中目标分子的浓度为5。
需要注意的是,荧光定量的准确性受到多种因素的影响,包括荧光染料的选择、实验条件的控制、仪器的精度等。
在进行荧光定量实验时,需要仔细选择合适的荧光染料,并进行实验条件的优化和仪器的校准,以提高测量结果的准确性。
建议根据本次荧光定量实验的结果和讨论,我们提出以下建议:1.在进行荧光定量实验时,应选择合适的荧光染料,并进行前处理步骤,以提高测量结果的准确性。
2.对于待测样品中目标分子浓度较高的情况,可以适当稀释样品,以避免荧光信号过强而超出荧光分析仪的测量范围。
3.在绘制标准曲线时,应使用多个标准溶液,以覆盖待测样品中目标分子浓度的范围,以提高浓度计算的准确性。

两种不同术式治疗老年人股骨颈骨折疗效比较目的:比较人工股骨头置换术与全髋关节置换术治疗老年人股骨颈骨折的临床疗效。
方法:回顾性分析2011年1月一2012年12月我院所收治的老年股骨颈骨折患者48例,随机分为两组,对照组22例行股骨头置换术,观察组26例行全髋关节置换术,比较2组手术时情况、术后关节功能恢复情况。
结果:对照组在手术时间、术中出血量、住院时间及术后下地时间方面均明显优于观察组,P<0.05,差异有统计学意义;对照组术后并发症及翻修率高于观察组,P<0.05,差异有统计学意义;对照组术后1年、2年Harris评分优良率分别为72.73%、63.64%,观察组为88.46%、80.77%,观察组明显优于对照组,P<0.05,差异有统计学意义。
结论:人工股骨头置换具有手术时间短、创伤小等优点,而全髋关节置换术远期疗效优于人工股骨头置换术,两种手术方法各有优缺点,治疗时应根据患者病情具体分析。
标签:股骨颈骨折;全髋关节置换术;人工股骨头置换术;老年人随着我国人口的老龄化,老年人股骨颈骨折的发病率也逐年上升,严重危害着老年人的正常生活。
根据骨折特点,选择一种安全、有效的治疗方案是改善预后、提高救治效果的关键。
而保守治疗和各种内固定治疗都有较高的骨不愈合及股骨头缺血坏死[1],仅有约25%可恢复功能,因此临床上在无明确手术禁忌证的情况下,多主张进行手术治疗。
目前,人工股骨头置换术和全髋置换术是治疗有移位的老年人股骨颈骨折的的主要方法,但二者的适应证及利弊方面尚存广泛争议。
本文将48例老年人股骨颈骨折患者,按手术方法不同将其分为两组,对照组行股骨头置换术,观察组行全髋关节置换术,将两组的手术时情况、术后并发症的发生情况及术后关节功能恢复情况等项指标进行对比,以探讨治疗老年人股骨颈骨折最佳手术方式。
现将分析结果报告如下。
1一般资料与方法1.1一般资料从我院2011年1月一2012年12月收治的股骨颈骨折患者中,选出年龄>60岁患者48例,其中男21例,女27例;平均年龄72.5±8.6岁;其中39例新鲜骨折,9例陈旧骨折;骨折类型:头下型21例,经颈型25例,头颈型1例,基底型1例;按Garden分型:Ⅲ型34例,Ⅳ型14例;致伤原因:摔伤32例,车祸伤16例。
荧光定量pcr的原理荧光定量PCR的原理。
荧光定量PCR(quantitative PCR,qPCR)是一种用于检测和定量DNA或RNA分子的技术,它结合了PCR扩增和荧光信号检测的方法,可以实现对目标分子数量的准确测量。
在本文中,我们将详细介绍荧光定量PCR的原理及其在科研和临床中的应用。
首先,让我们来了解一下PCR的基本原理。
PCR是一种体外扩增DNA片段的技术,它通过反复进行三步循环,即变性、退火和延伸,使目标DNA片段在体外得以扩增。
在PCR的过程中,引物(primers)与目标DNA序列特异性结合,DNA聚合酶(DNA polymerase)在引物的引导下合成新的DNA链,最终形成两倍于原始DNA的目标序列。
荧光定量PCR在PCR基础上增加了荧光信号的检测,通过监测荧光信号的强度来实现对PCR产物的定量分析。
在荧光定量PCR中,通常会使用DNA结合染料或探针来标记PCR产物,当PCR进行到一定程度时,荧光信号的强度与起始模板DNA的数量成正比。
通过测量荧光信号的强度,可以准确地定量PCR产物的数量,从而实现对起始模板DNA的定量分析。
在荧光定量PCR中,常用的荧光探针包括SYBR Green和TaqMan探针。
SYBR Green是一种DNA结合染料,它可以与PCR产物结合并发出荧光信号,因此可以用来实现对PCR产物的定量分析。
而TaqMan探针则是一种特殊的探针,它包含一个荧光素和一个荧光猝灭剂,当TaqMan探针与PCR产物结合时,荧光信号会被释放出来,从而实现对PCR产物的定量分析。
荧光定量PCR在科研和临床中有着广泛的应用,例如在基因表达分析、病原体检测、遗传疾病诊断等领域都有着重要的作用。
通过荧光定量PCR,我们可以快速、准确地检测和定量目标DNA或RNA分子,为科研和临床诊断提供了有力的工具。
总之,荧光定量PCR是一种重要的分子生物学技术,它结合了PCR扩增和荧光信号检测的方法,可以实现对DNA或RNA分子的定量分析。
荧光定量PCR(Quantitative Real-Time PCR,简称qPCR)是一种分子生物学技术,用于精确测定样本中特定核酸序列的数量。
其基本原理基于PCR(聚合酶链式反应)技术和实时荧光检测,能够在PCR扩增过程中连续监测荧光信号的变化,从而实现对起始模板量的定量分析。
荧光定量PCR原理简述:1.PCR扩增:qPCR采用传统的PCR方法,包括变性(DNA双链解开成单链)、退火(引物与靶序列配对)和延伸(DNA聚合酶合成新链)这三个基本步骤,反复进行使得目标序列指数级扩增。
2.荧光标记与检测:SYBR Green法:SYBR Green是一种非特异性的双链DNA结合染料,在游离状态下几乎不发出荧光,但一旦与双链DNA结合后,荧光强度显著增强。
因此,随着PCR过程中的产物增加,荧光信号也相应增加,荧光强度与PCR产物的数量成正比。
TaqMan探针法:此方法更为特异,使用一种特殊的寡核苷酸探针,其两端分别标记了荧光报告基团和淬灭基团。
在PCR反应中,当探针与靶序列配对时,位于中间的探针被Taq 酶水解,导致荧光报告基团与淬灭基团分离,从而产生荧光信号。
只有当特定的扩增产物生成时才会释放荧光。
荧光定量PCR实验步骤概览:1.样品制备:RNA提取:从组织、细胞或其他生物样本中提取总RNA,常用TRIZOL或类似试剂进行裂解、离心分相和乙醇沉淀来纯化RNA。
cDNA合成:对于mRNA的定量,需要先将RNA逆转录为cDNA。
2.设计与合成引物:针对目标基因设计一对特异性的PCR引物,用于扩增目的片段。
3.PCR反应体系构建:将纯化的cDNA或DNA模板、特异性引物、Taq聚合酶、缓冲液、dNTPs和其他必要成分如SYBR Green染料或TaqMan探针等加入至PCR管中,配置成最终的PCR反应体系。
4.实时荧光PCR扩增与检测:在荧光定量PCR仪上进行PCR反应,仪器在每次循环的适当阶段收集荧光信号,并记录下来。
荧光定量pcr收集信号摘要:1.荧光定量PCR简介2.荧光定量PCR信号收集原理3.荧光定量PCR实验流程4.荧光定量PCR在生物科学研究中的应用5.我国荧光定量PCR技术的发展与挑战正文:荧光定量聚合酶链反应(polymerase chain reaction,PCR)是一种在体外将特定DNA片段快速扩增的技术。
通过荧光定量PCR,研究者可以在短时间内获得大量目标DNA序列,以便进行进一步分析。
在这个过程中,荧光信号的收集和检测是关键环节。
荧光定量PCR信号收集的原理是利用荧光染料与目标DNA序列结合,通过检测荧光信号的强度来定量目标DNA的数量。
通常使用的荧光染料有两类:一种是荧光探针,可以与目标DNA序列特异性结合;另一种是荧光标记的引物,可以与目标DNA序列的延伸过程中结合。
当PCR反应进行时,荧光染料与目标DNA序列结合,产生荧光信号。
通过实时监测荧光信号的强度,可以了解目标DNA序列的数量。
荧光定量PCR实验流程包括以下几个步骤:1.设计引物:根据目标DNA序列合成一对特异性引物。
2.样本处理:从实验样本中提取DNA。
3.PCR反应:将提取的DNA与引物、荧光染料、缓冲液等混合,进行PCR反应。
4.信号收集:通过荧光检测仪器实时监测荧光信号的强度。
5.数据分析:根据荧光信号的强度计算目标DNA序列的数量。
荧光定量PCR技术广泛应用于生物科学研究,如基因表达调控、基因突变检测、病原体检测等领域。
在我国,荧光定量PCR技术得到了迅速发展,但仍面临一些挑战,如仪器设备的研发与更新、实验操作的标准化、数据分析的准确性和可重复性等。
荧光定量法摘要:一、荧光定量法的概述二、荧光定量法的原理三、荧光定量法的应用领域四、荧光定量法的优缺点五、荧光定量法的发展前景正文:荧光定量法是一种基于荧光强度与物质浓度成正比的原理,对特定目标物质进行定量检测的方法。
荧光定量法具有高灵敏度、高特异性、快速、简便等优点,被广泛应用于生物学、医学、环境监测等领域。
一、荧光定量法的概述荧光定量法,顾名思义,是一种基于荧光原理的定量检测方法。
荧光物质在受到外部刺激(如紫外光照射)后,会发出特定波长的荧光,其强度与荧光物质的浓度成正比。
利用这一特性,可以对目标物质进行定量检测。
二、荧光定量法的原理荧光定量法的原理主要基于两个方面:荧光的产生和荧光强度与物质浓度的关系。
首先,荧光物质在受到外部刺激后,会产生荧光;其次,荧光强度与荧光物质的浓度成正比,这意味着可以通过测量荧光强度来推算物质的浓度。
三、荧光定量法的应用领域荧光定量法在多个领域都有广泛应用,包括生物学、医学、环境监测等。
在生物学领域,荧光定量法可以用于检测蛋白质、核酸等生物大分子;在医学领域,荧光定量法可以用于检测病原微生物、肿瘤标志物等;在环境监测领域,荧光定量法可以用于检测重金属离子、有机污染物等。
四、荧光定量法的优缺点荧光定量法具有高灵敏度、高特异性、快速、简便等优点,但也存在一些局限性。
例如,荧光定量法对于样品的要求较高,需要样品具有一定的荧光特性;此外,荧光定量法可能受到其他物质的干扰,需要进行严格的质量控制。
五、荧光定量法的发展前景随着科学技术的进步,荧光定量法在各个领域的应用将更加广泛。
同时,新型荧光物质的开发、仪器设备的改进等都将进一步推动荧光定量法的发展。