高中化学1——物质分类与转化
- 格式:doc
- 大小:62.50 KB
- 文档页数:5

第1单元课时1物质的分类及转化一、学习目标1.知道化学科学的主要研究对象,知道化学是在分子层次上认识物质和合成新物质的一门科学。
2.初步认识物质的科学分类方法,学会从不同角度(尤其是物质的组成和性质角度)对常见物质进行分类。
认识分类等科学方法对化学研究的作用,能尝试运用比较、分类的方法对信息进行加工。
3.掌握四种基本反应类型,能根据化合价的变化判断是否氧化还原反应。
认识基本反应类型与氧化还原反应之间的关系。
4.了解化学家研究物质及其变化的方法和内容,体会化学的学科价值。
二、教学重点及难点物质的分类方法;物质之间的转化规律。
教学案:一、物质的分类[交流与讨论]按一定的依据对教材P3“交流与讨论”的物质进行分类。
引导得出结论:可以从不同的角度、用不同的标准对物质进行分类。
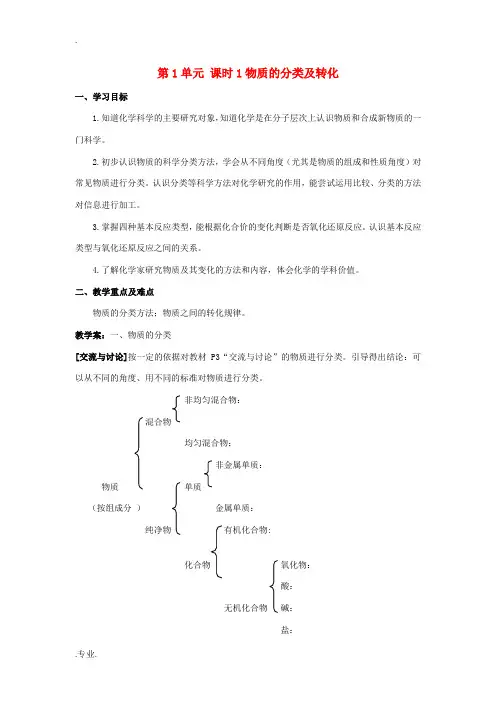
非均匀混合物:混合物均匀混合物:非金属单质:物质单质(按组成分)金属单质:纯净物有机化合物:化合物氧化物:酸:无机化合物碱:盐:……[问题解决]根据物质的组成对下列物质进行分类。
钙(Ca) 氯气(Cl2) 氯化钙(CaCl2)溶液硫酸(H2SO4) 碳酸钙(CaCO3) 氧化钙(CaO) 氢氧化钙[Ca(OH)2]。
例1:什么是酸?酸有哪些通性?举例并说明例2:什么是碱性氧化物?碱性氧化物有哪些通性?举例并说明例3:什么是酸性氧化物?酸性氧化物有哪些通性?举例并说明二、物质的转化哪些类别的物质之间可以发生转化?它们之间的转化需要怎样的条件?[交流与讨论]完成下表所列的物质的转化类型,并将你知道的其他的转化类型补充到表中。
物质的转化类型化学方程式单质化合物碱性氧化物碱酸性氧化物酸酸盐[交流与讨论]钙的金属活泼性比镁强,电解熔融的氯化钙可以得到金属钙和氯气,钙与氯气反应又能生成氯化钙。
请你尽可能多的写出表示图中物质之间转化的化学方程式,并将你的结果与同学交流讨论。
[讨论]根据化学反应的特点,我们也可将化学反应分为不同的反应类型来研究。
[整理与归纳]根据化学反应的特征(如参加反应的物质种类或种数),完成表1-4的填充。



高中化学必修一专题一:物质的分类及转化(经典实用)
物质的分类及转化是高中化学必修一的重要内容,该专题主要介绍了物质的分类方法和物质的转化规律。
以下是该专题的经典实用内容:
一、物质的分类方法:
1.按性质分类:可以根据物质的物理性质、化学性质、生物性
质等进行分类,如固体、液体、气体;酸、碱、盐等。
2.按组成分类:可以根据物质的基本组成单位进行分类,如元素、化合物、混合物等。
3.按来源分类:可以根据物质的来源进行分类,如天然物质和
人工合成物质等。
二、物质的转化规律:
1.物理变化:指物质在不改变其化学成分的情况下,发生形状、颜色、状态等方面的改变。
如溶解、汽化、凝固等。
2.化学变化:指物质在发生化学反应过程中,形成新的物质,
即产生化学变化。
如燃烧、酸碱中和、金属与酸反应等。
三、化学方程式:
1.化学方程式用化学符号和化学式表示化学反应的物质的种类
和数量关系。
反应物在化学方程式的左边,生成物在右边,用箭头分隔。
2.化学方程式还可以表示反应的摩尔比例关系和反应的能量变化。
四、化学反应的计算:
1.摩尔与质量的转化:可以利用化学方程式中物质的摩尔比例关系,通过已知物质的摩尔数或质量,计算其他物质的摩尔数或质量。
2.气体体积与摩尔数的关系:在一定的温度和压强下,气体的体积与物质的摩尔数成正比关系。
可以利用这一关系,计算反应物或生成物的摩尔数或体积。

人教版高中化学必修第一册《第一节物质的分类及转化》说课稿一、教材背景和教学目标1. 教材背景《第一节物质的分类及转化》是人教版高中化学必修第一册的第一节内容,介绍了化学的基本概念以及物质的分类及转化规律。
2. 教学目标•掌握基本化学概念,如物质、元素、化合物等;•熟悉物质的分类方法,并能根据不同的分类方法进行归类;•了解物质的转化规律,包括化学反应及其表示方法。
二、教学重点和难点分析1. 教学重点•物质的分类方法及其特点;•物质转化的基本规律。
2. 教学难点•理解物质的分类方法与元素、化合物的概念之间的关系;•理解物质转化规律与化学反应及其表示方法之间的关系。
三、教学过程设计1. 导入(5分钟)为了引起学生对本节内容的兴趣,可以通过以下方式导入:(例子1)老师带一些物质样品,如铁粉、盐酸、水等,让学生观察这些物质,发现它们有什么不同,引导学生思考物质的分类方法。
(例子2)老师出示一些物质的图片或名称,让学生根据特点进行分类,如固体、液体、气体等,引导学生思考分类的依据。
2. 学习与讨论(30分钟)2.1 物质的分类方法及特点提醒学生注意教材P1的内容,解释物质的分类和元素、化合物的概念,重点讲解以下几种分类方法:(1)按物质的存在状态分类:固体、液体、气体;(2)按物质的组成分类:元素、化合物、混合物;(3)按物质的性质分类:金属、非金属、金属loids。
引导学生思考不同分类方法的特点及其适用场合,鼓励学生发表自己的观点,并进行讨论。
2.2 物质的转化规律与化学反应讲解物质的转化规律及其与化学反应的关系。
解释化学反应的定义及其表示方法,包括化学方程式、物质的组成与变化等。
引导学生通过实例理解物质转化规律与化学反应之间的关系,例如铁与盐酸的反应,让学生观察并描绘出方程式。
3. 练习与巩固(15分钟)出示一些练习题,让学生运用所学知识进行练习,如:1.将以下物质进行分类:水、氧气、铁、二氧化碳、盐、可可粉。
高中化学复习知识点(1)物质的组成、分类和转化【考纲导向】1.了解两种常见的分类方法——树状分类法和交叉分类法。
2.认识元素可以组成不同种类的物质,能根据物质的组成和性质对物质进行分类。
3.了解分散系的概念及其组成,能够区分不同的分散系。
4.认识胶体是一种常见的分散系,掌握Fe(OH)3胶体的制备方法,了解胶体的丁达尔效应及其应用。
5.熟悉单质、氧化物、酸、碱和盐等各类物质的性质及其反应类型。
6.掌握单质、氧化物、酸、碱和盐等各类物质间的相互转化的关系和规律。
【命题分析】化学物质种类繁多,化学变化更是千姿百态、千变万化。
物质的组成、性质和分类是历年高中的必考内容,属于热点问题,从命题内容上看,试题的难度不大。
预计2021年高中仍以考查学生对有关化学基本概念的识记、再现能力为主,题型主要以选择题为主,主要以物质组成、性质和分类的概念为出发点,以反映重大科技成果和人们普遍关注的社会问题为切入点,将有关物质组成、分类的概念、胶体知识融合于试题之中,基本概念与其他部分化学知识和能力的相互渗透和结合将会有所加强。
核心考点一物质的组成及分类1.元素与物质的关系(1)同素异形体:同种元素形成的不同单质。
如金刚石、石墨和C60互为同素异形体。
(2)酸性氧化物:能与碱反应只生成盐和水的氧化物,如CO2、SO2等。
(3)碱性氧化物:能与酸反应只生成盐和水的氧化物,如CaO、Fe2O3等。
(4)元素与物质的关系2.元素、物质与微粒间的关系3.物质的分类方法(1)交叉分类法:从不同的角度对物质进行分类。
例如:(2)树状分类法:对同类事物按照某种属性进行分类。
例如:考法1 物质的分类【典例1】(2021·新泰市第一中学北校月考)将物质进行分类,有助于理解和记忆。
下列物质的分类正确的是( )【解析】酸是水溶液中电离出的阳离子全部是氢离子的化合物,碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物,盐是金属阳离子(或铵根离子)和酸根阴离子构成的化合物,碱性氧化物是和酸反应生成盐和水的氧化物,酸性氧化物是和碱反应生成盐和水的氧化物。

高一化学物质的分类及转化化学是一门研究物质的科学,它主要关注物质的分类和转化。
在高中化学课程中,学生需要学习物质的分类及其转化的基本概念和原理。
以下是一个关于高一化学物质分类及转化的详细讲解。
第一部分:物质的分类1. 物质的基本分类1.1. 纯物质和混合物1.1.1. 纯物质:由同一种类型的物质组成,具有固定的化学组成和特定的性质。
可以分为元素和化合物。
1.1.2. 混合物:由两种或更多种不同的物质混合而成,可以分为均匀混合物和非均匀混合物。
1.2. 元素和化合物1.2.1. 元素:由同一种类型的原子组成,无法通过化学方法分解成其他物质。
1.2.2. 化合物:由两种或更多种不同元素的原子以确定的化学比例结合而成,可以通过化学方法分解成其他物质。
2. 物质的进一步分类2.1. 元素的分类2.1.1. 金属元素:具有良好的导电性、导热性和延展性,大部分为固体。
2.1.2. 非金属元素:导电性和导热性较差,大部分为气体或固体。
2.1.3. 过渡元素:位于周期表中B族元素的区域,具有特殊的化学性质。
2.2. 化合物的分类2.2.1. 无机化合物:主要由金属和非金属元素组成。
2.2.2. 有机化合物:主要由碳和氢元素组成,通常还包含其他非金属元素。
第二部分:物质的转化1. 物质的化学变化1.1. 化学反应的基本概念1.1.1. 反应物和生成物:反应物是参与反应的物质,生成物是反应后生成的物质。
1.1.2. 反应的化学方程式:用化学符号和化学式表示化学反应过程。
1.2. 化学反应的类型1.2.1. 合成反应:两个或更多物质结合成一个新物质。
1.2.2. 分解反应:一个物质分解成两个或更多的物质。
1.2.3. 置换反应:一个元素或离子取代另一个元素或离子。
1.2.4. 双替换反应:两个化合物中的离子交换位置。
2. 物质的物理变化2.1. 物质的相态变化2.1.1. 固态到液态:熔化2.1.2. 液态到气态:汽化2.1.3. 固态到气态:升华2.1.4. 气态到液态:凝结2.1.5. 液态到固态:凝固2.2. 物质的溶解和溶液2.2.1. 溶解:溶质分子或离子与溶剂分子之间相互作用,形成溶液。

《物质的分类及转化》教学设计方案(第一课时)一、教学目标1. 理解并掌握物质分类的基本观点和常见物质的分类方法。
2. 学会通过物质分类进行物质的互相转化干系分析。
3. 培养化学思维,提高分析问题和解决问题的能力。
二、教学重难点1. 教学重点:理解物质的分类方法,学会分析物质的互相转化干系。
2. 教学难点:复杂物质的分类和转化干系分析,需要结合化学反应进行理解。
三、教学准备1. 准备教学PPT,包含各种物质的图片和示例。
2. 准备常见物质的化学式和常见反应的实验器械。
3. 准备一些复杂物质的分类和转化干系的案例,供学生分析和讨论。
4. 准备一些习题,用于学生练习和检验学习效果。
四、教学过程:本节课是《物质的分类及转化》的第一课时,以下是具体的教学过程设计:1. 导入新课:起首通过一些常见物质的分类和转化实例,引导学生思考物质的分类和转化在生活和生产中的应用,激发学生的兴趣和求知欲。
2. 展示学习目标:明确本节课的学习目标,让学生知道本节课需要掌握的内容和需要达到的目标。
3. 组织学生分组讨论:将学生分成若干小组,每组分配不同的任务,如钻研不同类型物质的性质、分类方法和转化干系等。
通过讨论和交流,培养学生的合作认识和团队精神。
4. 展示学习资料:提供学习资料,包括物质的分类、转化干系和实验操作等,让学生自主探究和学习。
5. 组织教室交流:学生分组讨论结束后,组织各组代表在教室上进行交流,分享学习效果和怀疑,互相学习和启发。
6. 教师总结:教师对本节课的知识点进行总结,强调重点和难点,帮助学生加深印象和理解。
7. 安置作业:安置与本节课内容相关的作业,包括练习题、实验报告等,稳固所学知识。
在教学过程中,注重学生的主体地位,通过分组讨论、自主探究、教室交流等多种方式,激发学生的学习兴趣和主动性,培养学生的合作认识和团队精神。
同时,教师也注重引导和启发,帮助学生加深理解和掌握所学知识。
教学设计方案(第二课时)一、教学目标1. 知识与技能:学生能够理解物质分类方法的原理,掌握常见物质分类的标准和转化方式。

新教材)高中化学人教版(2019)必修第1册知识点总结第一章物质及其变化第一节物质的分类及其转化一、物质的分类一)分类方法1.同素异形体:由同一种元素形成的几种单质,其物理性质不同。
例如,碳的同素异形体有金刚石、石墨、C60等。
需要注意的是,同素异形体之间的化学性质相同,但物理性质不同,它们之间的转化属于化学变化。
2.分类法:交叉分类法和树状分类法。
3.酸性氧化物:能与碱反应生成盐和水的氧化物,大多数非金属氧化物属于酸性氧化物。
需要注意的是,酸性氧化物不一定是金属氧化物,而非金属氧化物也不一定是酸性氧化物,如不成盐氧化物。
4.碱性氧化物:能与酸反应生成盐和水的氧化物,大多数金属氧化物属于碱性氧化物。
需要注意的是,碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
二)分散系及其分类1.分散系:一种(或多种)物质分散到另一种(或多种)物质中所形成的混合物。
2.分散系的组成:分散质和分散剂。
3.分散系的分类:根据分散质粒子直径的大小,可分为溶液、胶体和浊液。
4.胶体的分类:根据分散剂的不同,可分为气溶胶、液溶胶和固溶胶。
5.胶体的制备:例如氢氧化铁胶体的制备,需要在沸水中滴入5-6滴FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,即可得到Fe(OH)3胶体。
6.胶体的性质:1)丁达尔效应:用于区分胶体和溶液。
2)电泳。
3)聚沉:加电解质溶液或者加热都会使胶体聚沉。
7.常见的胶体。
8.溶液、胶体和浊液的比较:分散系。
分散质粒子种类。
分散质粒子直径。
外部特征。
能否透过滤纸。
能否透过半透膜溶液。
分子、离子。
小于1nm。
均一、稳定、透明。
能。
能胶体浊液。
大量分子聚集体或大分子大量分子聚集体。
1-100nm。
较均一、较稳定。
能。
不能浊液。
大于100nm。
不均一、不稳定。
不能。
不能二、物质的转化1.酸的通性酸具有相似的化学性质,原因在于不同的酸溶液中都含有H+。
酸可以通过以下反应转化:活泼金属―→盐+氢气(置换反应)碱性氧化物―→盐+水(复分解反应)盐―→新酸+新盐酸可以用酸碱指示剂来检测,例如紫色石蕊溶液变红色。

物质的分类和转化根据物质的组成和性质对物质进行分类1. 人们常根据物质的组成、状态和性质对物质进行分类。
例如,根据物质存在的状态,将物质分为__________________________________;根据物质的导电性将物质分为__________________________________;根据物质在水中的溶解性将物质分为__________________________________________。
2. 化合物通常分为________________________________________;根据在水溶液或熔化状态下能否导电分为__________________________,根据粒子间成键类型分为______________________________________。
3. 氧化物按元素组成分为____________________________;按性质分_____________。
①纯净物:由组成(只有种分子)的物质。
②混合物:由组成(分子有多种)的物质。
③单质:由组成的纯净物。
④化合物:由组成的纯净物。
⑤氧化物:由种元素组成,其中有一种元素是元素的化合物。
⑥酸:物质电离出的的化合物。
⑦碱:物质电离出的的化合物。
⑧盐:的化合物。
【例1】下列物质中属于有机物的是( )A. 氯化钾B. 二氧化碳C. 碳酸钠D. 乙烷【例2】 Na 2CO 3俗名纯碱,下列对其采用不同分类法的分类,不正确的是( )A. Na 2CO 3是碱B. Na 2CO 3是盐C. Na 2CO 3是钠盐D. Na 2CO 3是碳酸盐【例3】 下列物质分类的正确组合是( )【例4】 ① Na ;②空气;③ 干冰;④ 硫酸;⑤ 碳酸钙;⑥ 氧化钙;⑦ NaOH ;⑧ FeCl 3溶液;⑨ 醋酸;⑩ 乙醇。
对以上物质按组成分类:(1) 混合物____________(填序号,下同);(2) 单质____________;(3) 氧化物____________;(4) 酸____________;(5) 碱____________;(6) 盐____________;(7) 有机物____________。
2.常见物质及其变化的分类方法① 化学反应可分为__________、__________、__________和__________四种基本类型。
② 根据有无离子参加可以把化学反应分为__________和__________两种反应类型。
③ 根据有无电子转移可以把化学反应分为__________和__________两种反应类型。
④ 氧化还原反应和四大基本反应类型的关系请将“化合反应”“置换反应” “分解反应”“复分解反应”与“氧化还原反应”分别填入下图中的圆内或椭圆内。
【例5】 单晶硅是制作电子集成电路的基础材料。
科学家曾预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。
用化学方法可制得高纯度硅,其化学方程式为:① SiO 2+2C=====高温Si +2CO ;② Si +2Cl 2=====点燃碱 酸 盐 酸性氧化物A纯碱 盐酸 烧碱 二氧化硫 B 烧碱 硫酸 食盐 一氧化碳 C 苛性钠 醋酸 石灰石 水 D 苛性钾 碳酸 苏打 三氧化硫SiCl 4;③ SiCl 4+2H 2=====△Si +4HCl 。
其中,反应①和③属于( )A. 化合反应B. 分解反应C. 置换反应D. 复分解反应3.溶液、胶体和浊液及胶体鉴别方法① 混合物根据粒子直径大小分为_______________________________;② 胶体鉴别方法是___________________________________________;③ 胶体与溶液的本质区别是___________________________________。
【例6】 用特殊方法把固体物质加工到纳米级(1~100 nm ,1 nm =10-9 m)的超细粉末粒子,然后制得纳米材料。
下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )A. 溶液B. 悬浊液C. 胶体D. 乳浊液【例7】 下列分散系能产生丁达尔效应的是( )A .硫酸铜溶液 B. 稀硫酸 C. 溴水 D. 氢氧化铁胶体【知识总结】1.单质是由一种元素组成的纯净物;氧化物是由两种元素组成,其中一种元素是氧元素的化合物;混合物是由两种或两种以上的物质组成的物质。
2.化合反应:A + B == AB ;分解反应:AB == A + B ;置换反应:A +BC == B + AC ;复分解反应:AB + CD == AD + CB ;氧化还原反应的本质是电子的得失,特征是有化合价升降变化。
3.溶液、胶体、浊液均属于混合物,本质区别是分散质粒子直径大小不同。
【小练习】1. 2008年北京奥运会火炬使用了丙烷作燃料。
丙烷属于( )A. 无机物B. 有机物C. 氧化物D. 混合物2. “垃圾是放错了位置的资源”,应分类回收利用。
生活中废弃的塑料制品、旧轮胎、废纸等属于( )A. 单质 B .有机物 C. 氧化物 D. 无机物3. 二氧化硫是引起酸雨的一种物质。
二氧化硫属于( )A. 酸B. 酸性氧化物C. 碱D. 混合物4. 体操运动员比赛时为了防滑常在手掌上涂抹碳酸镁。
碳酸镁属于( )A. 酸B. 碱C. 盐D. 氧化物5.用生石灰中和法阻止海水酸化是人们的一种设想。
生石灰(CaO)属于( )A. 酸B. 碱C. 盐D. 氧化物6. 下列物质中属于天然有机高分子化合物的是( )A. 纤维素B. 聚乙烯C. 油脂D. 麦芽糖7. 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。
下列关于“CH3COONa”的分类不正确的是( )A. 化合物B. 氧化物C. 有机物D. 钠盐8. 下列过程发生化学变化的是( )A. 花香四溢B. 海水晒盐C. 粮食酿酒D. 冰雪消融9. 有以下六个反应(反应条件略):A. 2Na+2H2O ===2NaOH+H2↑B. CH4+2O2===CO2+2H2OC. KClO3===2KCl+3O2↑D. CaCO3+2HCl===CaCl2+H2O+CO2↑E. Na2O+CO2===Na2CO3F. CO2+C===2CO其中属于化合反应的有________(填字母,下同),属于分解反应的有________,属于复分解反应的有________,属于置换反应的有________,属于氧化还原反应的有________。
10. 当光束通过豆浆时,可观察到丁达尔效应,表明豆浆是( )A. 胶体B. 溶液C. 悬浊液D. 乳浊液11. 当光束通过鸡蛋清水溶液时,从侧面观察到一条光亮的“通路”,说明鸡蛋清水溶液是( )A. 溶液B. 胶体C. 悬浊液D. 乳浊液12. 下列关于胶体的叙述不正确的是 ( )A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7 m之间B. 光线透过胶体时,胶体中可发生丁达尔效应C. 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同D. Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水的目的13. 某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是( )A. ①②③④B. ①②⑤⑥C. ③⑤⑥⑦D. ①③④⑦14. 在① MgO、CuO、CaO、SO2;② C、Fe、S、P;③ ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质其分类与组内其他物质不同,这三种物质分别是( )A. CuO、Fe、 ZnCl2B. SO2、Fe、HNO3C. CaO、C、HNO3D. SO2、S、NaNO315. 石灰在工农业生产和建筑业上有着重要用途。
用于生产石灰的主要原料是石灰石(其主要成分为A),在石灰窑中加热焙烧石灰石得到生石灰(B),并放出气体(C)。
生石灰在建筑业上主要用做黏合剂,一般先使它“熟化”变成熟石灰(D),熟石灰与沙子混合成“沙灰”用于砌筑砖墙。
经过一段时间后,“沙灰”中的熟石灰又变成固体物质(A)。
(1) 上述A、B、D三种物质,所属类别依次是________(填字母)。
A. 酸、碱、盐B. 碱、盐、氧化物C. 盐、氧化物、氧化物D. 盐、氧化物、碱(2) 写出下列反应的化学方程式:A→B+C:________________________________________;D→A:___________________________________________。
(3) 新抹上“沙灰”的墙易“出汗”(即有“水滴”附着在墙上),请用你学过的化学知识解释这一现象。