东华理工大学地球化学复习题
- 格式:docx
- 大小:80.03 KB
- 文档页数:12

地球化学考试复习资料第一部分课后习题及答案绪论1. 简要说明地球化学研究的基本问题。
1)地球系统中元素及同位素的组成问题;2)地球系统中元素的组合和元素的赋存形式;3)地球系统各类自然过程中元素的行为(地球的化学作用)、迁移规律和机理;4)地球的化学演化,即地球历史中元素及同位素的演化历史。
2. 简述地球化学学科的研究思路和研究方法。
1)自然过程在形成宏观地质体的同时也留下了微观踪迹,其中包括了许多地球化学信息;2)自然界物质的运动和存在状态是环境和体系介质条件的函数;3)地球化学问题必须至于地球或其其子系统中进行分析,以系统的组成和状态来约束作用的特征和元素的行为。
地球化学研究方法:反序法和类比法第一章太阳系和地球系统的元素丰度1.简述太阳系元素丰度的基本特征.1)原子序数较低的范围内,元素丰度随原子序数增大呈指数递减,而在原子序数较大的范围内(Z>45)各元素丰度值很相近。
2)原子序数为偶数的元素其丰度大大高于相邻原子序数为奇数的元素。
具有偶数质子数(A)或偶数中子数(N)的核素丰度总是高于具有奇数A 或N的核素。
3)质量数为4的倍数的核类或同位素具有较高的丰度,原子序数或中子数为“约数”(2、8、20、50、83、126等)的核类或同位素分布最广、丰度最大。
4)锂、铍、硼元素丰度严重偏低,属于强亏损的元素。
5)氧和铁元素丰度显著偏高,它们是过剩元素。
6)含量最高的元素为H、He,这两种元素的原子几乎占了太阳中全部原子数目的98%。
2.简介地壳元素丰度特征.1)地壳元素丰度差异大:丰度值最大的元素(O)是最小元素(Rn)的1017倍;丰度值最大的三种元素之和达82.58%;丰度值最大的九种元素之和达98.13%;2)地壳元素丰度的分布规律与太阳系基本相同。
与太阳系或宇宙相比,地壳和地球都明显地贫H, He, Ne, N等气体元素;而地壳与整个地球相比,则明显贫Fe和Mg,同时富集Al, K 和Na。

专业课原理概述部分一、选择题(每题1分,共5分)1. 地球化学主要研究的是()A. 地球表层化学元素分布B. 地球内部化学元素分布C. 地球与宇宙间的化学元素分布D. 地球上所有生物的化学元素分布2. 下列哪个元素在地壳中的含量最高?()A. 氧B. 硅C. 铝D. 铁3. 下列哪个不是地球化学的研究方法?()A. 岩石地球化学B. 水地球化学C. 气体地球化学D. 生物地球化学分析4. 地球化学在下列哪个领域应用最广泛?()A. 矿产资源勘探B. 环境保护C. 农业生产D. 医学领域5. 下列哪个不是地球化学的研究内容?()A. 地球表层元素的迁移与循环B. 地球内部元素的富集与分布C. 地球历史演变过程D. 宇宙中其他星球的化学成分二、判断题(每题1分,共5分)1. 地球化学是介于化学和地质学之间的一门边缘科学。
()2. 地球化学主要研究地球表层及内部化学元素的分布、迁移、富集和循环。
()3. 地球化学家通过研究地球的化学成分,可以了解地球的形成和演化过程。
()4. 地球化学在环境保护领域没有应用价值。
()5. 地球化学家可以通过分析岩石中的化学元素,推断出岩石的形成时代。
()三、填空题(每题1分,共5分)1. 地球化学的研究对象主要包括地球的__、__、__和__。
2. 地球化学的研究方法有__、__、__和__。
3. 地球化学在__、__、__等领域具有广泛的应用。
4. 地壳中含量最多的元素是__,是__。
5. 地球化学家通过对__的研究,可以了解地球的形成和演化过程。
四、简答题(每题2分,共10分)1. 简述地球化学的研究内容。
2. 地球化学在矿产资源勘探中有哪些应用?3. 地球化学在环境保护方面有何作用?4. 请举例说明地球化学在农业生产中的应用。
5. 地球化学与地质学、化学的关系是什么?五、应用题(每题2分,共10分)1. 某地发现一种含铜矿床,请设计一个地球化学勘探方案,以确定矿床的品位和规模。

2006-2007第一学期《水文地球化学》期末试卷(B)-参考答案班级()学号()姓名()一、名词解释(每题3分,共21分)1、盐效应:矿物在纯水中的溶解度低于矿物在高含盐量水中的溶解度,这种含盐量升高而使矿物溶解度增大的现象。
2、阳离子交替吸附作用:在一定条件下,岩石颗粒吸附地下水中的某些阳离子,而将其原来吸附的某些阳离子转入水中,从而改变了地下水的化学成分,这一作用即为阳离子交替吸附作用。
3、氧化垒:在还原条件被氧化条件激烈交替的地段上所形成的地球化学垒。
4、侵蚀性CO2:当水中游离CO2大于平衡CO2时,水中剩余部分的CO2对碳酸盐和金属构件等具有侵蚀性,这部分即为侵蚀性CO2。
5、TDS:指水中溶解组分的总量,它包括溶于水中的离子、分子及络合物,但不包括悬浮物和溶解的气体。
6、硅质水与硅酸水:SiO2含量大于50mg/L的水称为硅质水(1.5分);在阴离子中,HSiO3-占阴离子首位(按mol%计算)的水称为硅酸水(1.5分)。
7、硬度:是以水中Ca2+和Mg2+来量度,其计算方法是以Ca2+和Mg2+的毫克当量总数乘以50,以CaCO3表示,其单位为mg/L。
二、填空(每题1分,共14分)1、Fe2+在(酸)性中迁移强,而在(碱)性中迁移弱。
2、地球化学垒按成因可分为(机械)垒、(物理化学)垒、(生物)垒和(复合)垒。
3、碱度主要决定于水中的(HCO-3,CO2-3)的含量。
硬度是以(Ca2+,Mg2+)的毫克当量总数乘以50,而暂时硬度是以(HCO-3,CO2-3)的毫克当量总数乘以50。
4.大气CO2的δ13C平均值是(-7‰),而土壤CO2的δ13C平均值是( -25‰)。
5.标型元素的标型程度取决于(元素的克拉克值)和(它的迁移能力)。
6.弥散作用包括(分子扩散),(对流扩散迁移)和(渗透分散)。
7、SiO2和Na/K地热温度计适用的温度范围分别为(0~250℃)和(150~350℃)。

一、名词解释1.冲积物的二元结构2.风化作用3.侵蚀基准面4.海啸5.平行不整合6.差异风化7.冲积扇8.向源侵蚀9.大陆架10.牛轭湖11.风化壳12.河流袭夺13.角度不整合14. 张节理15. 阶地16.向斜17.背斜18.化学风化作用19.基座阶地二、问答题1.河流的侧蚀作用及其演化趋势。
2.河流地质作用的一般趋势。
3.举例说明化学风化作用的主要方式4.试述河谷、冰蚀谷的主要区别5.试述影响风化作用的因素6.试述河流的侧蚀作用的过程。
7.试述地层间的接触关系及其反映的构造运动过程。
8.试述河流的下蚀作用的过程。
9.试述板块边界类型10.河流沉积物与冰碛物的区别11.论述河流侧蚀作用形成牛轭湖的过程12. 河流阶地的形成过程和分类三、填空题1. 被动型大陆边缘通常由,,三部分组成。
2. 化学风化作用的方式主要有,,等。
3.从底到顶,三角洲沉积物由,和等三层组成。
4. 内力地质作用的主要类型有,,。
5. 外力地质作用的主要类型有,,,,。
6. . 物理风化作用类型有__ __ __;化学风化作用类型有__ __ __。
7.倾斜岩层的产状要素:()、()、()。
8.组成断层的基本要素有:()、()、()。
9.变质作用的基本类型为:()、()、()和()。
10.河流侵蚀作用按作用方式分为()、()。
11.河流阶地的类型主要有()、()和()。
12.风化壳由下而上由()、()和()组成。
13.河流在垂直方向上对流经谷底部的冲刷作用,称为()。
而河流在水平方向冲蚀河岸的作用称为()。
14.河流可形成“V”形谷,而冰川可形成()形谷。
15.节理按力学性质分为两类:即()、()。
16.成岩作用主要方式有:()、()、()、()。
四、单项选择1.下列有关“节理”的论述哪个正确:A、矿物受力以后发生的破裂称为节理B、方解石具有完全节理C、岩石受力以后发生的破裂称为节理D、某些玄武岩具有柱状节理2.断层的主要类型包括:A、正断层、反断层、平移断层B、正断层、逆断层、平移断层C、正断层、逆断层、斜断层D、正断层、逆断层、转换断层3.下列不属于物理风化的是A 温差风化B 水解作用C 根劈作用D 盐类结晶与潮解作用4.河流地质作用形成的沉积物称为。

地球化学复习资料第1章绪论一、地球化学的定义地球化学是研究地球及子系统(含部分宇宙体)的化学组成、化学作用和化学演化的科学(涂光炽)。
地球化学是研究地球的化学成分及元素在其中分布、分配、集中、分散、共生组合与迁移规律、演化历史的科学。
二、地球化学研究的基本问题第一:元素(同位素)在地球及各子系统中的组成(量)第二:元素的共生组合和存在形式(质)第三:研究元素的迁移(动)第四:研究元素(同位素)的行为第五:元素的地球化学演化第2章自然体系中元素的共生结合规律一、元素地球化学亲和性的定义在自然体系中元素形成阳离子的能力和所显示出的有选择地与某种阴离子结合的特性称为元素的地球化学亲和性。
二、亲氧元素、亲硫元素与亲铁元素的特点地球的组分分异,由元素的性质决定。
元素在周期表中的位置:亲铁元素: 地核亲石元素: 地幔与地壳亲气元素: 大气圈和水圈三、其它的概念离子电位(π):是离子电价(W)与离子半径(R)的比值,即π=W/R电离能:指从原子电子层中移去电子所需要的能量。
电离能愈大,则电子与原子核之间结合得愈牢固。
电子亲和能:原子得到电子所放出的能量(E)叫电子亲和能。
E越大,表示越容易得到电子成为负离子。
电负性:中性原子得失电子的难易程度。
或者说原子在分子中吸引价电子的能力叫电负性。
表示为:X=I+E (X:电负性;I:电离能;E:电子亲和能)周期表上,以Li的电负性为1.0,得出其它元素相对电负性。
化学键:离子键(电子交换),共价键(电子共用),金属键(价电子自由移动),范德华键(分子间或惰性原子间,存在弱的偶极或瞬时偶极),氢键(也属分子间静电力,含H的分子与其它极性分子或负离子间)四、元素的地球化学化学分类(戈式分类)亲氧(亲石)、亲硫(亲铜)、亲铁、亲气根据地球中阴离子中氧丰度最高,其次是硫(主要形成氧的化合物和硫化物);而能以自然金属形式存在的丰度最高的元素是铁,因此,元素的地球化学亲和性主要分为以下三类:①亲氧性(亲石)元素;②亲硫性(亲铜)元素;③亲铁元素。

地球化学复习题一.概念题1.克拉克值答:元素在地壳中的丰度。
2.类质同像答:某些物质在一定的外界条件下结晶时,晶体中的部分构造位置随机地被介质中的其他质点(原子、离子、配离子、分子)所占据,结果只引起晶格常数的微小改变,晶体的构造类型、化学键类型等保持不变,这一现象称为“类质同象”3.背景与异常答:地球化学背景:在无矿化或未受矿化影响的地区,区内的地质体和天然物质没有特殊的地球化学特点,且元素含量正常。
正常含量也叫背景含量(值)。
元素呈正常含量的地区称背景区。
地球化学异常:是指与地球化学背景区有明显差异的元素含量富集区或贫化区。
4.同位素分馏答:轻稳定同位素(Z<20)的相对质量差较大(>10%),在自然作用中由于这种质量差所引起的同位素相对丰度的变异,称为同位素分馏。
5.亲氧性答:是指化学元素中一些金属元素与氧以离子键性结合形成化合物,表现出对氧的亲和性。
6.亲硫性答:是指化学元素中一些金属元素与硫结合形成高度共价键性质的化合物,表现出对硫的亲和性。
7.载体矿物答:指岩石中所研究元素的主要量分配于其中的那种矿物。
但有时该元素在载体矿物中的含量并不很高,往往接近该元素在岩石总体中的含量。
8.富集矿物答:是指所研究元素在其中的含量大大超过它在岩石总体中的含量的那种矿物。
9.丰度答:元素在宇宙体或较大的地球化学系统中的平均含量。
10.指示元素答:所谓指示元素,就是可以指示矿体的存在及其特征的化学元素。
换句话说,这些元素能在矿床或矿体周围形成清晰并具一定规模的原生异常,其含量变化在不同程度上能反殃矿体或矿化的存在,能很好地提供找矿线索。
11.核数答:核素是由一定数量的质子(P)和中子(N)构成的原子核。
核素具有质量、电荷、能量、放射性、丰度五种主要性质。
12.同位素答:同一元素的不同核素在周期表上占据相同的位置,这也就是同位素13.元素地球化学迁移答:当环境发生物理化学条件变化,使元素原来的存在形式变得不稳定时,为了与环境达到新的平衡,元素原来的存在形式自动解体,而结合成一种新的相对稳定的方式存在。
一、概念题(每题5分,共50分) 1、元素的丰度值 2、类质同象混入物 3、载体矿物和富集矿物 4、地球化学障 5、八面体择位能 6、戈尔德斯密特相律 7、相容元素和不相容元素 8、δCe值(列出计算公式并说明) 9、同位素分馏系数 10、衰变定律二、问答题(每题8分,共40分):1、当以下每种物质形成时,其氧化电位是高还是低?(1) 陨石;(2)煤;(3)海底锰结核;(4)钒钾铀矿;(5)页岩中的黄铁矿;(6)鲕绿泥石。
2、为什么硅酸盐矿物中K的配位数经常比Na的配位数大? (离子半径:K+的为1.38A,Na+的为1.02A,O2-的1.40A)。
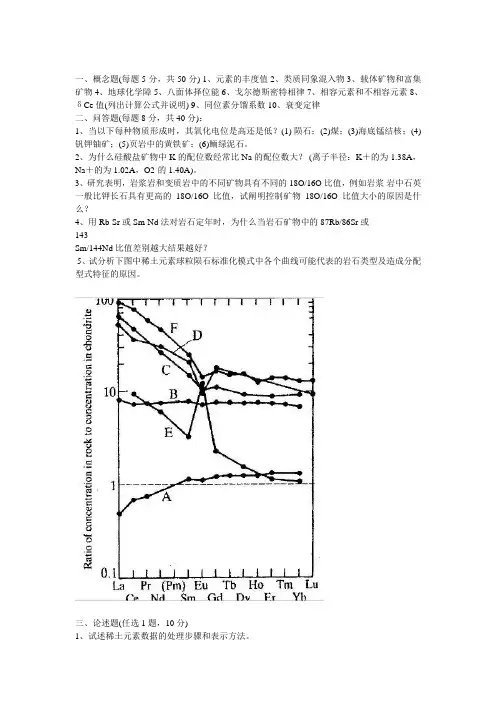
3、研究表明,岩浆岩和变质岩中的不同矿物具有不同的18O/16O比值,例如岩浆岩中石英一般比钾长石具有更高的18O/16O比值,试阐明控制矿物18O/16O比值大小的原因是什么?4、用Rb-Sr或Sm-Nd法对岩石定年时,为什么当岩石矿物中的87Rb/86Sr或143Sm/144Nd比值差别越大结果越好?5、试分析下图中稀土元素球粒陨石标准化模式中各个曲线可能代表的岩石类型及造成分配型式特征的原因。
三、论述题(任选1题,10分)1、试述稀土元素数据的处理步骤和表示方法。
2、要获得准确的同位素地质年龄必须满足的条件是什么?答案:一、1.每种化学元素在自然体中的质量,占自然体总质量(或自然体全部化学元素总质量)的相对份额(如百分数),称为该元素在该自然体中的丰度值.2. 某种物质在一定的外界条件下结晶时,晶体中的部分构造位置被介质的其它质点(原子、离子、络离子、分子)所占据,结果只引起晶格常数的微小变化,而使晶体构造类型、化学键类型等保持不变的现象。
由类质同像形式混入晶体中的物质称为类质同像混入物。
含有类质同像混入物的混合晶体称为固溶体。
3. 载体矿物是指岩石中所研究元素的主要量分配于其中的那种矿物。
但有时该元素在载体矿物中的含量并不很高,往往接近该元素在有时总体中的含量。

地球化学复习题地球化学复习题绪论1、地球化学的定义。
答:地球化学是研究地球(包括部分天体)的化学组成、化学作用和化学演化的科学。
2、地球化学的任务。
答:1)地球及其子系统中元素及其同位素的组成,即元素的分布和分配问题;2)元素的共生组合和赋存形式;3)元素的迁移和循环;4)地球的历史和演化。
5)基础理论和应用的发展。
3、地球化学的研究思路和工作方法。
答:研究思路:以化学、物理化学等基本原理为基础,以研究原子(包括元素和同位素)的行为为手段,来认识地球的组成、历史和地球化学作用。
工作方法:野外:地质考察+样品采集(代表性、系统性、统计性、严格性)。
室内:--岩矿鉴定--分析测试:早期容量法、离子色谱法和比色法,现今X射线荧光光谱XRF、ICPAES、--ICPMS、固体质谱、AAS等。
--元素结合形式和赋存状态的研究:化学分析、晶体光学、X射线衍射、拉曼谱、微区分析(电子探针、离子探针)等。
--作用过程的物理化学条件的测定:温度(包裹体、矿物、同位素)、压力、pH、Eh、盐度等。
--自然作用的时间参数:同位素测年。
--模拟实验。
--多元统计计算和数学模型。
4、地球化学学科的特点。
答:1、基础科学成果的应用.2、地质科学的发展.3、更广泛的数字模拟。
第一章太阳系和地球系统的元素丰度1、对比元素在地壳、地球和太阳系中分布规律的异同点,并解释其原因。
答:相同点:元素的丰度均随原子系数增大而减小。
均符合奇偶定律。
不同点:与太阳系或宇宙相比,地壳和地球都明显地贫H, He, Ne, N等气体元素;而地壳与整个地球相比,则明显贫Fe和Mg,同时富集Al, K和N a。
原因:2、研究克拉克值有何地球化学意义。
答:可作为元素集中、分散的标尺。
控制元素的地球化学行为。
A)影响元素参加地壳中地球化学过程的浓度。
B)限定自然界的矿物种类及种属。
C) 限制了自然体系的状态。
3、地球各圈层化学组成的基本特征。
答:地壳:①地壳中元素的相对平均含量是极不均一的。

地球化学复习题一、名词解释1、地球化学:是研究地球及有关宇宙的化学组成、化学作用和化学演化的科学2、地球化学体系:按照地球化学的观点;通常将要研究的对象作为一个体系3、元素克拉克值:元素在地壳中的丰度4、元素丰度:元素在宇宙或较大的地球体系中的平均含量..5、相容元素:岩浆结晶或固相部分熔融过程中偏爱矿物相的微量元素6、不相容元素:岩浆结晶或固相部分熔融过程中偏爱熔体或溶液相的微量元素..也称为亲岩浆元素7、元素的地球化学亲和性:元素形成阳离子能力和显示出的有选择性与某阴离子结合的特性;8、类质同象:某种物质在一定的外界条件下结晶时;晶体中的部分构造位置被介质中的其它质点原子、离子、络离子、分子所占据;结果只引起晶格常数的微小变化;而使晶体构造类型、化学键类型等保持不变保持稳定的现象..9、元素的赋存形式:元素在一定的自然过程或其演化的历史中的某个阶段所处的状态及与共生元素间的结合关系..10、干酪根:不能被有机溶剂萃取的不溶有机物..其含量占沉积岩中有机质的绝大部分约90%以上..11、生物标志化合物:又称分子化石、地球化学化石或指纹化石..指沉积物中的有机质以及原油、油页岩、煤中那些直接或间接来源于活的生物体的有机化合物..12、石油:是以液态形式存在于地下的碳氢化合物的混合物..13、天然气:广义:一切经自然过程生成的气体..狭义:指在沉积有机质演化过程中生成的可燃气体..14、煤:沉积作用期间及期后;由植物残体经过一系列的物理、化学和生物学变化而形成的;其中木质素、纤维素是成煤的主要组分..15、环境背景值:亦称环境本底值;是在未受或基本未受人为污染或者自然污染的情况下;岩石、土壤、水体、植物等环境要素中化学元素的平均含量..16、元素的存在状态:指元素的物理、化学相态和能量状态、价态、化合态和结构态等方面..元素的存在状态不同;其迁移行为和生物毒性不同..17、生物地球化学循环:是指生物圈中元素及其化合物从环境→生物→环境的迁移、转化过程..18、环境污染修复:指利用物理、化学、生物方法对土壤及水体中的重金属、有机污染进行治理;将有毒污染物转化为无毒物质;或减弱其毒性;从而减少污染物对生态系统和人体健康的负面影响..19、地方病:指在一定区域内流行的疾病;是指由于环境中某种或某些元素的不足或过量引起的生理失调..21、高场强元素和低场强元素;并各自举例出三种以上元素高场强元素highfieldstrengthelements-HFSE:离子半径小的高电荷阳离子离子电位>3.0..Zr;Hf;Nb;Ta;Th;U;Ti;REE..低场强元素lowfieldstrengthelements-LHSE:离子半径大的低电荷阳离子离子电位<3.0..又称大离子亲石元素largeionlithophileelements-LILE..K;Rb;Cs;Sr;Ba..22、能斯特分配定律:在给定溶质、溶剂及温度和压力下;微量元素i在两相间的浓度比值为常数KD;它与温度和压力有关;与i的浓度无关在一定浓度范围内..23、同位素isotope—是具有相同质子数和不同中子数的一组核素..24、放射性同位素和放射性成因同位素:放射性同位素;原子核是不稳定的;它们以一定方式自发地衰变成其它核素的同位素又称为放射性母体同位素;放射性成因同位素;通过放射性衰变形成的同位素又称为放射性子体同位素25、CHUR:指用球粒陨石的Sm/Nd和143Nd/144Nd比值代表未经化学分异的原始地幔的初始比值;二、简答题1、简述地球化学研究涉及的四个基本问题地球系统中元素及同位素的组成问题..元素的共生组合及赋存问题..元素的迁移和循环地球的历史和演化2、地球化学体系的特点有哪些有一定的空间;都处于特定的物理化学状态C、T、P等;并且有一定的时间连续..3、获取宇宙元素丰度的途径包括哪些1.光谱分析:对太阳和其它星体的辐射光谱进行定性和定量分析;2.直接分析:如测定地壳岩石、各类陨石和月岩、火星的样品.3.利用宇宙飞行器分析测定星云和星际间物质及研究宇宙射线..4、陨石主要包括哪几种类型陨石主要是由镍-铁合金、结晶硅酸盐或两者的混合物所组成;按成份分为三类:1铁陨石siderite主要由金属Ni;Fe占98%和少量其他元素组成Co;S;P;Cu;Cr;C等.. 2石陨石aerolite主要由硅酸盐矿物组成橄榄石、辉石..这类陨石可以分为两类;即决定它们是否含有球粒硅酸盐结构;分为球粒陨石和无球粒陨石..3铁石陨石sidrolite由数量上大体相等的Fe-Ni和硅酸盐矿物组成;是上述两类陨石的过渡类型..5、陨石研究对地球形成和组成演化的意义①它们来自某种曾经分异成一个富金属核和一个硅酸盐包裹层的行星体;这种天体的破裂就导致各类陨石的形成;②石陨石与地球上的基性、超基性岩矿物组成和化学成分相似;铁陨石与地核的化学成分相似;陨石的母体在组成上、结构上与地球极为相似;③各种陨石分别形成于不同的行星母体;因为各类陨石具有不同的年龄及成分差异;④陨石的年龄与地球的年龄相近陨石利用铅同位素求得的年龄是45.5±0.7亿年;⑤陨石等地外物体撞击地球;将突然改变地表的生态环境诱发大量的生物灭绝;构成了地球演化史中频繁而影响深远的突变事件;为此对探讨生态环境变化、古生物演化和地层划分均具有重要意义..6、简述太阳系元素丰度的基本规律1H和He含量最高;2原子序数低;丰度值指数递减;原子序数高;丰度值相近;3奥多-哈根斯法则;亦即奇偶规律;4Li、Be和B具有很低的丰度;属于强亏损的元素;而O和Fe呈现明显的峰;它们是过剩元素..7、简述地球元素丰度的研究方法陨石类比法地球模型和陨石类比法地球物理类比法8、地球和地球范围内的自然体系和自然过程特点1)温度、压力等条件的变化幅度与人为制备的条件相比有限2)是多组分的复杂体系3体系是开放的自然过程具多变度单向发展演化特征..体系与环境之间存在充分物质和能量交换;因外来成分加入或内部组分排出不断改变系统内作用性质和条件4自发进行的不可逆过程..反应进行的方向、速率、限度受能量效应制约;9、自然界元素结合的基本规律1元素的地球化学亲和性2矿物晶体形成或变化过程的类质同相规律3晶体场理论对过渡族元素行为的控制10、简述元素的地球化学亲和性分类按照亲和性划分为四个相:亲氧Lithophile;oxyphile、亲硫chalcophile;sulfophile、亲铁siderophile、亲卤;11、类质同象置换的条件主要有哪些类质同象置换的条件主要有:①离子或原子自身的性质;如半径相近、电价平衡、配位多面体的对称性相同和化学键的一致等;②体系的物理化学条件;如温度、压力、组分特征和氧化还原条件等有利于置换的进行;③固溶体的热力学性质..12、简述戈尔德斯密特类质同象法则1小离子优先法则:两种离子电价相同;半径相似;小半径离子优先进入矿物晶格;集中于早结晶矿物中;大半径离子集中于晚结晶矿物中..2高价离子捕获;低价离子容许法则:两种离子半径相似电价不同;高价离子优先进入早结晶矿物;3隐蔽容留法则:两种离子有相似半径和相同电价;丰度高主量元素形成独立矿物;丰度低微量元素按丰度比例进入主量元素矿物晶格;称为“隐蔽”或“容留”camouflage..13、元素赋存形式的研究方法元素含量测定法显微镜法萃取法晶格常数确定电子显微镜扫描14、简述干酪根的形成方式15、简述生物标志化合物的主要类型1.正构烷烃:又称饱和直链烷烃;属于甲烷系的碳氢化合物;通式为CnH2n+2..2.无环的类异戊二烯烷烃:是一类具有规则甲基支链的饱和烃;属无环的萜类3.萜类化合物:是指环状的类异戊二烯型化合物;可以看成是由含5个碳原子的异戊二烯通式为C5H8以首尾相连而成..4.甾类化合物:是具有四个环三个六元环和一个五元环的化合物..5.卟啉化合物:基本结构是由甲川桥连接的四个吡咯环组成的;最基本的化合物是卟吩16、煤的显微组分主要包括哪三类壳质组或稳定组:富类脂质植物遗体的残余物;如树脂腊、花粉、角质和藻类体..富含脂肪族成分;氢和挥发分含量高;碳含量低镜质组或腐殖组:含木质素、纤维素的植物组织的残余物;如树皮、树干和树根等..富芳香族成分、氧含量高、挥发分和氢含量中等丝质组或惰性组:较硬的富碳脆性小颗粒;原始物质和化学成分与镜质组相似;是丝碳化作用的产物;芳构化程度高;富含碳;氢、氧、挥发分含量低.. 17、成煤作用主要包括哪两个阶段各有什么特征泥炭化作用或腐泥化作用阶段:主导作用为生物化学作用;植物的组成物质在微生物参与下分解聚合变成泥炭或腐泥..地球化学阶段煤化作用阶段:包括泥炭或腐泥被沉积物覆盖后变干;并向褐煤、烟煤、无烟煤转变的整个地球化学过程..18、研究环境背景值的意义有哪些1为环境质量评价和预测提供依据;2为污染物在环境中迁移和转化规律的研究和环境标准的制定提供依据;3为地方病病因的研究、工农业生产的合理布局等提供基础资料..19、土壤中元素的存在状态包括哪些土壤主要由固相、液相和气相物质组成..除C、O、H和部分N主要来自大气和水以外;其它的植物生长必需元素主要来自土壤液相和固相物质..20、环境地球化学研究的主要领域包括哪些1、环境变化的历史记录;研究环境变化规律、揭示环境变化原因、预测环境变化趋势;已成为地球科学界的重要任务2、水体富营养化;指湖泊、河流、水库、海湾等缓流水体接纳过多的氮、磷等营养物质;造成水体中藻类和水生生物的大量繁殖;并导致水体的透明度和溶解氧下降;鱼类和其它水生生物死亡、水质恶化的总体效应..3、环境污染的修复;指利用物理、化学、生物方法对土壤及水体中的重金属、有机污染进行治理;将有毒污染物转化为无毒物质;或减弱其毒性;从而减少污染物对生态系统和人体健康的负面影响..21、简述土壤污染的修复技术1土壤污染的化学修复;利用改良剂、抑制剂等降低土壤重金属污染物的水溶性、扩散性、或利用表面活性剂和有机溶剂改进土壤中有机污染物的亲水性;从而达到降低污染物的毒性或去除污染物的目的2土壤污染的生物修复;包括有机污染物的微生物修复和重金属污染的植物修复两种..植物修复是一种有效地、低成本的新方法..22、常见的地方病包括哪些1.甲状腺肿;由于人体中碘缺乏或过量引发的疾病..2.氟中毒;主要分布在干旱-半干旱地区;如华北平原及一些温泉地带3.克山病;病因未明的地方病;表现为心肌坏死..4.大骨节病;以骨关节粗大、变形为主要特征的地方病;患者在初期不易察觉;在晚期发生关节畸形和功能障碍..23、某岩石中由30%橄榄石;20%斜方辉石;15%单斜辉石;30%的长石;3%角闪石和2%石榴石组成;根据稀土元素在各个矿物中的分配系数见下表;计算La、Ce、Nd、Sm、Eu和Yb元素在全岩中的总分配系数是多少如果该岩石发生部分熔融;根据总分配系数说明哪些元素容易进入熔体相;哪些元素容易进入残余相..根据上表中分配系数的数据;在上图中三条分配系数曲线上分别标注上正确的矿物名称.24、某一玄武岩中;轻重稀土明显分异;其中LREE/HREE>20;请解释轻重稀土分异可能的原因..这一参数能较好地反映REE元素的分异程度以及指示部分熔融残留体和岩浆结晶矿物的特征25、根据放射性衰变规律;推导出放射性同位素等时线公式..解:据衰变理论;在任一时刻t不稳定母核的衰变速率正比于尚未衰变的原子数N;其衰变方程可表达为:-dN/dt=λN1由t=0到t求积分得:N=N0e-λt2假定t=0时;子体核数为0;则任一时刻母核产生的子核原子数D可表示为D=N0-N代入2式:D=N e-λt-1或D=N01-e-λt3用D0表示t=0时系统存在的子核原子数:D=D0+D4所以:D=D0+N e-λt-15为方便测定;选取子体元素其它同位素Ds作为参照进行比值测定:D/Ds=D/Ds0+N/Ds e-λt-166式即为放射性同位素等时线公式..26、Rb-Sr等时线满足的条件是什么1所研究的一组样品岩石或矿物具有同时性和同源性;2形成时Sr同位素组成在体系内是均一的;因而有着相同的87Sr/86Sr初始同位素比值;3体系内化学成分不同;Rb/Sr比值有差异;可确保获得一条较好的等时线;4自结晶以来;Rb、Sr保持封闭体系;没有与外界发生物质交换..四、论述题1、论述地球化学、化学、地球科学其他学科在研究目标和研究方法方面的异同地球化学与与研究地球物质成分的矿物、岩石、矿床学和化学的关系如下表所示:地球化学研究对象全部化学元素与同位素元素在地球、地壳中演化活动的整个历史地球、地壳矿物学原子的集合体—矿物岩石学矿物的集合体—岩石矿床学有用矿物的集合体—矿石、矿床化学元素及化合物元素及化合物的化学性质及行为实验室研究内容研究对象所处的空间位置只研究元素全部活动历史过程中的某个阶段;元素活动的某个“暂时”存在的形式地球、地壳从表中我们可以看出:1地球化学是研究元素在地球、地壳中演化活动的整个历史;而矿物、岩石、矿床等学科仅研究元素全部活动历中的某个阶段;2地球化学是在自然界;又具有空间上条件的不均一性;时间上单向演化和阶段性;体系的多组分;多变度及总体的开放性;3地球化学研究不能脱离基础地质工作;它的一般工作程序仍然是在研究任务的指导下采用先野外;后室内的工作顺序;并注意从对地质体的观察来提取化学作用信息;建立地球化学研究构思..而化学主要是在实验室中;它是人为控制的体系;可以任意调节T、P、pH、Eh、C和纯化杂质2、论述类质同象规律的意义..1.确定元素的共生组合以岩浆岩为例:Ni、Co、Cr等主要集中于超基性岩中;这与超基性岩中Fe、Mg矿物大量析出有关;酸性岩中Li、Be、Rb、Cs、Tl、Ba、Y、W、Sn、Pb等的高含量往往与K、Na、Si矿物的富集有关;各类岩浆岩中微量元素含量高低及其变化实际上反映了元素间的结合规律;微量和主量元素的组合及微量元素对主量元素的依赖;主要受类质同象规律制约;2.决定元素在共生矿物之间的分配元素在同一岩石各组成矿物间的分配往往是极不均匀的;这种不均匀分配受结晶化学和热力学多方面因素的控制;可以归纳为主要受类质同象规律和分配定律的控制..3.支配微量元素在交代过程中的行为热液作用下岩石常发生交代变质..交代变质过程中系统是开放的;有元素迁出和带入;在主量元素发生迁移的同时;与主量元素发生类质同象置换的微量元素也会发生相似的迁移活动;如钾长石交代岩石中的钠长石时;Sr2+会随着Na+而迁出进入溶液;而Rb+则随着K+一起进入钾长石中;4.类质同象元素比值可作为地质作用过程和地质体成因的标志黄铁矿中常有Co、Ni等元素呈类质同象混入;在内生和外生条件下生成的黄铁矿中Co、Ni 含量不同..黄铁矿Co/Ni比值可以确定矿床的成因..5.标型元素组合矿物中含有大量类质同象的“杂质”;但同一种矿物在特定成因下往往只富含某些特征类质同象元素组合;据此可推断矿物形成环境..将有成因意义的元素组合称为指纹元素组合;也称为标型元素组合..6.影响微量元素的集中或分散以Be矿化为例分析类质同象是如何影响微量元素集中和分散的;地质事实:Be的质量分数--碱性岩中Be为7×10-6-9×10-6;酸性花岗岩中为3×10-6-5×10-6..酸性花岗岩中相对较低;但是自然界极少见到与碱性岩有关的Be矿床;却在某些与酸性花岗岩有关的伟晶岩脉中发现Be矿床;Be以形成绿柱石Be3Al2Si6O18形式富集..7.分配系数与地质温度计微量元素在晶体中的分配系数distributioncoefficients可用于估计共存矿物形成的温度;称为地质温度计-geothermometers..8.环境地球化学效应19世纪末的欧洲;有人在废弃的铅锌矿山附近居住;数年后这些人得了一种怪病;浑身骨骼疼痛难忍;后来;病人的手脚稍用力或略一弯腰就会导致骨骼断裂;最后只能在痛苦中死去..对此许多名医都未能查出病因;后来还是法医发现病人破碎的骨骼中镉Cd含量异常高..这种病后来被定名为“骨痛病”4、论述石油和天然气形成的一般过程..石油和天然气是沉积有机质热演化过程的阶段性产物..演化过程可分为三个阶段:1成岩作用阶段:温度、压力低;促使有机质演化的主要营力是生物作用..沉积物中的有机质:被微生物的新陈代谢所利用;转化为微生物的细胞;经缩合作用形成干酪根生油母质2深成热解作用阶段;3变质作用阶段..5、论述人类对生物地球化学循环的干扰作用并举例说明..人类对碳循环的干扰:1森林的过度砍伐造成植被覆盖率低;植被对大气中CO2的吸收量减少;2能源燃料的燃烧会向大气排放大量CO2..人类对氮循环的干扰:1任何的燃烧活动均能产生大量NO;经一些列化学作用形成酸雨;破坏农作物、树木;使生态系统产生紊乱;2NO3-等反硝化作用和矿物燃料不完全燃烧产生的NO2、NO等进入大气;不仅能与碳氢化合物形成光化学烟雾;而且还破坏臭氧层;紫外线增加;NO2也是一种温室气体;3氮肥需求量增加;促使合成氨工业从大气中消耗更多N2;或促使开采更多的含氮矿物原料如煤等4含有大量氮的农田排水和城镇生活污水造成水体污染和富营养化..人类活动对磷循环的干扰:1磷肥的大量使用;造成农田水含磷量增高;生活污水和某些工业废水中含有较高的磷;进入湖泊和海洋后将造成富营养化和海洋赤潮;2由陆地进入海洋的磷;只能部分返回陆地;从未造成陆地磷的减少;为了保证工农业生产;只能大量开采磷矿石;进一步加快陆地磷的循环..人类活动对硫循环的干扰:1含硫煤和石油燃烧产生的SO2约占人类活动向大气排放的SO2总量的2/3;2石油的炼制、硫化物矿石的冶炼等排放的废气中也含有大量SO2;进入大气后不仅对动植物产生危害;同时经氧化形成酸雨后;会对土壤和植被产生大面积的破坏..6、推导分异结晶作用模型一个包含不同组分总摩尔数为n的有限岩浆房;其中有y摩尔微量元素i如Ni..体系中i 的摩尔分数为Xi=y/n..当一种含i的矿物结晶时;如果每个相继晶体内层来不及与残余熔体保持平衡;或由于i在晶体中扩散缓慢;或由于晶体下沉使晶体每个相继内层未能与残余熔体保持平衡..在一个短时间之后;n变为n-dn;y变为y-dy;此时晶体与熔体中i的摩尔浓度分别为:Xi晶体=dy/dnXi熔体=y-dy/n-dn4.11i为微量元素服从亨利定律;据分配定律:Xi晶体=dy/dn=KDXi熔体4.12dy/dn可直接用Xi熔体表示..4.11右边;相对y;dy可忽略不计;相对于n;dn可忽略不计..有:Xi熔体=y/n;所以y=n·Xi熔体上式两边对n微分:dy/dn=ndXi熔体/dn+Xi熔体将4.12代入上式得:KDXi熔体=ndXi熔体/dn+Xi熔体4.13整理后:·dXi熔体=1/n·dn4.14如果在结晶过程中KD为常数;对上式在Xi0和Xi熔体之间以及初始熔体量n0和任何时刻n 值之间积分;得出分异结晶过程中该微量元素浓度的总体变化:4.15KD-14.16n/n0为残余熔体占原始熔体的百分数;以F表示;1-F反映岩浆的结晶程度;有:Xi熔体=Xi0·FKD-14.177、假定有一含斜长石50%;单斜辉石30%;橄榄石20%的辉长岩源岩经历部分熔融;用批次熔融模型计算当F=0.05;0.1;0.15;0.2;0.3;0.4;0.5;0.6;0.7;0.8;0.9时Rb;Sr的C l/C o;并绘制每种元素的C l/C o vs.F的演化图解..分配系数参考简答题23中的表..7.根据下表中给定的sample1和sample2的稀土元素的数据;计算∑REE;LREE/HREE;La/YbN 和δEu;根据δEu解释Eu异常出现的原因;计算球粒陨石标准化数据并把标准化的数据投入下图中;根据稀土配分图描述sample1和sample2的稀土地球化学特征及可能反映的岩浆成因..相对于三价REE离子;Eu在斜长石和钾长石中是相容元素;斜长石和钾长石结晶或斜长石在部分熔融残余体中的存在可以在熔体中造成Eu亏损或负异常;即Eu异常主要受长石特别是长英质岩浆的控制..因此由结晶分异长石从长英质熔体中移出;或岩石部分熔融长石保留在源区;都会在熔体中产生Eu负异常;石榴子石;磷灰石;普通角闪石;单斜辉石;紫苏辉石;榍石等在残余体中存在或早期结晶析出均可造成熔体中Eu相对富集或形成Eu正异常..在一火山岩系列中;Eu负异常逐渐增大;表明如果是斜长石作为斑晶;则斜长石不断从熔体中析出是Eu负异常逐渐增加的原因;与F和D的8.根据下图分别描述部分熔融和结晶分异作用过程中元素在熔体相中的浓度CL关系..①熔融程度低时;F→0;C i l/C i0→1/D;形成熔体中Tr富集或贫化程度最大..熔融程度很低时D 1的不相容元素富集达到最大..如果知道某Tr在低度部分熔融岩浆中浓度和D值;据方程估计该元素在源区中浓度..随F增大;熔体中Tr富集或贫化程度减小..当F→1;C i l/C i0=1..熔体中元素浓度完全与母岩中原始浓度趋于一致..②D<1的不相容元素在形成熔体中富集;最大富集浓度不会超出D=0的曲线;D=0时;C i l/C i0=1/F;与分异结晶一致;部分熔融的开始相当于结晶分异的结束..③D>1的相容元素在部分熔融形成的熔体中贫化..与分异结晶不同;部分熔融中相容元素浓度随熔融程度F增大缓慢增大;而在分异结晶中;相容元素随结晶程度增大F减小在残余岩浆中迅速贫化..应用这种差别;可以判别一个岩浆系列是岩浆分异结晶的产物;还是由部分熔融所成..9.假设一花岗岩中的黑云母用来Rb-Sr定年;其中我们测得的Rb=500ppm;Sr=0.6ppm;已知在黑母中仅含有87Rb和85Rb;并且87Rb/85Rb=2.5;黑云母仅含有放射性成因87Sr;其中给定的衰变常数λ=1.4210-11yr_1;计算花岗岩中黑云母的年龄..Rb-Sr定年公式如下其中λ远远小于年龄时;eλt~1+λ.10.某两种岩石的143Nd/144NdI 分别为0.51167和0.51313;计算这两岩石的εNdCHUR值..根据计算的结果;讨论该岩石的源区..已知:143Nd/144NdCHUR..=0.512638。

(完整word版)地球化学复习资料球类陨石:主要由基质、球粒、金属和一些特殊矿物集合体等组成。
碳质球类陨石是球粒陨石中的一个特殊类型,含有碳的有机化合物分子,并且主要由含水硅酸盐组成。
CI型陨石为什么能够作为太阳系元素丰度标准?I型碳质球类陨石中难挥发元素的丰度与太阳一致,且未经受热变质作用影响、形成于远离太阳的较低温区域,是最原始的太阳星云凝聚物资。
因而,它能保持着太阳星云中非挥发元素的初始丰度。
第二章复习题1、元素的地球化学亲和性元素地球化学亲和性:主要指阳离子在自然体系中趋向同某种阴离子化合的倾向。
又可指在自然体系中元素形成阳离子的能力和所显示出的有选择地与某种阴离子结合的特性。
2、戈尔德斯密特的元素地球化学分类1)、亲石元素:离子的最外层电子层具有8电子(S2P6)惰性气体型的稳定结构,与氧容易成键,主要集中于硅酸盐相。
2)、亲铜元素:离子的最外层电子层具有18铜型结构(s2p6d10)在自然界中容易与硫形成化合物,这些元素在分配时,主要分配在硫化物相中。
3)、亲铁元素:离子最外层电子层具有8-18过渡型结构,这种元素同氧、硫的化合能力较差,倾向于形成自然元素,因此,这类元素倾向分配在金属相中4)、亲气元素:原子最外层具有8个电子,原子半径大,具有挥发性或易形成挥发性化合物,主要分布在大气圈中。
5)、亲生物元素:这类元素主要富集在生物圈中。
3、类质同像的概念类质同像概念:某种物质在一定的外界条件下结晶时,晶体中的部分构造位置被介质中的其他质点(原子、离子、络离子或分子)所占据而只引起晶格常数的微小改变,晶格构造类型、化学键类型、离子正负电荷的平衡保持不变或相近,这种现象称类质同像。
5、影响元素类质同像的物理化学条件1)、组份浓度---“补偿类质同像”一种熔体或溶液中如果缺乏某种组份,当从中晶出包含此种组份的矿物时,熔体或溶液中性质与之相似的其他元素就可以类质同像代换的方式加以补充。
2)氧化还原电位.7、电负性;1衡量中性原子得失电子的难以程度2电负性(X)=I(电力能)+E(电子亲和能)3同一周期元素由左到右X值增大,酸碱度与之一致4金属与非金属分界线是元素酸碱性分界线5提供自然反应系中的酸碱度的标准6反映原子的电子层结构特征7决定元素在结合规律中的亲和性与酸碱性8、研究元素类质同像的地球化学意义1)、确定了元素的共生组合。

地质学基础复习资料第一章绪论1.地质作用:形成和改变地球的物质组成、外部形态特征与内部构造的各种自然作用。
分为内力作用(岩浆作用、构造作用、地震作用、变质作用、地球各层圈相互作用),外力作用(地质体的风化作用、重力滑动作用、剥蚀作用、搬运作用、沉积作用、固结成岩作用)第二章矿物1.地壳:指固体地球的最外圈,由岩石组成,岩石圈的重要组成部分底界为莫霍面。
2.克拉克值:由美国化学家求出的厚16km的地壳内50种元素的平均含量与总质量的比值,也称为地壳元素丰度。
3.矿物:由地质作用形成,在正常情况下呈结晶质的元素或无机化合物,是组成岩石和矿石的基本单元。
4.矿物的物理性质:透明度、光泽、颜色、条痕、硬度、节理、断口、密度、磁性。
5.矿物的分类;自然元素矿物、硫化物及其类似化合物矿物、卤化物矿物、氧化物和氢氧化物矿物、含氧盐矿物。
6.主要造岩矿物:石英、钾长石、斜长石、云母、角闪石、辉石、橄榄石(这些矿物在造岩运动中占有极其重要的地位)7.(辨析题):①对比解理与断口:解理是指晶体受到外力打击时能够沿着一定结晶方向裂成平面(即解理面)的能力。
断口是指矿物受到外力打击后不沿固定的结晶方向开裂而形成的的断裂面。
这两者截然相反!②对比晶体与非晶体:晶体是其内部原子或离子在三维空间呈周期性平移重复排列的固态物质。
非晶体是内部原子或离子在三维空间不呈规律性重复排列的固体。
③对比显晶质与隐晶质:显晶质指晶粒大小不一,较粗的用肉眼或放大镜就可以看出来。
隐晶质指晶粒细微,通过显微镜才可加以分辨。
第三章岩浆作用与火成岩1.岩石:火成岩,沉积岩与变质岩。
2.岩浆作用:指岩浆发育、运动、冷凝固结成为火成岩的作用,包括喷出作用与侵入作用。
3.喷出作用:岩浆喷出地表,冷凝固结的作用。
固体(火山灰-----凝灰岩,火山砾、火山渣------火山角砾岩,火山弹,火山块-------集块岩)4.火山喷发方式:(中心式、裂隙式和融透式)或者(宁静式、猛烈式和交替式)5.(填空题)喷出岩类型:按SiO2含量分:<45%超基性岩浆(科马提岩),45%—52%基性岩浆(玄武岩),52%—65%中性岩浆(安山岩),>65%酸性岩浆(流纹岩)。
名词解释1.浓度克拉克值:概念系指某元素在某一地质体(矿床、岩体成矿物等)中的平均含觉与克拉兑值的比值,表示某种元素在一定的矿床、岩体或矿物浓集的程度。
当浓度克拉克值人于1吋,说明该元素在地质体中比在地壳中相对集中;小于1吋,则意味帮分散2.亲氧性元素:倾向于与氣形成高度离子键的元索称亲氧元索。
特征是:离了•半径较小,宥惰性气体的电子层结构,电负性较小。
如K、Na、Ca、Mg、Nb、Ta、Zr、Ilf、KEE等;易形成怡性气体型离子;3.元素的地球化学迁移:即元素从一种赋存状态转变为一种赋存状态,并经常伴随着元素组合和分布上的变化及空间上的位移4.普通铅(或正常铅):普通铅(或正常铅):指产于U/Pb、Th/Pb比位低的矿物和岩石中任何形式的铅(如方铅矿、黄铁矿、钾长石等),在矿物形成以前,Pb以正常的比例与U、Th共生,接受U、Th衰变产物Pb的不断叠加并均匀化。
5.不相容元素:趋向于在液相中宮集的微觉元素。
由丁•其浓度低,不能形成独立矿物相,并且因离子半径、电荷、晶场等性质与构成结晶矿物的主元素相差很人,而使其不能进入矿物相。
仑们的固相/液相分配系数近于零。
6.同位素分馏系数:达到同位素交换平衡时共存相同位素相对丰度比值为常数,称分馏系数a,或者指两种物质(或物相)之间同位素比值之(□),即u A-B-RA / R B,式中A,B表示两种物质(或物相),K表示重同位素与轻同位素比值,如3 4S/32S,180/1 60。
《表示同位素的分馏程度,《值偏离1愈人,说明两相物质之间M位素分馏程度愈人;a =1吋物质间没有M位素分馏7.K(不稳定常数):金屌离子与配位体生成络合物的逆反成是络合物的解离反应,达成平衡时的常数,称为不稳定常数。
它与稳定常数互为倒数。
不稳定常数越大,络合物越不稳定。
8.S Eu:反映Eu异常的迦。
.9.稀土元素(REE):原子序数57-71的镧系元素以及与镧系相关密切的钪和钇共17种元素,包括:La, Ce, Pr , Nd, Pm,Sm, Eu , Gd,Tb,Dy,Ho , Er,Tm,Yb,Lu,Sc,Y10.高场强元素(HFSE):指离子半径小、电荷高,难溶于水,地球化学性质稳定的元素,如Nb、Ta、Zr、Hf、P、Th、HREE等,它们可作为“原始”物质组成特征的指示。
《地球化学试题》期末考试试卷考试形式:闭卷考试考试时间:120分钟班号学号姓名得分一、概念题(每题5分,共40分):1、元素的浓集系数2、元素的赋存状态3、元素的地球化学迁移4、固溶体5、能斯特分配系数6、戈尔德斯密特矿物相律7、δ18O值8、衰变定律二、问答题(30分):1、夏天和冬天相比,河水中的pH值是升高还是降低?为什么?白天和夜晚相比,湖水的pH值是升高还是降低?为什么?(6分)2、一个完全不相容元素的矿物/熔体总分配系数是多少?如果在批次熔融的情况下,某元素的总分配系数等于1,那么它的CL/C0比值(元素在熔体中的浓度与其在初始固相中浓度的比值)是多少?(6分)3、下列岩浆岩:①形成过程中仅与岩浆水发生了相互作用;②形成过程中广泛地与大气降水发生了相互作用。
试回答哪一种岩浆岩D/H比值和18O/16O 比值更高?(6分)4、下图为NaCl-H2O二元体系的相图(稳定常压条件下),试根据吉布斯相律分析图中C、D、E和F点存在的相数、各相的名称和自由度数。
(12分)三、论述题(每题10分,共30分):1、试论元素地球化学亲和性产生的内在原因。
2、如何编制稀土元素配分曲线?常用哪些指标描述稀土元素分布特征?3、试论自然界氧同位素的主要分馏反应?四、附加题:1、结合地球化学、矿床学和岩浆岩石学的知识,试分析为什么周口店房山花岗闪长岩体没有产生成矿作用?发生成矿作用的前提和必要条件是什么?2、试谈你对地球化学学科的认识,地球化学对你今后的地球科学学习和研究有什么样的启发?3、谈谈你对地球化学课程教学改革的想法。
A 卷答案:一、概念题:1、指某元素在矿床中的最低可采品位作为它在该地质对象中的平均含量,计算它与克拉克值的比值,即为该元素的浓集系数。
2、也称为元素的存在形式、结合方式、相态、迁移形式等,指元素在其迁移历史的某个阶段所处的物理化学状态与共生元素的结合性质。
3、元素从一种赋存状态转变为另一种赋存状态,并经常伴随元素组合和分布上的变化以及空间位移的作用称为地球化学迁移。
东华理工学院2007年研究生考试地球化学试题一、名词解释(每题5分:6×5=30分)1.相容元素:2.亲铁性:元素在自然界倾向于与铁有较强亲和力、易于呈自然金属元素状态存在的性质。
;元素在自然界以金属状态产出的一种倾向性3.偶数规则:元素周期表中相邻的两元素,原子序数为偶数的,其在地壳中的平均含量常大于奇数元素的含量。
4.元素的地球化学亲和性是指在自然体系中元素形成阳离子的能力和所显示出的有选择性地与某种阴离子化合(结合)的倾向性。
5.地球化学障:我们把表生带在短距离内迁移条件明显交替,并导致化学元素浓集的地段称为地球化学障(垒)。
6.BABI :二、填空题(每题5分:4×5=20分)7.有若干化学元素的化学性质和地球化学性质十分相似,例如铌与_____,锶与______,铪与______,镓与__________,铷与_________。
8.在自然界变价元素的矿物共生组合常用来定性地指示地质作用的环境条件,如自然铁、黄铁矿与金属硫化物的共生组合代表___________条件,而褐铁矿与磁铁矿的组合代表_____________条件,褐铁矿与针铁矿及硫酸盐矿物代表___________条件。
9.根据分馏作用的性质和条件可把自然同位素分馏作用区分为________________、_______________、____________、____________。
10.自然衰变反应的种类有________________、_______________、____________、____________。
三、论述题(任选5题完成)1.写出国际、国内两位著名的地球化学家的名字并简述其对地球化学的主要贡献(20分)。
2.简述当今社会如何利用地球化学知识为国民经济和社会可持续发展服务(20分)。
3.论述地球化学的室内外研究方法(20分)。
4.以Au、U和Cu三个元素中的任何一个元素为例说明它们在自然界各种不同地质作用过程中的地球化学行为(20分)。
东华理工大学地球化学复习题第一篇地球化学知识点整理(狼图腾)整理方法:课本+笔记+参考资料注:有些并非很重要!一、名词解释1.地球化学:是研究地球(包括部分天体)的化学组成、化学作用和化学演化的学科。
2.元素的丰度值:指各种化学元素在一定自然体系中的相对平均含量。
3.陨石:是降落在地球上的行星物质的碎块。
4.克拉克值:指地壳中元素重量百分数的丰度值。
5.丰度系数:指某一自然体的元素丰度与另一个可作为背景的自然体元素丰度的比值。
6.克里普岩:是岩浆分异或残余熔浆结晶形成的富含挥发组分元素的岩石,其富K、REE和P。
7.元素的地球化学亲和性:指在地球化学作用过程中,元素形成阳离子的能力和所显示出有选择地与某种阴离子结合的特性。
8.类质同像:指矿物在一定的物理化学条件下结晶时,晶体结构中某种质点(原子、离子、配离子、分子)被其他类似的质点所代替,结果只引起晶格常数的微小改变,晶体的构造类型、化学键类型等均保持不变的现象。
9.微量元素地球化学:是借助各种现代分析测试技术,基于微量元素地球化学的基本理论研究微量元素在地球及其子系统中的分布、化学作用及其演化的学科。
10.微量元素:指在所研究体系中(地质体、岩石、矿物、流体/熔体等)的含量低到可以近似地用稀溶液定律描述其地球化学行为的元素。
11.稀溶液定律(即亨利定律):在极稀薄溶液中,溶质的活度正比于溶质的摩尔浓度。
12.分配系数:微量元素i在平衡共存的两相之间的质量浓度比值。
13.(1)相容元素:(表述1)在岩浆结晶过程中,那些容易以类质同像的形式进入固体的微量元素。
(表述2)岩浆结晶或固相部分熔融过程中偏爱矿物相的微量元素(2)不相容元素:岩浆结晶或固相部分熔融过程中偏爱熔体或溶液相的微量元素。
14.元素地球化学迁移:元素从一种赋存状态转变成为另一种赋存状态,并经常伴随元素组合和分布上的变化以及空间位移的作用。
15.地球化学障:在元素迁移过程中,如果环境的物理化学条件发生了急剧变化,导致介质中原来稳定迁移的元素其迁移能力下降,元素因形成大量化合物而沉淀,则这些影响元素沉淀的条件或因素就称为地球化学障。
第一章地下水的无机化学成分一、名词解释1、侵蚀性CO 2 2、游离CO 2 3、平衡CO 2 4、Ph 5、去硝化作用6、硝化作用7、微量组分8、大量组分9、组分二、填空题1、地下水中的化学组分可以分为四组:(),(),(),和();水的中性点的pH 值随温度的升高而()。
2 、Cl - 具有很强的迁移性能,其原因在于:(),(),()。
碳酸衍生物的存在形式与水的pH 值有关,当pH>8 时,以()占优势:当pH<5 时,则以()占优势。
3、细菌按呼吸方式分有和两大类。
三、简答题1、地下水中氟的来源简况。
2、地下水中的主要气体成分及来源。
3、何谓地下水中的微量元素?研究它有何意义?4、什么是硝化作用或去硝化作用,它们各在什么环境中进行?四、论述题试论地下水中二氧化碳的起源及其水文地球化学意义。
第二章地下水中的有机物质及其地球化学意义一、简答题1、机物质对元素的迁移与沉淀有何影响? 2、溶性有机物质对地下水中元素迁移和富集的影响?3、下水中的有机质的来源有哪些?其中哪个最重要?4、机物质对铀的迁移和富集有何影响?5、溶性有机物质对化学元素在水中的迁移和富集有哪些影响?6、什么情况下有机物有利于铀的水迁移,在什么情况下它有利于铀的沉淀?二、填空题1、地下水中有机质的主要来源有()和()。
三、论述题根据表3.12 和3.13,分析地下水中有机物的来源。
表3.12 补给、迳流和排泄区地下会中有机物的含量补给区迳流区排泄区化合物平均值mg/L 分布率% 平均值mg/L 分布率% 平均值mg/L 分布率% 挥发性有机酸6.7 58 60.0 58 25.6 70 有机酸6.7 88 26.0 93 20.1 100 环烷酸1.9 34 1.3 38 2.3 67 高分子酸0.09 65 0.15 71 0.12 61 酚类 1.1 50 1.2 46 0.5 59 表3.13 地下水中有机碳的含量地下水有机碳平衡含量,毫克/升潜水27.4 层间承压水48.5 层间承压水的排泄区52.5 石油矿床附近的层间承压水370~826 油汽凝结矿床附近的层间承压水(以酸性挥发有机物为主)石油矿床外围的层间承压水110 石油矿床中不产油的地层水60第三章水及水中元素的同位素成分(一)名词解释1、同位素效应2、同位素分馏3、温度效应4、纬度效应5、高程效应6、大陆效应7、季节效应8、雨量效应9、山体屏蔽效应10、氧漂移11、降水氢氧稳定同位素的高程效应(二)填空题1、氧同位素的国际标准英文缩写为(),而碳同位素的国际标准缩写为()。
第一篇地球化学知识点整理(狼图腾)整理方法:课本+笔记+参考资料注:有些并非很重要!一、名词解释1•地球化学:是研究地球(包括部分天体)的化学组成、化学作用和化学演化的学科。
2•元素的丰度值:指各种化学元素在一定自然体系中的相对平均含量。
3•陨石:是降落在地球上的行星物质的碎块。
4•克拉克值:指地壳中元素重量百分数的丰度值。
5•丰度系数:指某一自然体的元素丰度与另一个可作为背景的自然体元素丰度的比值。
6•克里普岩:是岩浆分异或残余熔浆结晶形成的富含挥发组分元素的岩石,其富K、REE 和P。
7•元素的地球化学亲和性:指在地球化学作用过程中,元素形成阳离子的能力和所显示出有选择地与某种阴离子结合的特性。
8•类质同像:指矿物在一定的物理化学条件下结晶时,晶体结构中某种质点(原子、离子、配离子、分子)被其他类似的质点所代替,结果只引起晶格常数的微小改变,晶体的构造类型、化学键类型等均保持不变的现象。
9•微量元素地球化学:是借助各种现代分析测试技术,基于微量元素地球化学的基本理论研究微量元素在地球及其子系统中的分布、化学作用及其演化的学科。
10. 微量元素:指在所研究体系中(地质体、岩石、矿物、流体/熔体等)的含量低到可以近似地用稀溶液定律描述其地球化学行为的元素。
11. 稀溶液定律(即亨利定律):在极稀薄溶液中,溶质的活度正比于溶质的摩尔浓度。
12. 分配系数:微量元素i在平衡共存的两相之间的质量浓度比值。
13. (1)相容元素:(表述1)在岩浆结晶过程中,那些容易以类质同像的形式进入固体的微量元素。
(表述2)岩浆结晶或固相部分熔融过程中偏爱矿物相的微量元素(2)不相容元素:岩浆结晶或固相部分熔融过程中偏爱熔体或溶液相的微量元素。
14. 元素地球化学迁移:元素从一种赋存状态转变成为另一种赋存状态,并经常伴随元素组合和分布上的变化以及空间位移的作用。
15. 地球化学障:在元素迁移过程中,如果环境的物理化学条件发生了急剧变化,导致介质中原来稳定迁移的元素其迁移能力下降,元素因形成大量化合物而沉淀,则这些影响元素沉淀的条件或因素就称为地球化学障。
16. 原始地幔:地核形成以后,地壳形成以前的地幔。
17. 亏损地幔:原始地幔经过部分熔融形成地壳以后残余的地幔。
18. 富集地幔:由于板块俯冲作用将地壳物质再循环返回地幔后所形成的地幔。
19. 五重简并:在一个孤立的过渡金属离子中,五个d轨道的能级相同,电子云呈球形对称,电子在五个d轨道的分布概率相同,称为"五重简并”。
20. 晶体场分裂:当过渡金属离子处在晶体结构中时,由于晶体场的非球形对称特征,使d轨道的能级产生差异,称为“晶体场分裂”。
21. 晶体场分裂能:将一个孤立的过渡金属离子放在正八面体配位的晶体中时,五个d 轨道都受到配位体负电荷的排斥,轨道总的能级提高;由于正八面体配位场中配位体质点处于直角坐标的三个垂直轴方向,故dr轨道电子云的瓣指向配位体,使两个dr轨道电子的被排斥力比d?轨道的被排斥力大,dr轨道的能级要比d?轨道电子的能级高得更多,dr轨道电子的能级与d?轨道电子能级间的能量差,称为“晶体场分裂能”。
22. 晶体场稳定能:d轨道电子能级分裂后的d电子能量之和,相对于未分裂前d电子能量之和的差值,称为“晶体场稳定能”。
23. 八面体择位能:离子八面体配位的晶体场稳定能减去其四面体配位的晶体场的稳定能。
二、问答题1. 简述地球化学的研究内容。
(1)自然界中元素和同位素的组成与分布。
(2)地质作用过程中各种元素迁移和共生组合规律。
(3)地质运动过程中元素的演化和循环历史。
(4)地球化学的基础理论研究。
(5)应用地球化学研究。
简述地球化学的研究思路和学科特点。
(1)通过分析常量、微量元素和同位素组成的变化,元素相互组合和赋存状态变化等追索地球演化历史;(2)利用热力学等现代科学理论解释自然体系化学变化的原因和条件,探讨自然作用的机制;(3)将地球化学问题置于地球和其子系统(岩石圈、地壳、地幔、地核等)中进行分析,以个系统的组成和状态约束作用过程的特征和元素的行为。
2. 简述太阳系元素组成的研究方法。
(1)直接采样分析,如直接测定地球岩石、各类陨石和月球岩石的样品(2)光谱分析,如对太阳光谱和小行星带天体进行定性和定量测定(3)由天体的物理性质与成分的对应关系来推算行星组成(4)利用宇宙飞行器对星体进行观察、就位探测或取样返回分析(5)遥感和取样分析测定气体星云或星际间物质(6)分析研究宇宙射线简述相对丰度的计算中采用106Si 原子做除数的原因。
(1)Si 分布广,便于对比各种自然体系中的丰度值;(2)Si 挥发性小,稳定性好;(3)在化学分析和光谱分析中,Si 易精确测定;(4)大部分元素的相对原子数的数量级在106—10-4之间。
简述丰度表示法:1)重量丰度:以重量单位表示的元素丰度2)原子丰度:以原子百分数表示的某元素在全部元素的原子总数中的分数3)相对分数:以硅原子的106原子为基数求其他原子的相对原子数简述陨石的分类。
分类依据:(1)所含金属与硅酸盐的比值;(2)陨石结构;(3)陨石化学成分。
分类类型:铁陨石,石—铁陨石,石陨石。
简述地球内部的地球化学特征。
(1)h<60km,正常化学作用带;(2)h在60—2900km,退化学作用带,地幔榴辉岩圈;(3)h>2900km无化学作用带,“金属化”核心。
3. 简述陨石的研究意义。
(1 )陨石物质的平均成分为非挥发性元素的相对丰度提供了最好的信息;(2)为陨石成因和太阳系的起源、年龄、演化历史提供了极有价值的数据。
4. 简述CAI 的定义及其作用CAI 是指球粒陨石中由富Ca 和Al 的氧化物和硅酸盐组成的难熔物质集合体。
作用:CAI是太阳星云最早期各种热事件的产物,保存了星云最原始的信息,具有同位素异常和大量灭绝核素子体,是研究早期太阳星云形成和演化的探针。
5. 简述月岩的研究意义。
(1)有助于了解地球早期历史;(2)由月海玄武岩相当于拉斑玄武岩,反应月球与地球年龄相似;(3)月球中有可供人类利用的元素;(4)月岩早期火山活动即相当于地球火山带。
6. 简述克拉克值的研究意义。
版本一(上课笔记):(1)元素克拉克值影响着元素参加地壳地球化学过程的浓度,支配着元素的地球化学行为;(2)元素克拉克值可以为阐明地球化学省的特征提供依据;(3)依据克拉克值可以计算出地壳中地球化学性质相似或相关元素之间的平均比值。
版本二(参考资料):(1)控制元素的地球化学行为:1)支配元素的地球化学行为。
2)限定自然界的矿物种类及种属。
3)限制了自然体系的状态。
4)对元素亲氧性和亲硫性的限定。
(2)地壳克拉克值可作为微量元素集中、分散的标尺:1)可以为阐明地球化学省(场)特征提供标准。
2)指示特征的地球化学过程3)浓度克拉克值和浓集系数可表述元素的集中与分散以及其在地壳中富集的能力7. 应用陨石类比法研究地球化学元素丰度的假定前提。
(1)陨石在太阳系形成;(2)陨石与小行星成分相同;(3)陨石是破坏了的星体碎片;(4)产生陨石的星体,其内部结构和成分与地球相似。
简述大陆上地壳元素丰度的作用。
(1)是进行成矿预测和环境评价的主要地球化学依据;(2)是区域环境地球化学和农业地球化学评价的依据。
8. 简述地球化学自然体系的基本特征。
(1)自然作用体系中众多的化学组分共存,但是各组分之间的含量差异极大;(2)T、P 等条件的变化幅度与人为设置的实验条件相比相对有限;(3)具多变度单向发展演化特征的开放体系;(4)自发进行的不可逆过程。
9. 简述自然过程产物的特征。
( 1 )自然稳定相(矿物)及各种流体相的总数有限;(2)自然稳定相都不是纯的化合物。
几乎每一种矿物都是一个成分复杂、元素含量与一定变化范围的混合物系列;(3)元素形成自然分类组合;(4)一定物理化学条件下,矿物之间按一定生成环境呈现规律性的共生组合。
10. 简述自然体系中元素的赋存形式。
固相中:(1)独立矿物;(2)类质同像;(3)超显微非结构混入物;(4)吸附形势;(5)与有机质结合的形式液相中:(1)离子;(2)分子;(3)胶体;(4)微细颗粒物11. 简述元素赋存形式的研究方法。
(1)矿物学观察;(2)X射线衍射法;(3)电子探针;(4)显微镜观察;(5)萃取法(偏提取法);(6)电渗析;(7)透射电镜12. 简述离子电位的作用。
(1 )反应元素离子大小和离子电荷的综合作用效果的化学参数,它决定了离子吸引价电子的能力;(2)是表征离子电场强度的参数,其值等于离子的电荷与半径之比值,它决定了元素的存在形式和迁移能力。
13. 简述元素赋存形式的研究意义。
(1)元素的结合形式不同,其化学活动性亦不同;(2)同一种元素不同的赋存状态,可表现出不同的地球化学行为;(3)就矿产资源的可利用性而言,元素的存在形式有时比元素的含量更有意义。
14. 简述影响元素地球化学亲和性的主要因素。
(1 )元素的基本化学性质;(2 )化学反应的能量效应;(3)元素的丰度。
简述元素地球化学的分类(非重点)。
(1 )哥德施密特元素地球化学分类:______________ 分类依据:以其提出的地球起源和内部构造假说为基础,根据化学元素的性质与其在地球各圈层间的分配将元素分为:①亲石元素1)离子的最外层电子具有8个电子的稳定结构;2)以离子键的形式结合;3)氧化物的生成热大于FeO的生成热,与氧的亲和力强,易熔于硅酸盐熔体;4)位于原子容积曲线的下降部位;5)主要集中在岩石圈。
②亲铜元素1)离子的最外层电子层具有18个电子的铜型离子结构;2)电负性大;3)以共价键的形式结合;4)氧化物的生成热小于FeO的生成热,与硫的亲和力强,易熔于硫化铁熔体;5)位于原子容积曲线的上升部位;6)主要集中于硫化物一氧化物过渡圈。
③亲铁元素1)离子的最外电子层具有8-18个电子的过渡型结构;2)以金属键的形式存在;3)氧化物的生成热最小,与氧及硫的亲和力均弱,易熔于熔体;4)位于原子容积曲线的最低部分;5)主要集中于镍-铁圈中。
④亲气元素1)原子最外层具有8个电子;2)以分子键形式存在;3)原子容积最大处;4)具有挥发性或倾向形成易挥发化合物;5)主要集中在大气圈。
⑤亲生物元素多富集在生物圈内。
(非重点)(2)查瓦里斯基元素地球化学分类:____________ 以展开式元素周期表为基础,赋以原子和离子半径以重要意义并根据元素的地球化学行为的相似性将元素分为11族:①氢族;②惰性气体族;③造岩元素族:Li、Be、Na、Mg、Al、Si、K、Ca、Rb、Sr、Cs 和Ba;④岩浆射气元素族:B、C、N、0、F、P、S和Cl ;⑤铁族:Sc、Ti、V、Cr、Mn、Fe、Co 和Ni⑥稀有元素组:REE、Y、Zr、Hf、Nb和Ta;⑦放射性元素组:Ra、U和Th;⑧钼钨组Mo-W:Cu、Ag、Au、Zn、Cd、Hg、Ga、In、Tl、Ge、Sn 和Pb;⑨铂族:⑩半金属和重矿化剂族:As、Bi、Se、Te和Po;?重卤族:Br、I和At。