第三章 化学势资料
- 格式:ppt
- 大小:1.04 MB
- 文档页数:9

第三章 化学势§3.1 偏摩尔量(1)偏摩尔量的定义多组分系统的任一种容量性质X 可以看作是温度 T 、 压力 p 及各物质的量的函数,X = ƒ(T ,p , n B ,n C ,n D ,…)在定温定压条件下,dT=0,dp=0,则 dX = ΣX B dn BX B 称为物质B 的“偏摩尔量”。
偏摩尔量的物理意义是,在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入 1mol 物质 B 所引起的系统中某个热力学量 X 的变化,实际上是一偏微商的概念。
§ 3.2 化学势化学势的定义由于等温等压条件下吉布斯自由能的变化值课作为过程方向性的判定,也就是摩尔或偏摩尔吉布斯自由能的降低会推动过程(物质迁移或相变或化学变化)自发进行,故又称偏摩尔吉布斯自由能为化学势。
物质的化学势是决定物质传递方向和限度的强度因素,这就是化学势的物理意义。
§3.3 气体物质的化学势(1)纯组分理想气体的化学势对纯物质系统来说 G B = G mµ = µ θ+ RTln(p/ p θ)此式就是理想气体化学势表达式。
理想气体压力为p θ 时的状态称为标准态, µ θ 称为标准态化学势,它仅是温度的函数。
(2) 理想气体混合物的化学势θθμμpp ln B RT B B += 其中p B 是理想气体混合物中气体B 的分压,μθ是分压p B = p θ 时的化学势,称为气体B 的标准态化学势,它亦仅是温度T 的函数。
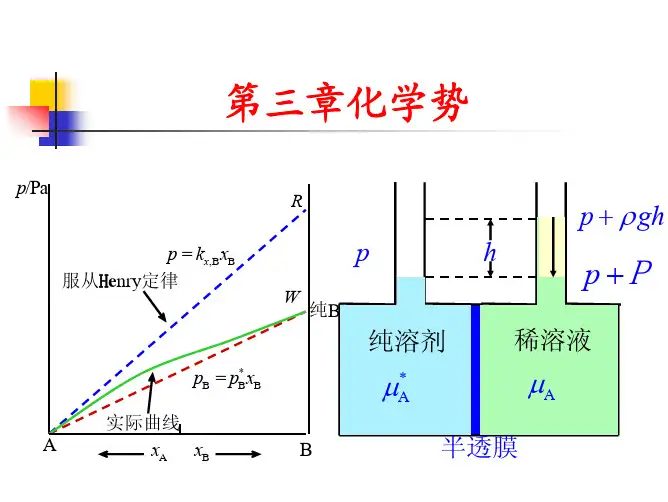
§3.4 理想液态混合物中物质的化学势(1)拉乌尔定律一定温度时,溶液中溶剂的蒸气压 p A 与溶剂在溶液中的物质的量分数X A 成正比,其比例系数是纯溶剂在该温度时的蒸气压 pA (上标“*”表示纯物质) ,称为“拉乌尔定律”。
用数学式可表示为p A = p A *X A此式不仅可适用于两种物质构成的溶液,亦可适用于多种物质构成的溶液。

第3篇化学势化学势,这个在化学领域中被频繁提及的概念,对于许多初学者来说,可能显得有些抽象和难以理解。
它是一个描述物质在化学反应中能量的变化和传递的重要参数,是理解化学反应热力学性质的关键。
那么,化学势究竟是什么呢?它又是如何影响化学反应的呢?我们需要明确化学势的定义。
化学势是一个物质在特定条件下的自由能变化率,它表示了该物质在反应中的能量状态。
简单来说,化学势越高,物质的能量就越高,它就越有可能发生反应。
那么,化学势是如何影响化学反应的呢?化学势决定了物质的反应活性。
当两种物质的化学势相差较大时,它们之间发生反应的可能性就越大。
这是因为化学势高的物质具有更高的能量,它们更倾向于释放能量,从而发生反应。
化学势还影响着反应的方向。
在封闭系统中,化学反应总是朝着化学势降低的方向进行。
这是因为系统会自发地朝着能量更低、更稳定的状态发展。
因此,通过控制化学势,我们可以预测和控制化学反应的方向。
化学势还与反应的平衡状态有关。
在化学反应中,当正反应和逆反应的速率相等时,系统达到平衡状态。
此时,反应物和物的浓度不再发生变化,系统的化学势达到最低。
通过改变反应条件,如温度、压力等,我们可以改变系统的化学势,从而影响反应的平衡状态。
化学势是一个描述物质在化学反应中能量变化的重要参数。
它不仅影响着物质的反应活性,还决定了反应的方向和平衡状态。
理解化学势的概念,对于我们深入理解化学反应的热力学性质具有重要意义。
在深入探讨化学势之前,我们还需要了解化学势与温度、压力等外界条件的关系。
这些外界条件的变化,会直接影响物质的化学势,进而影响化学反应的进行。
温度对化学势的影响。
根据热力学原理,温度的升高会导致物质的分子运动加剧,从而增加物质的化学势。
因此,在高温条件下,化学反应的速率通常会加快,因为反应物分子的碰撞频率和能量都增加了。
然而,对于放热反应来说,温度的升高反而会导致反应速率的降低,因为物的化学势降低了。
压力对化学势的影响。