七年级科学浓酸的强腐蚀性
- 格式:ppt
- 大小:178.00 KB
- 文档页数:14



浓硫酸的结构与性质浓硫酸(H2SO4)是一种无色、无味、具有强烈腐蚀性的液体。
它是常用的无机酸之一,广泛应用于化工、电子、制药等各个领域。
1.结构:浓硫酸的分子式为H2SO4,它的分子量为98.09 g/mol。
硫酸分子由两个氢原子、一个硫原子和四个氧原子组成。
硫原子位于中心,四个氧原子和硫原子之间通过共价键连接。
硫酸分子具有分子镜面对称性。
2.物理性质:浓硫酸是一种无色、黄色或棕色的液体。
它的密度为1.84 g/cm³,熔点为10.31°C,沸点为337°C。
浓硫酸可以在常温下迅速吸湿,因此有时会被用作脱水剂。
浓硫酸具有很高的粘度,是一种黏稠的液体。
3.化学性质:浓硫酸具有很强的腐蚀性,可以与多种物质发生化学反应。
下面是一些浓硫酸的典型化学性质:(1)酸性:浓硫酸是一种强酸,它可以与碱反应生成盐和水。
例如,与氢氧化钠反应生成硫酸钠和水:H2SO4+2NaOH→Na2SO4+2H2O(2)氧化性:浓硫酸是一种强氧化剂,在高温下可以与金属反应,产生二氧化硫气体和相应的金属离子。
例如,浓硫酸可以与铜反应生成二氧化硫气体和硫酸铜:H2SO4+Cu→SO2+CuSO4+H2O(3)脱水性:浓硫酸是一种强烈的脱水剂,可以与水反应生成大量的热量,并形成硫酸:H2SO4+H2O→H2SO4这个反应也是硫酸具有强腐蚀性的原因之一4.安全注意事项:浓硫酸是一种具有强腐蚀性的化学物质,必须小心操作。
(1)佩戴化学防护手套、护目镜和防护工作服,确保安全操作。
(2)避免与皮肤接触,一旦接触到皮肤,立即用大量水冲洗。
(3)浓硫酸应储存在密闭容器中,远离易燃、易爆物品。
(4)在使用浓硫酸时要保持通风良好的工作环境,避免吸入其蒸气。
(5)避免与其他化学物质混合使用,以免引发危险反应。
总结起来,浓硫酸是一种无色、无味的液体,具有腐蚀性、氧化性和脱水性。
它在许多工业和实验室的应用中发挥着重要作用,但同时也需要小心操作,确保安全环境。


酸、碱溶液的腐蚀性【学习目标】1.认识稀盐酸对金属、大理石的腐蚀性。
2.认识浓氢氧化钠溶液具有腐蚀性。
【学习重点】认识一些酸、碱溶液的腐蚀性。
【学习难点】描述稀盐酸与金属的反应。
【学习准备】【器材】活动一:试管、试管夹及试管架、锌粒、镊子、稀盐酸、木条、酒精灯、镁条、铜片、铁片。
活动二:大理石颗粒、试管、镊子、稀盐酸、澄清石灰水、单孔橡皮塞、导管。
活动三:表面皿、白卡片、浓硫酸、安全眼镜、布条、猪肉。
活动四:试管、试管夹、浓氢氧化钠溶液、全羊毛绒线、玻璃棒、酒精灯、烧杯、叶片、镊子、三脚架、石棉网。
【学习过程】活动一:稀盐酸和金属反应活动目标:1.通过实验,培养学生实验中仔细观察、认真比较、及时记录的好习惯。
2.能够描述稀盐酸与金属的反应。
3.通过拓展讨论部分,让学生了解科学与生活的关系。
实验:在放有锌粒的试管内注入稀盐酸,观察有何现象产生并进行描述。
思考:气泡的出现意味着气体的产生,那么这些气体又是何种气体呢?通过检验,得出该产生的气体是氢气。
实验:分别以镁、铜、铁代替锌,重复上面的实验。
实验现象:。
活动二:稀盐酸与碳酸钙的反应活动目标:1.通过实验了解稀盐酸与大理石的反应。
2.运用所学解释大理石雕刻的腐蚀问题。
3.实验:在放有大理石颗粒的试管中加入稀盐酸,观察有何现象产生并进行描述。
思考:气泡的出现意味着气体的产生,那么这些产生的气体又是何种气体呢?通过检验,得出该产生的气体是二氧化碳。
对实验现象进行分析,得出结论:。
活动三:浓的氢氧化钠溶液的腐蚀性活动目标:通过观察实验,了解浓氢氧化钠溶液具有腐蚀性。
把一段全羊毛绒线放在盛有浓氢氧化钠溶液的试管中,并煮沸溶液。
观察并记录绒线的变化。
交流:通过实验,对碱溶液产生了什么认识?。
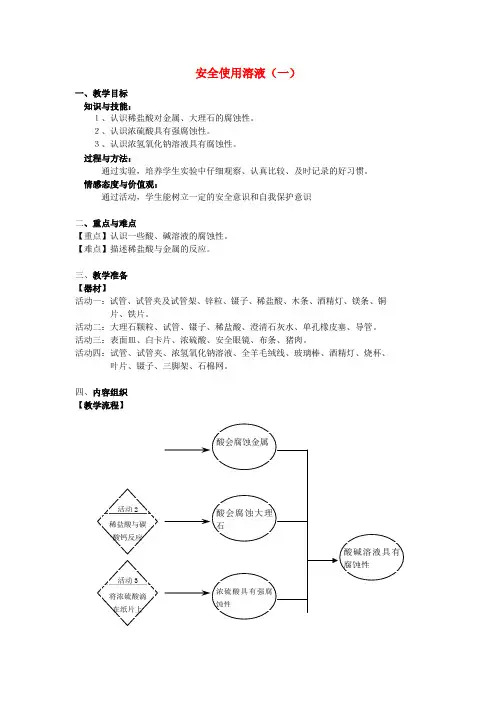
安全使用溶液(一)
一、教学目标
知识与技能:
1、认识稀盐酸对金属、大理石的腐蚀性。
2、认识浓硫酸具有强腐蚀性。
3、认识浓氢氧化钠溶液具有腐蚀性。
过程与方法:
通过实验,培养学生实验中仔细观察、认真比较、及时记录的好习惯。
情感态度与价值观:
通过活动,学生能树立一定的安全意识和自我保护意识
二、重点与难点
【重点】认识一些酸、碱溶液的腐蚀性。
【难点】描述稀盐酸与金属的反应。
三、教学准备
【器材】
活动一:试管、试管夹及试管架、锌粒、镊子、稀盐酸、木条、酒精灯、镁条、铜片、铁片。
活动二:大理石颗粒、试管、镊子、稀盐酸、澄清石灰水、单孔橡皮塞、导管。
活动三:表面皿、白卡片、浓硫酸、安全眼镜、布条、猪肉。
活动四:试管、试管夹、浓氢氧化钠溶液、全羊毛绒线、玻璃棒、酒精灯、烧杯、叶片、镊子、三脚架、石棉网。
四、内容组织
【教学流程】
【活动设计】
活动一:稀盐酸和金属反应
活动目标:
1、通过实验,培养学生实验中仔细观察、认真比较、及时记录的好习惯。
2、能够描述稀盐酸与金属的反应。
活动二:稀盐酸与碳酸钙的反应
活动目标:
1、通过实验了解稀盐酸与大理石的反应。
2、运用所学解释大理石雕刻的腐蚀问题。
活动三:浓硫酸的强腐蚀性
活动目标:
1、通过观察实验,了解浓硫酸具有强腐蚀性。
活动四:浓的氢氧化钠溶液的腐蚀性
活动目标:。

硫酸浓度与腐蚀的关系硫酸是一种常见的强酸,具有强烈的腐蚀性。
硫酸浓度与腐蚀的关系是一个重要的研究领域,对于工业生产和实验室安全具有重要意义。
本文将从硫酸浓度的角度探讨硫酸的腐蚀性,并分析其原因和影响。
我们需要了解什么是腐蚀。
腐蚀是指金属或其他材料与其周围环境发生化学反应,导致材料表面的破坏和失效。
硫酸作为一种强酸,具有强氧化性和腐蚀性,可与许多金属和非金属物质发生反应。
在浓硫酸中,腐蚀作用更为明显。
浓硫酸具有更高的酸浓度,其分子中含有更多的游离氢离子,因此与物质发生反应的可能性更大。
浓硫酸的腐蚀作用主要通过两种方式进行:氧化和质子化反应。
首先是氧化反应。
浓硫酸中的游离氢离子可以与金属表面的电子发生反应,使金属离子化。
同时,硫酸中的氧气也可以与金属表面发生反应,形成氧化物。
这些氧化物会进一步与硫酸反应,形成可溶性的金属硫酸盐,并释放出电子。
这样的反应会导致金属表面的腐蚀和损坏。
其次是质子化反应。
浓硫酸中的游离氢离子可以与物质中的氧、氢等原子发生反应,形成氧化物、水等产物。
这些质子化反应会导致物质的结构破坏和性质改变,从而引起腐蚀现象。
硫酸浓度对腐蚀性的影响是显而易见的。
随着硫酸浓度的增加,酸的强度增强,腐蚀作用也会增加。
浓硫酸中的游离氢离子浓度增加,与物质反应的速率增加,腐蚀作用加剧。
此外,浓硫酸中的氧气也会增加,加速腐蚀反应的进行。
然而,硫酸浓度对腐蚀性的影响也存在一定的限制。
当硫酸浓度过高时,硫酸分子之间的相互作用将增强,形成硫酸分子的聚集和结晶。
这种结晶现象会形成硫酸的浓度梯度,使得浓硫酸在表面形成保护膜,阻止了进一步的腐蚀反应。
因此,硫酸浓度对腐蚀性的影响存在一个最佳范围。
除了硫酸浓度,其他因素也会影响硫酸的腐蚀性。
温度是一个重要的因素,高温下硫酸的腐蚀性更强。
硫酸浓度与腐蚀的关系是一个复杂而重要的研究领域。
硫酸作为一种强酸,具有强烈的腐蚀性,其腐蚀作用主要通过氧化和质子化反应进行。
硫酸浓度的增加会导致酸的强度增强,加速腐蚀作用的进行。


浓酸与稀硫酸的区别与用途浓酸与稀硫酸是化学领域中常见的两种酸性物质。
它们在不同的浓度下具有不同的性质和应用。
以下将详细介绍浓酸与稀硫酸的区别和用途。
一、浓酸与稀硫酸的区别:1.浓度不同:浓酸是指酸的溶液中酸的质量分数较高,通常超过50%;而稀硫酸是指酸的溶液中酸的质量分数较低,一般在1%-10%之间。
2.腐蚀性不同:浓酸具有强腐蚀性,能与多种物质反应,并导致剧烈的化学反应;稀硫酸的腐蚀性较弱,更安全。
3.稳定性不同:浓酸相对不稳定,易于分解和挥发;稀硫酸在常温下相对稳定。
4.熔点和沸点不同:一般来说,浓酸的熔点和沸点较高,稀硫酸的熔点和沸点较低。
5.物理性质差异:浓酸呈浓稠的液体,带有蒸汽,具有特殊的刺激性气味;稀硫酸呈无色透明的液体,几乎无味。
二、浓酸与稀硫酸的用途:1.浓酸的用途:浓酸由于具有强腐蚀性和高活性,常用于以下领域:(1)化学实验:浓酸可以作为试剂用于化学实验室中的各种实验,如酸碱中和反应、金属的溶解试验等。
(2)电镀工业:浓酸常用于金属的电镀工艺,可以通过溶解底物表面的氧化层、清除杂质等。
(3)清洁剂和阻燃剂:浓酸具有强腐蚀性,可用作清洗剂清除铁锈、水垢等,还可以用于生产阻燃材料。
(4)有机合成:浓酸在有机合成中有重要作用,如硝化反应、氧化反应等。
(5)矿物冶炼:浓酸被用于提取金属矿石中的有用成分,如硫酸法提取钛铁矿等。
2.稀硫酸的用途:稀硫酸由于其较弱的腐蚀性和良好的稳定性,广泛应用于以下领域:(1)化学实验:稀硫酸常用于化学实验室中,特别是用于非金属元素和一些不易溶于其他酸的物质的溶解。
(2)工业生产:稀硫酸在化工、纸浆、制药和肥料等工业中扮演重要角色,如用于纸浆和纸张的脱墨、裂解木质纤维等。
(3)电池制造:稀硫酸是常用的电池电解液,如铅酸电池和镍镉电池等。
(4)医学和医药:稀硫酸可用于制备药物和化妆品,如用于制备硫酸麦素和染色剂等。
(5)水处理:稀硫酸可用于水处理,如去除水中的铁、锰等杂质。

酸碱溶液的腐蚀性
一、背景与任务分析
本节课是《科学》(牛津上海版)第一册第八章“身边的溶液”第八节“酸碱溶液的腐蚀性”中的第一课时。
通过前七节课的学习,学生已经知道按照酸碱性可以将溶液分为三类,学会了使用pH试纸测定溶液的酸碱性,并能根据pH大小判定溶液的酸碱度。
“酸碱溶液的腐蚀性”是本节课的教学重点,教师要带领学生通过“稀酸与金属的反应”和“酸对建材的腐蚀作用”两个活动,从本质上认识酸雨对环境的危害,加强环境保护意识。
二、教学目标
知识和技能:
①知道稀酸与金属的反应;
②知道酸的腐蚀性;
③知道酸对建材的腐蚀作用;
④掌握稀酸与碳酸钙进行反应的基本操作。
过程、方法和能力:
①体会对未知气体(金属与稀酸反应)的猜测和验证方法;
②通过观察稀酸与金属反应的现象,培养学生归纳能力与继续发现问题的能力;
③利用酸的腐蚀性解决日常生活中的问题;
④利用不同的途径寻找相关资源,对资源进行有效的筛选。
态度与价值观:认真对待科学猜测;
三、教学重点与难点
【重点】①稀酸与金属的反应
②酸对建材的腐蚀作用。
【难点】①稀酸与金属的反应。
②稀酸与碳酸钙进行反应的操作。
四、教学类型
新知识传授课。

浓硫酸腐蚀裕度全文共四篇示例,供读者参考第一篇示例:浓硫酸是一种极具腐蚀性的化学物质,其蚀削性较强,能够腐蚀许多金属和非金属材料。
在工业生产中,浓硫酸的应用非常广泛,但同时也带来了一定的安全隐患。
对于浓硫酸的腐蚀性进行裕度评估,对工业生产中的安全管理至关重要。
浓硫酸的腐蚀裕度是指在一定条件下,材料能够抵抗浓硫酸侵蚀的能力。
浓硫酸的腐蚀性主要体现在其强酸性和氧化性上,它能够侵蚀金属表面,造成材料的损伤和腐蚀。
在选择材料时,要考虑其在浓硫酸环境中的腐蚀裕度,选择具有良好耐蚀性能的材料。
对于浓硫酸的腐蚀性进行裕度评估时,首先要考虑浓度的影响。
浓硫酸的浓度越高,其腐蚀性就越强。
一般来说,浓硫酸的腐蚀性可分为浓度大于85%的浓硫酸和浓度小于85%的浓硫酸。
在工业生产中,常用的浓硫酸浓度为98%左右,因此对于浓硫酸98%的腐蚀裕度评估更为重要。
要考虑温度的影响。
浓硫酸在高温下的腐蚀性更强,能够加速材料的腐蚀速度。
在进行浓硫酸腐蚀裕度评估时,必须考虑材料在高温下的稳定性和耐蚀性。
还要考虑浓硫酸的腐蚀形式。
浓硫酸对金属和非金属材料的腐蚀方式有所不同。
对于金属材料,浓硫酸主要通过腐蚀和氧化的方式侵蚀金属表面;对于非金属材料,还会对其物理性能产生影响,使其变形或损坏。
在工业生产中,为了提高材料的耐蚀性能,通常采取以下措施:选择具有良好耐蚀性能的材料;进行材料的表面处理,如镀层、喷涂等;采用防腐涂层,增加材料的耐蚀性能。
第二篇示例:浓硫酸是一种具有强腐蚀性的化学物质,其对各种材料都具有很强的腐蚀作用。
在实际生产和工程应用过程中,有时会遇到浓硫酸腐蚀的问题,因此需要了解材料的浓硫酸腐蚀裕度,以选择合适的材料来抵抗浓硫酸的腐蚀。
浓硫酸是一种常见的化工原料,广泛应用于磷化工、有机合成、石油化工等领域。
由于浓硫酸本身性质极其侵蚀,因此需要在工业生产和实验室中小心操作,以避免造成人身伤害和设备损坏。
浓硫酸的腐蚀性取决于多种因素,包括浓度、温度、接触时间、材料的成分和结构等。
初中化学强腐蚀性物质教案主题:强腐蚀性物质年级:初中课时:1课时教学目标:1.了解强腐蚀性物质的定义及特点。
2.学习正确使用强腐蚀性物质的方法。
3.掌握强腐蚀性物质对人体和环境的危害。
教学内容:1.什么是强腐蚀性物质?2.强腐蚀性物质的常见种类。
3.使用强腐蚀性物质的注意事项。
4.强腐蚀性物质对人体和环境的危害。
教学过程:一、导入(5分钟)教师引导学生回顾上一课时学到的化学知识,引出本节课的主题——强腐蚀性物质。
二、讲解强腐蚀性物质(10分钟)1.通过PPT或实物展示,向学生介绍强腐蚀性物质的定义和特点。
2.列举一些常见的强腐蚀性物质,如硫酸、氢氟酸等。
三、使用方法(10分钟)1.讲解正确使用强腐蚀性物质的方法,包括佩戴防护装备、小心操作、及时清洁等。
2.举例说明在实验室或日常生活中如何正确使用强腐蚀性物质。
四、危害及应急措施(15分钟)1.讲解强腐蚀性物质对人体和环境的危害,包括皮肤灼伤、眼睛损伤等。
2.介绍遇到强腐蚀性物质意外时的应急措施,如立即用清水冲洗受伤处等。
五、小结(5分钟)教师帮助学生总结本节课的重点内容,强调正确使用强腐蚀性物质的重要性。
六、作业(5分钟)布置作业:请学生整理一份强腐蚀性物质的安全使用手册,包括定义、常见种类、使用方法和应急措施等。
教学反思:本节课主要围绕强腐蚀性物质展开教学,通过理论讲解和实例说明,帮助学生了解强腐蚀性物质的特点、正确使用方法以及危害及应急措施。
同时,通过作业巩固学生对知识的理解和应用,提高他们对强腐蚀性物质的安全意识和应对能力。