《吸收解吸》PPT课件
- 格式:ppt
- 大小:475.50 KB
- 文档页数:32
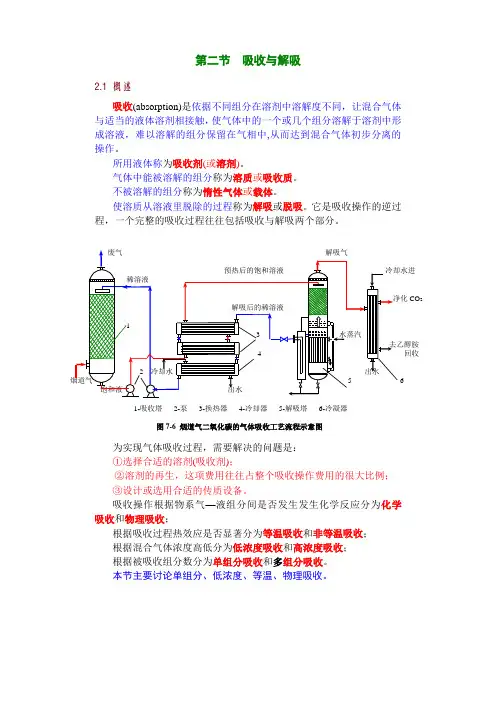
第二节吸收与解吸2.1 概述吸收(absorption)是依据不同组分在溶剂中溶解度不同,让混合气体与适当的液体溶剂相接触,使气体中的一个或几个组分溶解于溶剂中形成溶液,难以溶解的组分保留在气相中,从而达到混合气体初步分离的操作。
所用液体称为吸收剂(或溶剂)。
气体中能被溶解的组分称为溶质或吸收质。
不被溶解的组分称为惰性气体或载体。
使溶质从溶液里脱除的过程称为解吸或脱吸。
它是吸收操作的逆过程,一个完整的吸收过程往往包括吸收与解吸两个部分。
为实现气体吸收过程,需要解决的问题是:①选择合适的溶剂(吸收剂);②溶剂的再生,这项费用往往占整个吸收操作费用的很大比例;③设计或选用合适的传质设备。
吸收操作根据物系气—液组分间是否发生发生化学反应分为化学吸收和物理吸收;根据吸收过程热效应是否显著分为等温吸收和非等温吸收;根据混合气体浓度高低分为低浓度吸收和高浓度吸收;根据被吸收组分数分为单组分吸收和多组分吸收。
本节主要讨论单组分、低浓度、等温、物理吸收。
2.2 气液相平衡2.2.1 气体在液体中的溶解度在恒定温度和压力下气液两相接触时将发生溶质气体向液相转移,使其在液相中的浓度增加,当充分接触,两相达到相平衡。
此时,溶质在液相中的浓度称为平衡溶解度,简称溶解度;溶解度随温度和溶质气体的分压而不同,平衡时溶质在气相中的分压称为平衡分压。
平衡分压p ﹡与溶解度间的关系曲线,这些曲线称为溶解度曲线。
加。
故加压和降温有利于吸收操作。
反之,升温和减压则有利于解吸过程。
2.2.2 亨利定律亨利定律:当总压不太高(一般约小于500kPa)时,在一定温度下,稀溶液(或理想溶液)上方气相中溶质的平衡分压与液相中溶质的摩尔分数成正比。
Ex p A =*式中——*A p 溶质A 在气相中的平衡分压,kPa ;x ——液相中溶质的摩尔分数;E ——称为亨利系数,kPa 。
采用其他的气、液相组成时,亨利定律有如下几种表达形式:(1)气相组成用溶质A 的分压*A p ,液相组成用溶质的浓度c A 表示时,亨利定律可表示为Hc p A A =*式中c A ——液相中溶质的浓度kmol/m 3;H ——溶解度系数,kmol/(m 3﹒kPa)。

一、实训目的1.认识吸收解吸设备结构2.认识吸收解吸装置流程及仪表3.掌握吸收解吸装置的运行操作技能4.学会常见异常现象的判别及处理方法二、吸收与解吸实训装置功能:1开车前准备和正常开停车实训任务1.1工艺文件准备能识记吸收、解吸生产过程工艺文件(能识读吸收岗位的工艺流程图、实训设备示意图、实训设备的平面和立面布置图,能绘制工艺配管简图,能识读仪表联锁图。
熟悉吸收塔、解吸塔、填料及附属设备等主要设备的结构和布置)。
1.1.1吸收与解吸基本原理气体吸收是典型的化工单元操作过程,其原理是根据气体混合物中各组分在选定液体吸收剂中物理溶解度或化学反应活性的不同而实现气体组分分离的传质单元操作。
前者称物理吸收,后者称化学吸收。
吸收操作所用的液体溶剂称为吸收剂,以S表示;混合气体中,能够显著溶解于吸收剂的组分称为吸收物质或溶质,以A表示;而几乎不被溶解的组分统称为惰性组分或载体,以B表示。
吸收操作所得的溶液称为吸收液或溶液,它是溶质A在溶剂S中的溶液;被吸收后排除出的气体称为吸收尾气,其主要成分为惰性气体B,但仍含有少量未被吸收的溶质A。
吸收操作在石油化工、天然气化工以及环境工程中有极其广泛的应用,按工程目的可归纳为:①净化原料气或精制气体产品;②分离气体混合物以获得需要的目的组分;③制取气体溶液作为产品或中间产品;④治理有害气体的污染、保护环境。
与吸收相反的过程,即溶质从液相中分离出来而转移到气相的过程(用惰性气体吹扫溶液或将溶液加热或将其送入减压容器中使溶质放出),称为解吸或提馏。
吸收与解吸的区别仅仅是过程中物质传递的方向相反,它们所依据的原理一样。
⑴. 气体在液体中的溶解度,即气-液平衡关系在一定条件(系统的温度和总压力)下,混合气中某溶质组分的分压若一定,则与之密切接触而达到平衡的溶液中,该溶质的浓度也为一定,反之亦然。
对气相中的溶质来说,液相中的浓度是它的溶解度;对液相中的溶质来说,气相分压是它的平衡蒸汽压。

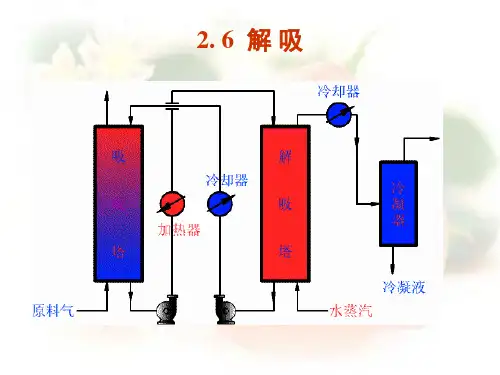

---------------------------------------------------------------最新资料推荐------------------------------------------------------1 / 10化工原理下册课件第二篇 章 吸收第6次课解吸及其他条件下的吸收2. 6 解 吸 2. 6 解 吸 一、概述 1 、作用: ① ① 吸收剂的再生,以便循环使用; ② 回收溶质,得到分离后气体。
2 、解吸常用的方法:压力低,温度高,有利于脱吸 加热溶液(加热解吸) ,增大溶液中溶质的 平衡分压 用水蒸汽(气提) ,加热、降低气相中溶质的 分压 ;适用于溶质为不凝性气体,或溶质冷凝液不溶于水 通惰性气体(惰性气体气提) ,降低操作压力,主要用于吸收剂的再生,不能直接得到纯净的溶质组分。
Y=mX B A X 1 X 2 Y 2 * Y 2 Y 1 1、 、 物料衡算:-=-=二 、解吸塔的计算 解吸过程的操作线总是在平衡线的下方, 解吸过程的推动力是吸收的相反值。
2 、操作线方程:3 、最小气液比:4 、填料层高度的求法:Z=H OG N OG =H OL N OL ((1 )对数平均推动力法((2 )吸收因数法:-=AY YY YAANOL *1 1*2 1) 1 ( ln11-=2.7 强化吸收过程的途径从从可以看出,影响吸收的主要因素: K Y 、吸收推动力和相接触面积。
吸收过程的主要阻力集中在滞流膜上。
要提高吸收总系数, 必须设法降低气膜和液膜的厚度。
通过加大流体的流动速度,增加流体的湍动程度,则可减小滞流膜层的厚度。
一、提高吸收总系数K Y ( 或K G ) 或K X ( 或K L ) 三、增大单位吸收传质面积面积主要由设备来决定,对于填料塔,应该注意:填料的选型,应尽量选比表面积大的填料。
增大气液分散度,液体喷淋均匀,填料充分润湿,保证上升气泡和液层充分接触,达到传质目的。


一、实训目的1.认识吸收解吸设备结构2.认识吸收解吸装置流程及仪表3.掌握吸收解吸装置的运行操作技能4.学会常见异常现象的判别及处理方法二、吸收与解吸实训装置功能:1开车前准备和正常开停车实训任务1.1工艺文件准备能识记吸收、解吸生产过程工艺文件(能识读吸收岗位的工艺流程图、实训设备示意图、实训设备的平面和立面布置图,能绘制工艺配管简图,能识读仪表联锁图。
熟悉吸收塔、解吸塔、填料及附属设备等主要设备的结构和布置)。
1.1.1吸收与解吸基本原理气体吸收是典型的化工单元操作过程,其原理是根据气体混合物中各组分在选定液体吸收剂中物理溶解度或化学反应活性的不同而实现气体组分分离的传质单元操作。
前者称物理吸收,后者称化学吸收。
吸收操作所用的液体溶剂称为吸收剂,以S表示;混合气体中,能够显著溶解于吸收剂的组分称为吸收物质或溶质,以A表示;而几乎不被溶解的组分统称为惰性组分或载体,以B表示。
吸收操作所得的溶液称为吸收液或溶液,它是溶质A在溶剂S中的溶液;被吸收后排除出的气体称为吸收尾气,其主要成分为惰性气体B,但仍含有少量未被吸收的溶质A。
吸收操作在石油化工、天然气化工以及环境工程中有极其广泛的应用,按工程目的可归纳为:①净化原料气或精制气体产品;②分离气体混合物以获得需要的目的组分;③制取气体溶液作为产品或中间产品;④治理有害气体的污染、保护环境。
与吸收相反的过程,即溶质从液相中分离出来而转移到气相的过程(用惰性气体吹扫溶液或将溶液加热或将其送入减压容器中使溶质放出),称为解吸或提馏。
吸收与解吸的区别仅仅是过程中物质传递的方向相反,它们所依据的原理一样。
⑴. 气体在液体中的溶解度,即气-液平衡关系在一定条件(系统的温度和总压力)下,混合气中某溶质组分的分压若一定,则与之密切接触而达到平衡的溶液中,该溶质的浓度也为一定,反之亦然。
对气相中的溶质来说,液相中的浓度是它的溶解度;对液相中的溶质来说,气相分压是它的平衡蒸汽压。




第二节吸收与解吸2.1 概述吸收(absorption)是依据不同组分在溶剂中溶解度不同,让混合气体与适当的液体溶剂相接触,使气体中的一个或几个组分溶解于溶剂中形成溶液,难以溶解的组分保留在气相中,从而达到混合气体初步分离的操作。
所用液体称为吸收剂(或溶剂)。
气体中能被溶解的组分称为溶质或吸收质。
不被溶解的组分称为惰性气体或载体。
使溶质从溶液里脱除的过程称为解吸或脱吸。
它是吸收操作的逆过程,一个完整的吸收过程往往包括吸收与解吸两个部分。
为实现气体吸收过程,需要解决的问题是:①选择合适的溶剂(吸收剂);②溶剂的再生,这项费用往往占整个吸收操作费用的很大比例;③设计或选用合适的传质设备。
吸收操作根据物系气—液组分间是否发生发生化学反应分为化学吸收和物理吸收;根据吸收过程热效应是否显著分为等温吸收和非等温吸收;根据混合气体浓度高低分为低浓度吸收和高浓度吸收;根据被吸收组分数分为单组分吸收和多组分吸收。
本节主要讨论单组分、低浓度、等温、物理吸收。
2.2 气液相平衡2.2.1 气体在液体中的溶解度在恒定温度和压力下气液两相接触时将发生溶质气体向液相转移,使其在液相中的浓度增加,当充分接触,两相达到相平衡。
此时,溶质在液相中的浓度称为平衡溶解度,简称溶解度;溶解度随温度和溶质气体的分压而不同,平衡时溶质在气相中的分压称为平衡分压。
平衡分压p ﹡与溶解度间的关系曲线,这些曲线称为溶解度曲线。
加。
故加压和降温有利于吸收操作。
反之,升温和减压则有利于解吸过程。
2.2.2 亨利定律亨利定律:当总压不太高(一般约小于500kPa)时,在一定温度下,稀溶液(或理想溶液)上方气相中溶质的平衡分压与液相中溶质的摩尔分数成正比。
Ex p A =*式中——*A p 溶质A 在气相中的平衡分压,kPa ;x ——液相中溶质的摩尔分数;E ——称为亨利系数,kPa 。
采用其他的气、液相组成时,亨利定律有如下几种表达形式:(1)气相组成用溶质A 的分压*A p ,液相组成用溶质的浓度c A 表示时,亨利定律可表示为Hc p A A =*式中c A ——液相中溶质的浓度kmol/m 3;H ——溶解度系数,kmol/(m 3﹒kPa)。
吸收解吸的基本原理嘿,朋友们!今天咱来唠唠吸收解吸的基本原理,这可真是个有意思的事儿呢!咱就说吸收吧,你可以把它想象成一个大胃王在疯狂“吃”东西。
那些要被吸收的物质就像是各种美味食物,而吸收剂呢,就像是大胃王的嘴巴和肚子。
吸收剂有个神奇的能力,能把那些需要的物质紧紧抓住,不让它们跑掉。
这不就跟咱吃饭吸收营养一个道理嘛!比如说,空气中有某种我们想要的气体,那我们就找个合适的吸收剂,让它把那气体给“逮住”。
那解吸呢,就像是大胃王把吃进去的东西又给吐出来。
为啥要吐出来呀?因为这些东西可能还有别的用处呀!也许我们之前吸收是为了把它们从一个地方弄到另一个地方,或者是为了提纯啥的。
这解吸的过程也不简单呢,得找到合适的条件,让吸收剂乖乖地把之前抓住的东西放出来。
你想想看,吸收和解吸就像是一场你来我往的游戏。
吸收剂是游戏的主角,它一会儿要把东西吸进来,一会儿又要把东西放出去。
而且这个游戏还得玩得恰到好处,不能吸得太多或者太少,也不能解吸得太随便或者太难。
比如说在工业生产中,我们经常要用吸收解吸来处理各种气体。
如果吸收得不好,那可能就达不到我们想要的效果,产品质量就会受影响。
要是解吸不顺利,那可能就会浪费很多资源,成本就上去了。
这可不行呀,咱得把这个游戏玩好,才能让一切都顺顺利利的。
吸收解吸的应用那可多了去了。
像化工行业,经常要分离和提纯各种物质,吸收解吸就是个很棒的手段。
还有环保领域,吸收空气中的有害气体,再解吸出来进行处理,多重要啊!这不就是在保护我们的环境嘛!再想想我们的日常生活,其实也有类似的情况呢。
就好比你收拾房间,把乱七八糟的东西都归置到一块儿,这就有点像吸收。
然后等你要用的时候,再从那一块儿找出来,这不就是解吸嘛!哈哈,是不是挺有意思的?总之啊,吸收解吸的基本原理虽然看起来有点复杂,但只要我们好好去理解,就会发现它其实就在我们身边,而且非常有用呢!它能让我们的生活变得更美好,让我们的工业生产更高效,让我们的环境更干净。