氢键的类型和本质
- 格式:pdf
- 大小:216.13 KB
- 文档页数:5


常见的氢键1. 静电氢键:静电氢键是由于氢原子与带正电荷的氮、氧等原子之间的相互作用而形成的。
这种氢键的形成依赖于原子间的静电相互作用。
2. 氢氧氢键:氢氧氢键是指水分子中两个氢原子与一个氧原子之间的作用力。
氧原子带负电荷,而氢原子带正电荷,因此氢原子与氧原子之间存在吸引力,形成氢氧氢键。
3. 氢氟氢键:氢氟氢键是指氢原子与氟原子之间的相互作用力。
氟原子电负性很高,可以吸引氢原子的电子云,形成氢氟氢键。
4. 氢键交替:氢键交替是指由相邻的分子之间的氢键形成的一种特殊排列方式。
分子之间的氢键交替排列可以增强分子间的稳定性。
5. 线性氢键:线性氢键是一种通过共享单个氢原子的两个分子之间形成的氢键。
这种氢键通常具有较长的键长和较低的键能。
6. 混合氢键:混合氢键是指在一个分子中形成的两个或多个氢键之间存在交互作用的一种情况。
这种氢键的形成通常涉及多个氢原子和多个电负性较高的原子之间的相互作用。
7. π-π氢键:π-π氢键是一种通过共享π电子云而形成的氢键。
这种氢键形成在共轭体系中的π轨道上,并且对于分子的稳定性和相互作用具有重要影响。
8. 碳氢氧键:碳氢氧键是指在有机化合物中碳原子与氢原子和氧原子之间的相互作用力。
这种氢键可以在碳和氧之间形成共轭结构,从而影响分子的稳定性和反应性。
9. 硫氢氢键:硫氢氢键是指硫原子与两个氢原子之间的相互作用力。
这种氢键在含有硫的化合物中很常见,对分子的空间构型和稳定性具有重要影响。
10. 氢氮氢键:氢氮氢键是指氢原子与氮原子之间的相互作用力。
这种氢键在含有氮的化合物中经常出现,对分子的稳定性和反应性具有重要影响。
氢键在基础有机化学中,曾经利用氢键解释醇和其它一些化合物的沸点及其在水中的溶解度等获得了很大成功。
然而氢键的存在并不仅仅表现在这两方面,而且也不只局限在醇和酚等几类化合物中。
事实上,氢键既存在于液体中,也存在于气体、晶体、溶液等各种状态中,且支配着化合物的各种性质。
与一般共价键相比,氢键的键能比较小,键长比较长,是一中弱键,但对许多化合物各种性质的影响,有时非常显著。
例如,羟基化合物(如乙醇)多数比其非羟基异构体(如甲醚)的沸点高很多(乙醇的沸点比甲醇约高101.5℃),原因是羟基化合物能形成氢键。
为了更好地了解氢键对众多有机化合物各种性质的影响,有必要回顾一下氢键的本质及有关问题。
现简述如下。
一、氢键的生成氢键的生成,主要是由偶极子与偶极之间的静电吸引作用。
当氢原子与电负性甚强的原子(如A)结合时,因极化效应,其键间的电荷分布不均,氢原子变成近乎氢正离子状态。
此时再与另一电负性甚强的原子(如B)相遇时,即发生静电吸引。
因此结合可视为以H离子为桥梁而形成的,故称为氢键。
如下式中虚线所示。
A─H---B其中A、B是氧、氮或氟等电负性大且原子半径比较小的原子。
生成氢键时,给出氢原子的A—H基叫做氢给予基,与氢原子配位的电负性较大的原子B或基叫氢接受基,具有氢给予基的分子叫氢给予体。
把氢键看作是由B给出电子向H配对,电子给予体B是氢接受体,电子接受体A─H是氢给予体。
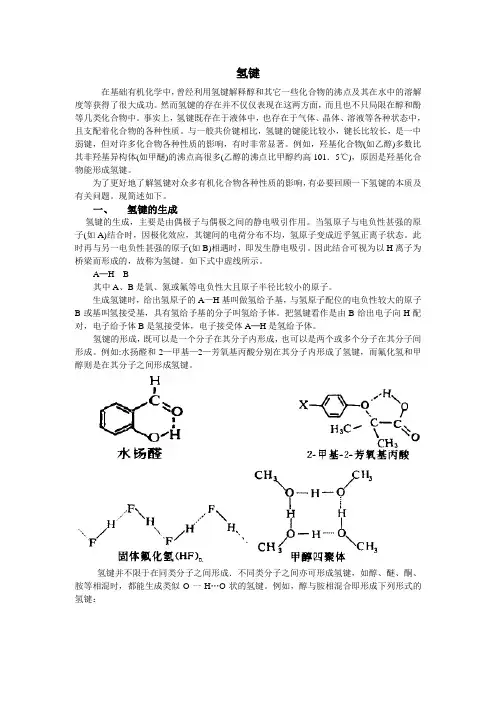
氢键的形成,既可以是一个分子在其分子内形成,也可以是两个或多个分子在其分子间形成。
例如:水扬醛和2—甲基—2—芳氧基丙酸分别在其分子内形成了氢键,而氟化氢和甲醇则是在其分子之间形成氢键。
氢键并不限于在同类分子之间形成.不同类分子之间亦可形成氢键,如醇、醚、酮、胺等相混时,都能生成类似O一H…O状的氢键。
例如,醇与胺相混合即形成下列形式的氢键:RR—O—H…N—R一般认为,在氢键A—H…B中,A—H键基本上是共价键,而H…B键则是一种较弱的有方向性的范德华引力。

氢键知识点归纳
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。
如水分子问的氢键如下图所示。
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。
分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。
例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。
再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。
水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存。

可燃冰笼形分子氢键理论说明以及概述1. 引言1.1 概述可燃冰是一种富含天然气或甲烷的冰晶,具有高能源含量和广泛的应用前景。
笼形分子是可燃冰中重要的组成部分,其通过氢键在结构中起到稳定分子排列和储存气体的作用。
本文将探讨可燃冰中笼形分子氢键的理论模型及其作用机制,并对这一领域未来的研究方向和应用前景进行展望。
1.2 文章结构本文将按照以下结构进行讨论:2. 笼形分子的概念与特点:介绍可燃冰和笼形分子的基本概念,分类以及特点。
3. 氢键的基本知识:解释氢键的定义、特点以及在化学反应中的重要性。
4. 可燃冰中的笼形分子氢键理论模型及机制解析:详细阐述可燃冰中笼形分子的结构与组成分析,建立笼形分子氢键理论模型的方法与原理,并解释笼形分子氢键在可燃冰稳定性及储存释放过程中起到的作用机制。
5. 结论和展望:总结本文的主要发现,并对未来在可燃冰中笼形分子氢键领域的研究方向和应用前景进行展望。
1.3 目的本文旨在理论上阐述可燃冰中笼形分子氢键的基本概念和特点,深入探讨其在可燃冰稳定性及储存释放中的作用机制。
通过对该领域的深入研究,为进一步开发利用可燃冰提供理论依据,并为相关领域的科学家和工程师提供参考和指导。
此外,本文还将展望未来在可燃冰中笼形分子氢键领域可能的发展方向和应用前景,以促进该领域技术不断创新和进步。
2. 笼形分子的概念与特点2.1 可燃冰简介可燃冰是一种特殊的天然资源,在寒冷的海底或极地地区形成,并存在于深海沉积物和孔隙岩中。
它主要由水和天然气(甲烷)组成,以冰的形式储存。
可燃冰具有丰富的能源潜力,并且被认为是未来能源开发的重要方向。
2.2 笼形分子的定义与分类笼形分子是指在化学结构中具有空腔或空穴的分子。
这些空腔可以容纳其他小分子或原子,形成所谓的“笼”。
根据笼型空间和结构特征,笼形分子可以进一步分类为不同类型,如正十二面体、正二十面体、立方体等。
2.3 笼形分子的特点与应用笼形分子具有许多独特的特点和性质,使其在科学研究和技术应用中具有广泛的用途。

一、氢键1、概念:一种特殊的分子间作用力2、形成条件:①与电负性大且半径小的原子(F、O、N)相连的 H;②在附近有电负性大, 半径小的原子(F、O、N) 3、表示方法:X—H... Y—。
氢键氢键是一种静电作用,是除范德华力外的另一种分子间作用力;氢键的大小介于化学键与范德华力间,不属于化学键,但有键长、键能,氢键具有饱和性、方向性。
二、氢键的存在1、分子间氢键。
如:C2H5OH、CH3COOH、H2O 、HF、NH3 相互之间2、分子内氢键。
如:苯酚邻位上有-CHO、-COOH、-OH和-NO2时,由氢键组成环的特殊结构生物大分子中也存在的氢键三、氢键的强弱(1)、X—H ... Y—:X和Y的电负性越大,吸引电子能力越强,则氢键越强。
如:F 电负性最大,得电子能力最强,因而F-H…F是最强的氢键。
(2)、氢键强弱顺序:F-H…F > O-H…O > O-H…N > N-H…N (注意:C原子吸引电子能力较弱,一般不形成氢键)。
氢键强弱比较四、对物质熔沸点的影响分子间能形成氢键的物质,一般都具有较高的熔点和沸点,这是因为固体熔化或液体气化时除了破坏范德华力外,还必须破坏分子间氢键,从而需要消耗更多的能量。
在同类化合物中能形成分子间氢键的物质,其熔沸点比不能形成分子间氢键的高。
如,第VIA 族元素的氢化物,由H2Te、H2Se 到H2S,随相对分子量的递减,分子间作用力递减,熔沸点依次降低;但H2O 分子间形成了O-H…O 氢键,分子间作用力增强,H2O 的熔沸点陡然升高。
分子内氢键的形成使物质的熔沸点降低。
如,邻、间、对硝基苯酚的熔点分别为45℃、96℃、114℃,这是由于间位、对位硝基苯酚中存在分子间氢键,熔化时必须破坏其中的一部分氢键,熔点较高;而邻硝基苯酚中形成分子内氢键,不形成分子间氢键,故熔点较低。
五、对物质溶解性的影响如果溶质分子与溶剂分子之间形成氢键,则溶质的溶解度会骤增。

氢键的相关知识点总结1. 氢键的概念和定义氢键是指两个或多个分子间的相互作用力,其作用力主要来源于氢原子与其他原子形成的非共价键。
在氢键中,氢原子通过与其他原子(通常是氧、氮或氟原子)形成共价键而与带负电性较强的原子形成氢键。
氢键通常被表示为“H···A”,其中H代表氢原子,A代表带负电性的原子。
氢键的形成是在电负性较强的原子上形成部分正电荷,使其与邻近原子的带负电性原子发生相互作用,从而形成了氢键。
氢键的作用力既包括电荷-电荷相互作用力,也包括范德华力等非共价相互作用力。
氢键的强度通常在5-40kj/mol之间,比范德华力强,但比共价键弱。
氢键是一种比较强的作用力,在化学和生物学中起到了非常重要的作用。
它不仅使得分子之间能够形成化学键,还能够在生物体内调控生物分子的结构和功能。
由于氢键的独特性质,使得它成为了一种非常重要的相互作用力,其研究在化学、生物学、物理化学等领域都有着重要的应用和意义。
2. 氢键的结构氢键的结构主要取决于参与形成氢键的分子的性质和构型。
一般而言,氢键的结构可以分为两种类型:线性氢键和非线性氢键。
线性氢键是指氢原子和带负电性原子以直线的方式相互作用形成的氢键。
在线性氢键中,氢原子和带负电性原子之间的键角约为180°,结构上呈现出一条直线状。
线性氢键通常具有较大的键能,且较为稳定。
非线性氢键是指氢原子和带负电性原子以非直线的方式相互作用形成的氢键。
在非线性氢键中,氢原子与带负电性原子之间的键角大约在160°-180°之间,结构上呈现出一定的弯曲状。
非线性氢键通常具有较小的键能,且较为不稳定。
氢键的结构相对复杂,同时也受到多种因素的影响。
分子的构型、成键原子的性质以及外界环境等都能够对氢键的结构产生一定程度的影响。
因此,氢键的结构十分复杂且多样化。
3. 氢键的性质氢键具有一系列独特的性质,使得它成为一种非常重要的相互作用力。

氨水中4种氢键主要存在形式
氨水中的氢键主要存在形式有四种,分别是:
分子间氢键:氨分子之间形成的氢键,这种氢键是由氨分子中的氮原子与另一个氨分子中的氢原子相互作用形成的。
在氨水中,分子间氢键的形成使得氨分子能够以一定的聚集态存在,影响了氨水的物理性质,比如沸点、蒸发速率和溶解度等。
分子内氢键:氨分子内形成的氢键,这种氢键是由氨分子中的氮原子与同一个分子内的氢原子相互作用形成的。
分子内氢键的形成会影响氨分子的电子云分布和化学性质。
水分子与氨分子间的氢键:水分子和氨分子之间形成的氢键,这种氢键是由水分子中的氧原子与氨分子中的氮原子相互作用形成的。
水分子与氨分子间的氢键在氨水的形成和稳定性中起着重要作用,同时也影响着氨水的溶解度和酸碱性。
水分子间氢键:由于水分子之间的氧原子和氢原子之间的相互作用形成的氢键。
这种氢键在纯水中非常普遍,也存在于氨水之中,对水的物理性质如沸点和凝固点等有一定影响。
这四种氢键的存在形式在氨水中都起到了非常重要的作用。
了解这些氢键的存在形式和形成机理,有助于深入理解氨水的化学性质和物理性质,对相关领域的研究和应用具有重要意义。
同时,对于其他含有氮、氧、氟等电负性较强的元素的化合物,也存在类似的氢键现象,因此对氨水中氢键的研究也可以为其他类似化合物的研究提供借鉴和参考。

氢键的结构氢键是一种分子间相互作用力,它是由于分子中的氢原子与其他原子之间的极性相互作用而形成的。
这种相互作用力在化学和生物学中起着重要的作用,并对分子的结构和性质产生着重要影响。
氢键的结构可以分为三种类型:线性氢键、非线性氢键和水分子中的氢键。
线性氢键是指氢原子与另一个原子形成直线排列的氢键。
这种氢键通常发生在分子中含有氢原子和较电负的原子(如氮、氧和氟)的化合物中。
其中,氢原子以共价键形式与一个原子结合,同时通过静电作用与另一个原子形成氢键。
这种线性氢键的结构使分子更加稳定,并且可以影响分子的几何构型和化学性质。
非线性氢键是指氢原子与另一个原子形成非直线排列的氢键。
这种氢键的形成通常是由于分子中存在多个氢原子和较电负的原子之间的相互作用。
非线性氢键的结构使分子具有更大的灵活性和多样性,对分子的性质和功能起到重要作用。
水分子中的氢键是指水分子中的氢原子与氧原子之间的相互作用力。
水分子是由两个氢原子和一个氧原子组成的,其中氢原子与氧原子之间形成了两个氢键。
水分子中的氢键使其具有特殊的性质,如高沸点、高表面张力和固体的密度小于液体等。
水分子的氢键结构也对生命的存在和发展起到了至关重要的作用。
除了以上三种主要的氢键结构外,还存在其他类型的氢键,如离子-氢键和分子内氢键等。
离子-氢键是指氢原子与带有正电荷的离子之间的相互作用力。
这种氢键的结构对于离子的稳定性和反应性起着重要作用。
分子内氢键是指分子内部的氢键相互作用。
这种氢键的结构可以影响分子的构象和性质,并在化学反应中发挥重要作用。
氢键的结构多种多样,每种结构都对分子的性质和功能产生影响。
通过研究和理解氢键的结构,可以深入了解分子之间的相互作用和化学反应机制,为材料科学、生物学和药物设计等领域的研究提供重要的理论基础。


氢键:氢原子与电负性的原子X共价结合时,共用的电子对强烈地偏向X的一边,使氢原子带有部分正电荷,能再与另一个电负性高而半径较小的原子Y结合,形成的X—H┅Y型的键分子间的作用力与氢键的区别:氢键的本质是强极性键(A-H)上的氢核与电负性很大的、含孤电子对并带有部分负电荷的原子B之间的静电引力。
氢原子可以同时与2个电负性很大、原子半径较小且带有未共享电子对的原子(如O、N、F等)相结合。
在X—H…Y,X、Y都是电负性很大、原子半径较小且带有未共享电子对的原子。
X—H 中,X有极强的电负性,使得X—H键上的电子云密度偏向于X一端,而H显示部分正电荷;另一分子中的Y上也集中着电子云而显负性,它与H以静电力相结合,这就是氢键的本质。
所以一般把形成氢键的静电引力也称为范德华力,所不同的的是它具有饱和性与方向性。
这种力一般在40kJ/mol以下,比一般的键能小得多。
影响分子间作用力大小的因素:氢键、键的极性、相对分子量分子间的作用力大小与物理性质的关系:组成和结构相似的物质,相对分子质量越大,分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高.但存在氢键时分子晶体的熔沸点往往反常地高.分子间作用力与氢键的关系氢键的本质是强极性键(A-H)上的氢核与电负性很大的、含孤电子对并带有部分负电荷的原子B之间的静电引力。
氢原子可以同时与2个电负性很大、原子半径较小且带有未共享电子对的原子(如O、N、F等)相结合。
在X—H…Y,X、Y都是电负性很大、原子半径较小且带有未共享电子对的原子。
X—H 中,X有极强的电负性,使得X—H键上的电子云密度偏向于X一端,而H显示部分正电荷;另一分子中的Y上也集中着电子云而显负性,它与H以静电力相结合,这就是氢键的本质。
所以一般把形成氢键的静电引力也称为范德华力,所不同的的是它具有饱和性与方向性。
这种力一般在40kJ/mol以下,比一般的键能小得多。
:分子间作用力分类分子间作用力可以分为以下三种力:取向力取向力发生在极性分子与极性分子之间。
高一知识点氢键氢键是一种重要的化学现象,它在生物、物理和化学领域中起着关键作用。
在高一化学课程中,学生经常会接触到氢键的概念。
本文将介绍氢键的基本原理、形成条件以及其在生物学和化学中的应用。
一、氢键的基本原理氢键是由一个部分正电荷的氢原子与一个具有部分负电荷的电子云或原子之间的相互作用所引起的。
在氢键中,通常一个氢原子与一个氮、氧或氟原子形成键合,而这些氮、氧或氟原子都有较强的电负性。
氢键可以分为两类:1)氢键的给体是一个氮、氧或氟原子,受体是一个电子云或原子;2)氢键的给体是一个电子云或原子,受体是一个氮、氧或氟原子。
氢键的能力取决于给体和受体之间的距离和角度。
二、氢键的形成条件氢键的形成需要满足一些条件,包括距离、角度和电荷。
通常情况下,氢键形成的三个原子之间的距离应当大约在1.5至3.0埃之间。
此外,氢键的三个原子应当尽量保持线性,这意味着氢键的角度应当接近180度。
除了距离和角度之外,电荷也是影响氢键形成的重要因素。
氢键的给体通常要有一个部分正电荷的氢原子,而受体应当具有部分负电荷的电子云或原子。
三、氢键在生物学中的应用氢键在生物学中发挥着重要的作用。
例如,在DNA双螺旋结构中,氢键起到了连接两条链的作用。
DNA中的氢键是通过氧原子与氢原子之间的相互作用形成的,这种连接对于DNA的稳定性和复制过程至关重要。
另一个生物学中氢键的应用是蛋白质的折叠和稳定。
蛋白质中的氢键可以帮助维持蛋白质的三维结构,从而使其具有特定的功能。
氢键的形成与蛋白质的稳定性密切相关。
四、氢键在化学中的应用氢键在化学反应中也有许多应用。
例如,氢键可以影响分子之间的相互作用和反应速率。
通过控制氢键的形成和断裂,化学家可以调控分子的性质和化学反应的速度。
在有机合成中,氢键的存在可以影响分子的立体结构和反应选择性。
有时候氢键的形成可以阻止或促进某些反应的发生,从而产生有机合成的特定产物。
此外,氢键还可以在药物设计中发挥重要的作用。
氢键和碳氢键是化学中常见的两种键。
氢键是一种特殊类型的化学键,通常存在于电负性较强的元素(如氟、氧、氮)的氢化物之间。
氢键的实质也是一种电性作用,但是氢键是分子间较弱的作用力,它不是化学键。
氢键的形成是由于电负性较强的原子(如F,O,N等)对氢原子的电子的吸引作用。
当氢原子与电负性较强的原子(如F,O,N等)形成的共价键与另一个电负性较强的原子接近时,会产生一种吸引力,将氢原子“拉”过来,形成氢键。
氢键的强度比范德华力强,但是弱于共价键和离子键。
而碳氢键(C-H键)是碳原子和氢原子之间的一种化学键,这种键可以在许多有机化合物中找到。
它是一种共价单键,意味着碳原子与最多四个氢原子共享其外层价电子,这完成了它们的两个外壳,使它们变得稳定。
碳氢键的键长约为1.09埃(1.09×10-10米),键能约为413kJ/mol。
碳和氢的电负性分别是2.5和2.1,由于二者的电负性差只有0.4,因此碳氢键一般被认为是非极性的共价键。
洛阳理工学院谈谈氢键(专科)系别环境工程与化学系专业工业分析与检验班级Z090754姓名宋如箱2010 年 5 月 26日谈谈氢键摘要氢键是一种比分子键作用力稍强的相互作用,可以把它看作是一种较强的分子间作用力。
本文通过氢键的定义、本质、性质、类型、形成、强度、对物质性质的影响、存在方面综合介绍了氢键。
关键词:氢键、分子间作用力定义、本质、性质、类型、形成、强度、影响、存在Abstract :The hydrogen bond is slightly stronger than the interaction of molecular bond forces, it can be seen as a strong intermolecular force. In this paper, the definition of hydrogen bonding, nature, nature, type, form, intensity, on the material properties, there is comprehensively introduced the hydrogen bondKey words: hydrogen bond, intermolecular force definition, nature, nature, type, form, strength, impact, there目录氢键的定义 (1)氢键的形成 (1)同种分子之间 (1)不同种分子之间 (1)氢键形成的条件 (1)氢键的本质 (2)氢键的性质 (2)饱和性和方向性 (2)键参数 (2)氢键的强度 (3)氢键的类型 (3)氢键形成对物质性质的影响 (4)熔点、沸点 (5)溶解度 (5)粘度 (6)体积与密度 (6)酸性 (6)构型 (7)硬度 (7)氮键的存在 (7)参考文献 (8)氢键的定义与电负性大的原子X(氟、氧、氮等)共价结合的氢,如与负电性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形的键。
氢键的类型和本质氢键是一种重要的构成物质的化学键,它在有机物体结构中发挥着重要的作用,因此人们对其有着深入的研究。
在讨论氢键的类型和本质之前,先来回顾一下氢键的形成机理。
氢键形成的机理是氢原子的半电荷性质以及它与其他原子的作用,氢原子拥有一个负的电荷,它可以产生两个半电荷,即一个正电荷和一个负电荷,正电荷与负电荷之间可以形成电偶极引力,而当两个原子的半电荷相互作用的时候就会产生一种力,即氢键。
一般来说,当氢原子和其他原子相互作用的时候,吸引力比斥力大,所以当多个原子之间赋予电荷好的时候,它们之间就会形成氢键。
根据它的形成机理,可以将氢键分为三种类型:化学性氢键、物理性氢键和介电性氢键。
化学性氢键是最常见的氢键,它是一种由半电荷引起的化学键,在这种氢键中,氢原子和其它元素之间形成了一种半电子共享的非共价键。
因为氢原子相对较小,所以它们不能与其他原子形成强烈的共价键,但它们可以使原子之间形成弱的非共价键,这就是所谓的化学性氢键。
物理性氢键是由原子类型和形状决定的。
一般来说,当原子的形状合适的时候,它们之间就会形成物理性氢键。
这类氢键主要形成在同类原子或氢原子之间,因为它们具有相同的尺寸和形状,所以它们之间的作用较小。
介电性氢键是一种由介电性物质之间的聚合产生的氢键,介电性物质具有非常独特的电荷分布,例如氯化物,当它与其它物质接触的时候,它们就会形成一种特殊的氢键,即介电性氢键。
氢键本质上是一种由电荷分布引起的化学键,其作用机理可以归结为:在氢原子与其它原子之间形成两个半电荷,一个是正电荷,一个是负电荷,当正电荷与负电荷相互作用时,就会形成氢键来把原子连接起来。
氢键是物质构成的基础,它是生物结构活动的重要动力,在今天的世界中,氢键更多的是以分子的形式发挥作用,它是化学反应的关键,也是能够改变物质性质的重要因素,它正在被广泛地用于生物、医学、化学等领域,为我们提供了更多的可能性。
hcl化学键类型
HCl 的化学键类型:
1、氢键:HCl 是一个重要的氢化物,在分子中由共价键连接生成氢键。
它是
根据氢原子电子对答式中的对称原子间作用由共价键实现的,其中存在电荷平衡作用。
HCl 分子中的氢原子和氯原子的各自原子,可以互相吸引,形成一种带电的共价键,称为氢键。
2、共价键:HCl 由共价键连接形成,其中存在电荷不平衡作用。
HCl 分子中,氢原子和氯原子中的电子,彼此间可以通过立体键来连接,使得二者之间产生几英里的电荷分布。
因此,HCl 分子中存在平衡电荷,也就是说,HCl 分子中存在共价键。
3、键转移键:键转移键是一类特殊的介射偶联,其中存在HCl 分子中的结构
基团。
HCl 分子中,氢原子的电荷分布与氯原子的电荷分布存在一定的不平衡,形成一类特殊的介射偶联。
当一个偶联分子受到一个外部的偶联分子的牵引时,存在一种反应,也就是所谓的“键转移键”,这也是HCl 分子形成的一种特殊作用。
4、介射偶联:介射偶联是介射键的一种,它构成了HCl 分子中的介射键,它
的特点是有很多的电荷平衡,沿着介射键的方向,波长分布在不同的键上。
一个HCl 分子是由两个原子组成的,氢原子和氯原子之间存在一种电荷平衡的作用,这种介射作用形成了介射偶联,也就是HCl 分子中的一种特殊作用。
氢键形成的本质
氢键是一种特殊的氢键相互作用,它是指当一个氢原子的原子键注入到另一个非金属原子中(有时是一些非金属分子)时,形成的特殊的化学键称为氢键。
它是特征性的虚弱,相对较短的化学键。
1、氢键的形成机制
氢键是一个羟基原子以一个它自身孤立原子(无氧原子)的形式去反应,但它不会成为一个二价离子,而只会成为一个单价离子,形成一个氢键的原子称为捐赠原子,也有时被称为捐赠者羟基。
这种单价的氢羟基可以与共价受体原子形成氢键,起连接作用。
2、氢键的特点
(1)氢键的吸引力相对较低,其大小就像杂项相互作用,只有当它们接近到一定距离时才能发挥作用。
(2)氢键相对短暂,氢键不具有极性,它们没有能量差异,因此常常不能形成持久化学结构。
(3)氢键反应性相对较低,同时因其相对较短,更容易受到其他的化学键的影响,也更容易被解离或替换。
3、氢键的作用
(1)保持结构稳定,氢键是一种中等强度的结合能,其中参与强度控制离子、酶、蛋白质及脂质分子之间的相互作用,另外氢键还能维持
有机分子的空间结构,使它们既保持稳定又保持其活性;
(2)形成蛋白质结构:氢键是复杂生物分子结构稳定的重要因素,蛋白质分子是由氢键连接的氨基酸残基形成的,蛋白质的结构和活动的高效率在极大的程度上具有获取由氢键把分子紧密结合的效果;(3)参与溶液中的反应:氢键通常参与溶液中的反应,它不仅能影响有机物的溶解性,而且也可以影响无机物质的溶解性;
(4)乙醇氢键:由于H2O及乙醇具有单价的氢羟基,当它们接触另一个非金属原子时,即可产生氢键。