第一类医疗器械生产备案表0001
- 格式:docx
- 大小:19.57 KB
- 文档页数:9
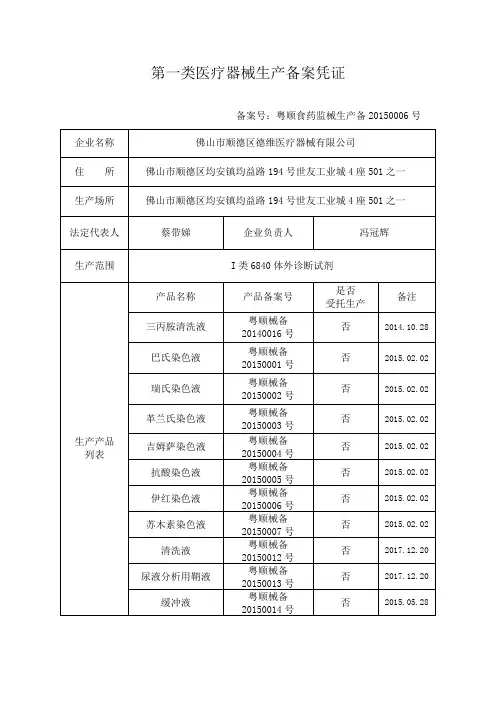
第一类医疗器械生产备案凭证备案号:粤顺食药监械生产备20150006号企业名称佛山市顺德区德维医疗器械有限公司住所佛山市顺德区均安镇均益路194号世友工业城4座501之一生产场所佛山市顺德区均安镇均益路194号世友工业城4座501之一法定代表人蔡带娣企业负责人冯冠辉生产范围I类6840体外诊断试剂生产产品列表产品名称产品备案号是否受托生产备注三丙胺清洗液粤顺械备20140016号否2014.10.28 巴氏染色液粤顺械备20150001号否2015.02.02 瑞氏染色液粤顺械备20150002号否2015.02.02 革兰氏染色液粤顺械备20150003号否2015.02.02 吉姆萨染色液粤顺械备20150004号否2015.02.02 抗酸染色液粤顺械备20150005号否2015.02.02 伊红染色液粤顺械备20150006号否2015.02.02 苏木素染色液粤顺械备20150007号否2015.02.02 清洗液粤顺械备20150012号否2017.12.20 尿液分析用鞘液粤顺械备20150013号否2017.12.20 缓冲液粤顺械备20150014号否2015.05.28尿液分析用染色液粤顺械备20150015号否2017.12.20尿液分析用稀释液粤顺械备20150016号否2017.12.20血细胞分析用鞘液粤顺械备20150017号否2017.12.20血细胞分析仪试剂-稀释鞘液粤顺械备20150018号否2015.05.28血细胞分析用染色液粤顺械备201500019号否2017.12.20血细胞分析用稀释液粤顺械备20150020号否2017.12.20血细胞分析用溶血剂粤顺械备20150021号否2017.12.20核酸提取或纯化试剂粤顺械备20180006号否2018.04.10细胞保存液粤顺械备20180007号否2018.04.10 备案部门(公章)备案日期:2018年05月 22日。

第一类医疗器械生产备案表一、引言随着医疗技术的快速发展和公众对健康需求的不断提高,医疗器械的生产和使用已成为社会的重要议题。
第一类医疗器械作为医疗器械的重要组成部分,其生产和使用的管理显得尤为重要。
本文将详细解读第一类医疗器械生产备案表的相关内容。
二、第一类医疗器械生产备案表概述第一类医疗器械是指通过常规控制能够确保安全性和有效性的医疗器械,如普通诊察器械、物理治疗器械等。
根据《医疗器械监督管理条例》规定,从事第一类医疗器械生产的单位必须向食品药品监督管理部门提交第一类医疗器械生产备案表,方可从事生产活动。
三、第一类医疗器械生产备案表主要内容第一类医疗器械生产备案表主要包括以下内容:1、生产单位基本信息:包括单位名称、统一社会信用代码、住所、法定代表人、生产等。
2、生产产品信息:包括产品名称、注册证编号、规格型号、生产批量、生产工艺流程等。
3、原材料采购信息:包括主要原材料的种类、供应商、进货渠道等。
4、质量控制信息:包括质量控制标准、检验设备及人员资质、产品检验报告等。
5、销售及售后服务信息:包括销售渠道、售后服务承诺等。
四、第一类医疗器械生产备案表的填报注意事项在填报第一类医疗器械生产备案表时,需要注意以下几点:1、确保填写的信息真实、准确、完整,不得虚报、瞒报。
2、对于生产过程中的关键环节和质量控制点,应详细描述并附上相关证明材料。
3、对于涉及到的技术参数和性能指标,应严格按照相关标准填写。
4、提交的资料应当清晰明了,易于查阅和理解。
五、总结第一类医疗器械生产备案表是保证第一类医疗器械安全性和有效性的重要文件,也是监管部门对生产单位实施监督管理的依据。
各生产单位应认真填写备案表,遵守相关法规,确保医疗器械的质量和安全,为公众的健康提供有力保障。
监管部门也应加强对第一类医疗器械生产的监管力度,确保备案制度的落实和执行。
第一类医疗器械备案信息表一、概述第一类医疗器械备案信息表是用于记录和展示第一类医疗器械备案信息的表格。
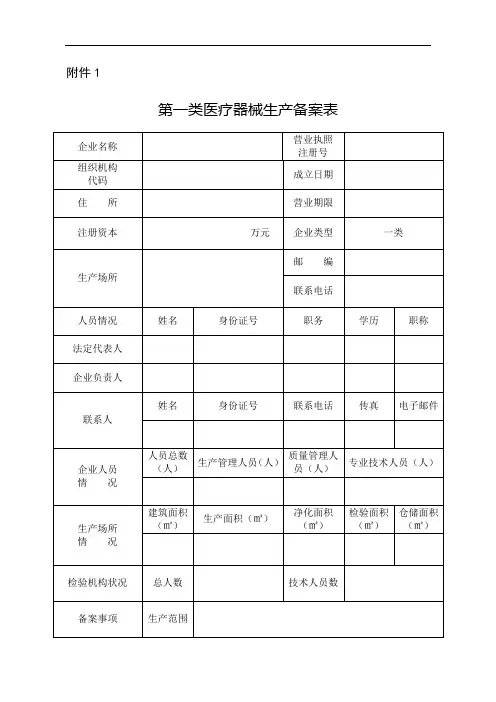
附件1第一类医疗器械生产备案表填表说明:一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求1.第一类医疗器械生产备案表;2.所生产产品的医疗器械备案凭证复印件;3.经备案的产品技术要求复印件;4.营业执照和组织机构代码证复印件;5.法定代表人、企业负责人身份证明复印件;6.生产、质量和技术负责人的身份、学历职称证明复印件;7.生产管理、质量检验岗位从业人员、学历职称一览表;8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;9.主要生产设备和检验设备目录;10.质量手册和程序文件;11.工艺流程图;12.经办人授权证明;13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证备案号:XX食药监械生产备XXXXXXXX号备案部门(公章)备案日期:年月日第二类医疗器械经营备案表填表说明一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
第二类医疗器械经营备案材料要求1.第二类医疗器械经营备案表;2.企业营业执照复印件;3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;4.企业组织机构与部门设置说明;5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;6.企业经营设施和设备目录;7.企业经营质量管理制度、工作程序等文件目录;8.经办人授权证明;9.其他证明材料。

第一类医疗器械备案表产品名称(产品分类名称):备案人:成都市食品药品监督管理局制填表说明1. 本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2. 要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕” 因备案表格式所限而无法填写完整时,请另附附件。
3. 备案时应一并提交含有备案表内容(含附件)的电子文档(Excel 形式)。
4. 境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5. 如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6. 境内医疗器械备案人应填写组织机构代码。
7. 进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8. 所填写各项内容应与所提交备案材料内容相对应。
9. 产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10. 备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11. 备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12. 如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
应附资料1.产品风险分析资料□2.产品技术要求□3.产品检验报告□4.临床评价资料□5.生产制造信息□6.产品说明书及最小销售单元标签设计样稿□7.证明性文件□8.符合性声明□□其他需要说明的问题备案人/ 代理人(签章)日期:年月日第一类医疗器械备案变更表共页,第页共页,第页注:如实申报,填写完整、规范第一类医疗器械备案凭证补发表受理号:共页,第页共页,第页注:如实申报,填写完整、规范。

第一类医疗器械生产备案表第一类医疗器械生产备案表企业名称:营业执照注册号:成立日期:组织机构代码:注册资本(万元):营业期限:企业类型:邮编:住所:联系生产地址:联系人员情况:法定代表人:企业负责人:联系人:人员总数(人):生产管理人员(人):质量管理人员(人):技术人员数:专业技术人员(人):一类检验机构状况:备案事项:生产范围:生产产品列表:序号产品名称产品备案号备注本企业承诺所提交的全部备案资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字)(企业盖章)填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表生产范围应当按照国家食品药品监督管理部门发布的第一类医疗器械产品目录和相应体外诊断试剂分类子目录中规定的管理类别、分类编码和名称填写。
第一类医疗器械生产备案变更表备案编号:组织机构代码:联系人:变更内容:企业名称:住所:法定代表人:企业负责人:生产地址非文字性变更:生产地址文字性变更:原备案事项:联系变更后事项:备案日期:生产范围:生产产品:本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字)(企业盖章)填表说明:1.本表按照实际内容填写,不涉及的可缺项。
2.本表生产范围应当按照国家食品药品监督管理部门发布的第一类医疗器械产品目录和相应体外诊断试剂分类子目录中规定的管理类别、分类编码和名称填写。
第一类医疗器械生产备案凭证补发表备案编号:企业名称:住所:生产地址:法定代表人:联系人:企业负责人:联系备案日期:组织机构代码:生产范围:生产产品列表:序号:补发:遗失、损毁原因:说明:本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
附件 1第一类医疗器械生产备案表企业名称组织机构代码住所注册资本生产场所人员情况法定代表人企业负责人联系人企业人员情况生产场所情况姓名姓名人员总数(人)建造面积(㎡)万元身份证号身份证号生产管理人员(人)生产面积(㎡)营业执照注册号成立日期营业期限企业类型邮编联系电话职务联系电话质量管理人员(人)净化面积(㎡)一类学历职称传真电子邮件专业技术人员(人)检验面积仓储面积(㎡) (㎡)检验机构状况备案事项总人数生产范围技术人员数序号产品名称生产产品列表产品备案号是否受托生产备案日期本企业承诺所提交的全部备案材料真实有效,并承担因失实引起的一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字) (企业盖章)年月日填表说明:一、本表按照实际内容填写,不涉及的可缺项.其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用 A4 纸双面打印,不得手写。
附件 2第一类医疗器械生产备案材料要求1。
第一类医疗器械生产备案表;2.所生产产品的医疗器械备案凭证复印件;3。
经备案的产品技术要求复印件;4.营业执照和组织机构代码证复印件;5.法定代表人、企业负责人身份证明复印件;6。
生产、质量和技术负责人的身份、学历职称证明复印件;7.生产管理、质量检验岗位从业人员、学历职称一览表;8。
生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;9.主要生产设备和检验设备目录;10.质量手册和程叙文件;11.工艺流程图;12。
经办人授权证明;13.其他证明材料。
备案材料应完整、清晰,使用 A4 纸打印装订并附有目录,复印件加盖公章后与电子版一并提交.附件 3第一类医疗器械生产备案凭证备案号:XX 食药监械生产备 XXXXXXXX 号企业名称住所生产场所法定代表人企业负责人备案部门(公章)备案日期: 年 月 日附件 4第二类医疗器械经营备案表营业执照 注册号 成立日期营业期限注册资本邮 编传真联系电话企业名称组织机构 代 码 住 所经营方式经营场所联系人库房地址 联系电话身份证号 电子邮件姓名生产范围产品名称产品备案号是否 受托生产备注生产产品 列表邮 编经营范围人员情况 法定代表人 企业负责人 质量负责人企业人员 情 况建造面积经营场所 情 况经营场所及 仓储条件本企业承诺所提交的全部备案材料真实有效,并承担因失实引起的一切法律责任。

第⼀类医疗器械备案(变更、补发、取消)表格第⼀类医疗器械备案表产品名称(产品分类名称):备案⼈:成都市⾷品药品监督管理局制填表说明1.本表⽤于进⼝和境内第⼀类医疗器械、体外诊断试剂备案。
2.要求填写的栏⽬内容应使⽤中⽂、打印完整、清楚、不得空⽩,⽆相关内容处应填写“⁄”。
因备案表格式所限⽽⽆法填写完整时,请另附附件。
3.备案时应⼀并提交含有备案表内容(含附件)的电⼦⽂档(Excel形式)。
4.境内医疗器械、体外诊断试剂只填写备案⼈名称、注册地址和⽣产地址中⽂栏。
进⼝医疗器械、体外诊断试剂备案⼈名称、注册地址和⽣产地址中⽂栏⾃⾏选择填写。
进⼝医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中⽂栏必填。
5.如系统⽀持,则进⼝医疗器械产品名称、备案⼈名称、注册地址和⽣产地址原⽂栏必填,原⽂填写内容应与备案⼈注册地址或⽣产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明⽂件中载明内容和⽂种⼀致。
6.境内医疗器械备案⼈应填写组织机构代码。
7.进⼝医疗器械产品名称、备案⼈名称、注册地址和⽣产地址英⽂栏必填。
如原⽂⾮英⽂,英⽂内容必须与原⽂⼀致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类⽬录、第⼀类医疗器械产品⽬录、第⼀类体外诊断试剂分类⼦⽬录等相关⽂件填写。
10.备案⼈、代理⼈注册地址栏填写备案⼈和代理⼈企业营业执照等相关证明性⽂件上载明的注册地址。
11.备案⼈、代理⼈所在地系指备案⼈和代理⼈注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明第⼀类医疗器械备案变更表共页,第页第⼀类医疗器械备案凭证补发表受理号:共页,第页共页,第页注:如实申报,填写完整、规范。
第⼀类医疗器械备案取消表受理号:注:如实申报,填写完整、规范。

附件1上海市第一类医疗器械生产首次备案表企业名称(公章):申请人:联系电话:填表日期:年月日以下由食品药品监督管理部门填写备案日期年月日备案编号:国家食品药品监督管理总局监制上海市食品药品监督管理局改制谢谢你的观赏谢谢你的观赏填表说明一、申请企业必须按照要求填表,并对所填内容的真实性负责。
二、企业在报送申请表时,将有关证明材料一并附上。
三、拟建企业法定代表人应亲笔签名。
四、填表内容必须打印。
谢谢你的观赏谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产首次备案资料一览表备案资料号:申请企业名称__________________________谢谢你的观赏申请人(签名):__________________ 日期: 年月日委托代理人(签名):______________ 日期: 年月日受理人(签名): _________________ 日期: 年月日谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产(首次)备案资料目录企业名称:谢谢你的观赏谢谢你的观赏编号:沪生产备上海市第一类医疗器械生产变更备案表企业名称(公章): 申请人:联系电话:填表日期: 年 月 日 以下由食品药品监督管理部门填写 受理日期 年 月 日国家食品药品监督管理总局监制 上海市食品药品监督管理局改制填表说明一、请企业必须按照要求如实填表,并对所填内容的真实性负责。
二、企业在报送申请表时,将有关证明材料一并附上。
三、法定代表人应亲笔签名。
四、填表内容必须打印。
谢谢你的观赏谢谢你的观赏谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产变更备案资料一览表备案资料号:申请企业名称__________________________申请人(签名):__________________ 日期: 年月日委托代理人(签名):______________ 日期: 年月日受理人(签名): _________________ 日期: 年月日谢谢你的观赏企业名称:谢谢你的观赏谢谢你的观赏第一类医疗器械生产备案凭证补发表填表说明:本表按照实际内容填写,不涉及的可缺项。

附件1上海市第一类医疗器械生产首次备案表企业名称(公章):申请人:联系电话:填表日期:年月日以下由食品药品监督管理部门填写备案日期年月日备案编号:国家食品药品监督管理总局监制上海市食品药品监督管理局改制谢谢你的观赏谢谢你的观赏填表说明一、申请企业必须按照要求填表,并对所填内容的真实性负责。
二、企业在报送申请表时,将有关证明材料一并附上。
三、拟建企业法定代表人应亲笔签名。
四、填表内容必须打印。
谢谢你的观赏谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产首次备案资料一览表备案资料号:申请企业名称__________________________谢谢你的观赏申请人(签名):__________________ 日期: 年月日委托代理人(签名):______________ 日期: 年月日受理人(签名): _________________ 日期: 年月日谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产(首次)备案资料目录企业名称:谢谢你的观赏谢谢你的观赏编号:沪生产备上海市第一类医疗器械生产变更备案表企业名称(公章): 申请人:联系电话:填表日期: 年 月 日 以下由食品药品监督管理部门填写 受理日期 年 月 日国家食品药品监督管理总局监制 上海市食品药品监督管理局改制填表说明一、请企业必须按照要求如实填表,并对所填内容的真实性负责。
二、企业在报送申请表时,将有关证明材料一并附上。
三、法定代表人应亲笔签名。
四、填表内容必须打印。
谢谢你的观赏谢谢你的观赏谢谢你的观赏谢谢你的观赏上海市第一类医疗器械生产变更备案资料一览表备案资料号:申请企业名称__________________________申请人(签名):__________________ 日期: 年月日委托代理人(签名):______________ 日期: 年月日受理人(签名): _________________ 日期: 年月日谢谢你的观赏企业名称:谢谢你的观赏谢谢你的观赏第一类医疗器械生产备案凭证补发表填表说明:本表按照实际内容填写,不涉及的可缺项。
附件1
第一类医疗器械生产备案表
第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
附件2
第一类医疗器械生产备案材料要求
1. 第一类医疗器械生产备案表;
2. 所生产产品的医疗器械备案凭证复印件;
3. 经备案的产品技术要求复印件;
4. 营业执照和组织机构代码证复印件;
5. 法定代表人、企业负责人身份证明复印件;
6. 生产、质量和技术负责人的身份、学历职称证明复印件;
7. 生产管理、质量检验岗位从业人员、学历职称一览表;
8. 生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9. 主要生产设备和检验设备目录;
10. 质量手册和程序文件;
11. 工艺流程图;
12. 经办人授权证明;
13. 其他证明材料。
备案材料应完整、清晰,使用A4 纸打印装订并附有目录,复
印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:
第二类医疗器械经营备案表
填表说明
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类
目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4 纸双面打印,不得手写。
第二类医疗器械经营备案材料要求
1. 第二类医疗器械经营备案表;
2. 企业营业执照复印件;
3. 企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;
4. 企业组织机构与部门设置说明;
5. 企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;
6. 企业经营设施和设备目录;
7. 企业经营质量管理制度、工作程序等文件目录;
8. 经办人授权证明;
9. 其他证明材料。
备案材料应完整、清晰,使用A4 纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第二类医疗器械经营备案凭证
备案号:XX食药监械经营备XXXXXXXX号
备案部门(公章)
备案日期:。