第七章消除反应完
- 格式:doc
- 大小:574.50 KB
- 文档页数:18






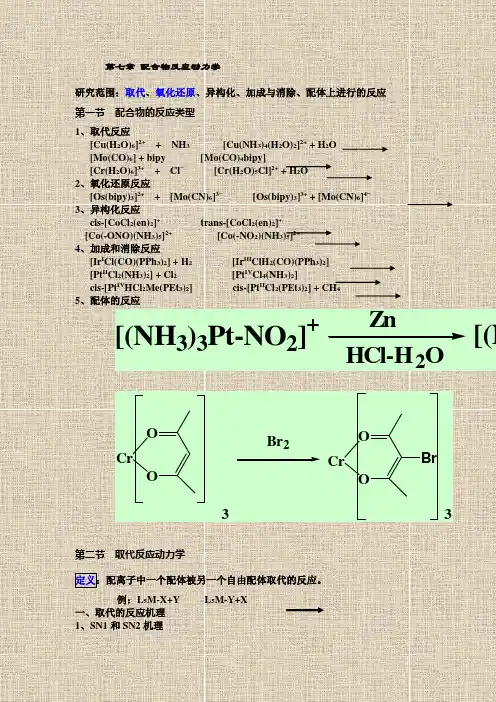
第七章配合物反应动力学研究范围:取代、氧化还原、异构化、加成与消除、配体上进行的反应第一节配合物的反应类型1、取代反应[Cu(H2O)6]2++ NH3 [Cu(NH3)4(H2O)2]2+ + H2O[Mo(CO)6] + bipy [Mo(CO)4bipy][Cr(H2O)6]3++ Cl−[Cr(H2O)5Cl]2+ + H2O2、氧化还原反应[Os(bipy)3]2++ [Mo(CN)6]3−[Os(bipy)3]3+ + [Mo(CN)6]4−3、异构化反应cis-[CoCl2(en)2]+trans-[CoCl2(en)2]+[Co(-ONO)(NH3)5]2+[Co(-NO2)(NH3)5]2+4、加成和消除反应[Ir I Cl(CO)(PPh3)2] + H2[Ir III ClH2(CO)(PPh3)2][Pt II Cl2(NH3)2] + Cl2[Pt IV Cl4(NH3)2]cis-[Pt IV HCl2Me(PEt3)2] cis-[Pt II Cl2(PEt3)2] + CH45、配体的反应ZnHCl-H2O [(NH3)3Pt-NO2]+[(NCrOOCrOOBrBr233第二节取代反应动力学定义:配离子中一个配体被另一个自由配体取代的反应。
例:L5M-X+Y L5M-Y+X一、取代的反应机理1、SN1和SN2机理(1)离解机理(SN1机理)慢a.L5M-X = L5M + X(配位数下降6 5)b.L5M + Y = L5M-Y速率方程:d[L5M-Y]/dt = k[L5M-X]速率与Y浓度无关,是对[L5M-X]的一级反应。
(2)缔合机理(SN2机理)慢a、L5M-X + Y = L5MXY(配位数升高6 7)b、L5MXY = L5M-Y + Xd[L5M-Y]/dt = k[L5M-X][Y]属于二级反应。
* SN1和SN2是两种极限情況。
二.活性与惰性配合物及理论解释1、活性与惰性配合物1)定义:配体可被快速取代的配合物,称为活性配合物;配体取代缓慢的配合物,称为惰性配合物划分标准:配合物与反应试剂(浓度均为0.1M)在25℃时反应,t1/2>1min,称为惰性配合物;t1/2<1min,称为活性配合物。



第七章燃烧及其利用课题1 燃烧和灭火考试要求:认识燃烧、缓慢氧化、爆炸的条件及其防火、灭火、防爆炸的措施一、燃烧1、概念:可燃物与空气中氧气发生的一种发光、放热的剧烈的氧化反应。
2、条件:(1)可燃物(2)氧气(或空气)(3)温度达到着火点(三者缺一不可,否则不能燃烧)如右图所示:A、薄铜片上的白磷燃烧而红磷不燃烧,说明了燃烧需要温度达到着火点;B、薄铜片的白磷燃烧而水中的白磷不燃烧,说明了燃烧需要氧气白磷的着火点低,应贮存在装有水的试剂瓶中3、燃烧与缓慢氧化的比较相同点:都是氧化反应、都放热;不同点:前者发光、反应剧烈,后者不发光、反应缓慢二、灭火的原理和方法(考点一)1、燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以达到灭火的目的2、灭火的原理:(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下。
3、泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般的失火外,还可以扑灭电器、油、气等燃烧引起的失火。
液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等处的失火4、泡沫灭火器的反应原理,利用碳酸钠与浓盐酸迅速反应产生大量的二氧化碳来灭火化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑二、爆炸(考点二)概念发生条件防范措施燃烧可燃物与氧气发生的一种发光、发热的剧烈的氧化反应可燃物;与空气或氧气接触;温度达到着火点可燃物与其他物品隔离;与空气隔离;降低温度至着火点以下②化学变化的爆炸:可燃物在有限空间内急速燃烧,放出的热使气体的体积迅速膨胀③可燃性气体(氢气、一氧化碳、甲烷)或粉尘(面粉、煤粉)与空气或氧气混合,遇到明火可能会发生爆炸;可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险④油库、面粉加工厂门口贴有“严禁烟火”的标志:空气中常混有可燃性气体或粉尘,接触到明火,就有发生爆炸的危险⑤可燃物与氧气的接触面积越大,燃烧越剧烈常见灭火的方法(考点三)①油锅着火,用锅盖盖灭②电器着火,先应切断电源③煤气泄漏,先应关闭阀门,再轻轻打开门窗,切忌产生火花④酒精在桌面上燃烧,用湿抹布扑盖⑤扑灭森林火灾,将大火蔓延前的一片树木砍掉其它:A、生煤炉火时,需先引燃纸和木材,因为纸和木材的着火点比煤低,容易点燃B、室内起火,如果打开门窗,会增加空气的流通,增加氧气的浓度,反应剧烈,燃烧更旺C、用扇子扇煤炉火,虽然降低了温度,但没有降至着火点以下,反而增加了空气的流通,所以越扇越旺。

一、名词解释1.氧化反应:有机化合物分子中,凡失去电子或电子偏移,使碳原子上电子密度降低的反应称为氧化反应。
狭义地说,是指化合物分子增加氧或失去氢的反应,或两者兼而有之。
2. 沃氏氧化反应:仲醇或伯醇在异丙醇铝催化下,用过量酮(丙酮或环己酮等)作为电子受体,可被氧化成相应的羰基化合物,该反应成为沃氏氧化反应。
3.消除反应: 从一个有机化合物分子中同时除去两个基团(或原子)而形成一个新的分子的反应称为消除反应。
4.达参反应:邻位或对位有羟基的芳醛或芳酮,在碱性条件下用过氧化氢氧化生成多羟基化合物的反应称为达参反应。
5.沃氏氧化反应(Oppenauer氧化):仲醇或伯醇在异丙醇铝催化下,用过量酮(丙酮或环己酮等)作为电子受体,可被氧化成相应的羰基化合物,该反应成为沃氏氧化反应。
二、填空题1. 高锰酸盐为强氧化剂,在酸性、中性及碱性条件下均能起氧化作用。
常在中性或碱性溶液中使用。
2. 过量的高锰酸钾可以用亚硫酸钠等还原剂将其分解掉。
过滤,除去不溶性的二氧化锰后,将羧酸盐的水溶液用无机酸酸化,即可得到较纯净的产物。
3. 重铬酸钠容易潮解,但是比重铬酸钾的价格便宜得多,在水中的溶解度大,故在工业上应用广泛。
目前,由于重铬酸盐价格较贵,含铬废液的处理费用较高,因此已逐渐被其他氧化法所代替。
4. 三氧化铬—吡啶络合物又称为Collins试剂,其制备方法是将一份三氧化铬缓慢分次加入10份吡啶中,逐渐提高温度至30℃,最后得到黄色络合物,将三氧化铬—吡啶络合物从吡啶中分离出来,干燥后再溶于二氯甲烷中组成溶液。
它于无水条件下氧化醇,可得收率较高的醛或酮。
5. 过氧化氢俗称双氧水,是一种缓和氧化剂,其最大特点是反应后不残留杂质,因而产品纯度高。
市售的过氧化氢试剂通常浓度为30%,它的氧化反应可在中性、酸性和碱性或催化剂存在下进行。
过氧化氢最大优点是在反应完成后本身变成水,无有害残留物。
但是过氧化氢不够稳定,只能在低温下使用,这就限制了它的使用范围。
有机化学中的消除反应有机化学中的消除反应是一种重要的反应类型,指的是有机物分子中的某种官能团或原子被去除,形成新的化学物质。
消除反应在有机合成、药物合成和生物化学等领域具有广泛的应用。
本文将介绍消除反应的机理、反应条件以及常见的消除反应类型。
一、消除反应的机理消除反应的机理可能有多种,其中最为常见的是亲核消除和酸催化消除。
1. 亲核消除机理亲核消除指的是一个亲核试剂攻击一个带有β氢的有机物分子,使其失去一个氢和一个卤素或其他官能团。
这个过程可以通过两个连续的步骤来描述:步骤一:亲核试剂攻击有机物分子中的碳原子,形成一个碳-亲核试剂中间体。
步骤二:中间体失去一个氢和一个卤素或其他官能团,产生消除产物和亲核试剂。
亲核消除通常需要存在β氢的有机物分子,而且该分子还要有足够的活化能,以便亲核试剂攻击。
2. 酸催化消除机理酸催化消除是以酸作为催化剂的消除反应。
酸可以使有机物中的其它官能团偏离其正常的反应路径,从而促使消除反应发生。
酸催化消除通常发生在酸性条件下,例如在浓硫酸或磷酸存在下进行。
二、常见的消除反应类型在有机化学中,存在多种消除反应类型,以下是其中几种常见的类型:1. β-消除β-消除是指当有机物分子中存在β位可活化的官能团时,它们往往会在适当的条件下发生消除反应。
常见的β-消除类型有:醇酸消除、亲核取代消除、脱氢消除等。
2. α-消除α-消除是指在有机物分子中,某个官能团与α位所连接的碳原子发生消除反应。
常见的α-消除类型有:鉍消除、卤素氢消除、萘环开启等。
3. 氧化消除氧化消除是指一种官能团在氧化剂的作用下发生消除,常见的氧化消除类型有:胺氧化消除、过氧化消除等。
4. 还原消除还原消除是指通过还原剂的作用,使含有特定官能团的有机物分子发生消除。
常见的还原消除类型有:酮醛消除、羧酸还原消除等。
三、消除反应的应用消除反应在有机合成中具有广泛的应用价值,常用于构建碳碳键和碳氧键等。
它可以用于合成具有复杂结构和功能的分子,例如天然产物合成、药物合成等。
第七章聚合物化学反应一、名称解释1. 聚合物化学反应:研究聚合物分子链上或分子链间官能团相互转化的化学反应过程。
聚合物的化学反应根据聚合物的聚合度和基团的变化(侧基和端基)可分为相似转变、聚合物变大的反应及聚合物变小的反应。
2. 功能高分子:是指具有传递、转换或储存物质、能量可信息的高分子,其结构特征是聚合物上带有特殊功能基团,其中聚合物部份起着载体的作用,不参与化学反应。
按功能的不同,可分为化学功能高分子、物理功能高分子和生物功能高分子。
3. 高分子试剂:也叫反应性高分子,即高分子试剂上的基团起着化学试剂的作用,它是各类高分子的化学试剂的总称。
4. 高分子催化剂:将能起催化剂作用的基团接到高分子母体上,高分子本身不发生变化,但能起催化低分子反应。
这种催化剂称作高分子催化剂,5. 低分子基质:低分子反应物中的特定基团与保护试剂作用后受到保护不再参与主反应,这种受到保护的低分子反应物称作低分子基质。
6. 高分子基质:将要准备反应的低分子化合物以共价键形式结合到聚合物载体上,得到高分子基质。
7. 接枝:通过化学反应,在某些聚合物主链上接上结构、组成不同的支链,这一过程称为接枝,形成的产物称为接枝共聚物。
8. 嵌段:形成嵌段共聚物的过程。
9. 扩链:分子量不高的聚合物,通过适当的方法,使多个大分子连接在一起,分子量因而增大的过程称为扩链。
10. 交联:聚合物在光、热、辐射、或交联剂作用下,分子链间形成共价键,产生凝胶或不溶物,这一过程称为交联。
交联有化学交联和物理交联。
交联的最终目的是提高聚合物的性能。
如橡胶的硫化等。
11. 交联剂:使聚合物交联的试剂。
12. 降解:降解是聚合度分子量变小的化学反应的总称。
它是高分子链在机械力、热、超声波、光、氧、水、化学药品、微生物等作用下,发生解聚、无规断链及低分子物脱除等反应。
13. 老化:聚合物及其制品在加工、贮存及使用过程中,物理化学性质及力学性能逐步变坏,这种现象称老化。
第七章 消除反应消除反应:是指从一个分子中除去两个原子或基团 生成不饱和化合物或环状化合物的反应。
α-消除:从同碳原子上消除两个原子或基团,形成卡宾。
有些反应也产生氮烯β-消除:γ-消除:两个原子或基团也可以从相隔更远的位置上除去.第一节 消除反应的历程及影响因素 一、消除反应的历程根据离去基团和β-氢从分子中离去的顺序,分为三种机理: 根据离去基团和β-氢从分子中离去的顺序,分为三种机理:C NuE C + Nu EC 6H 5O 2S N 3Fe (CO)C 6H 5O 2S N+N 2加热C CNu ECCNuE+在相邻的两个碳原子上的原子或基团被消除,形成双键或叁键。
两个原子或基团从1,3位上除去,形成环状化合物.CC C NuECCC+ NuEH 2C H C HC CH 2H 2C H C HC CH 2+Br2-1. E1历程-单分子消除反应机理2. E1cb 历程-共轭碱单分子消除机理3. E2历程-双分子消除反应机理4. E1历程-单分子消除反应机理 E1历程与SN1相似。
两部均为单分子反应 第一步 第二步 反应活性:对于烷基:3°> 2°> 1°> CH3 动力学上表现为一级反应 支持E1历程的证据:反应速度只与反应的物的浓度有关,与溶剂无关 V=k [反应物]反应活性 R3CX > R2CHX > RCH2X 间接说明有正碳离子中间体生成选择合适的反应底物, 在E1条件下完成消除反应 时,常常发现重排产物2、 E2历程-双分子消除反应机理C C C C +L -slowC CH+H+υ= kC C H L亲核试剂从反应物夺取一个b-H ,与此同时,离去基团带着一对键合电子离去,它们是逐渐进行的,经过一个过渡态,最后旧键完全断裂,新键完全生成形成烯烃。
B: 中性或带负电荷,如:OR -, OH -, H2O 等。
L: X ,SO2R , NO2, CN , NR3+,SR2+等。
动力学为二级动力学,反应速度与反应物的浓度有关,也与碱浓度有关。
V=k [反应物] [B]反应为协同反应,氢提取和离去基团的脱掉发生在同一步骤,从来没有鉴定到过中间体3、 E1cb 历程-共轭碱单分子消除机理 第一步 第二步在碱进攻下,H 首先离去,然后L 再以负离子形式离去。
按E1cb 机理进行反应底物结构特征:CLC C + H B + LC C H LBδδC CL HC C +B -fastLBH共轭酸共轭碱碳负离子历程+L -C C L① L 是难离去基团。
②至少有一个酸性β-氢(被吸电子基团活化,如:COCH3、NO2、Me3N+等)乙酸-2-硝基环己酯与CH3OK 的CH3OH 溶液作用,经E1cb 机理消除CH3COOH 得到1-硝基环己烯: E1、E2和E1cb 是β-消除反应中的三种极限机理。
通常按E2机理进行的较多,但完全按协同机理进行仅是一种理想状态。
如果βC —H 键的断裂先于αC —L 的断裂及π键的形成,在过渡态时βC —H 键的断裂程度就大于αC —L 键,这种过渡态与E1cb 类似;反之,则与E1类似。
实际上E1通过E2到E1cb 是一个连续变化的过程——E2可变过渡态理论。
该理论认为,许多消除反应的机理介于典型的E1、E2、 E1cb 之间,过渡态的确切状态会随离去基团的性质、碱的强弱、溶剂效应及反应底物的空间结构的不同而改变 -E2可变过渡态理论协同的一步反应,无任何中间体,而E1和E1cb 均为二步反应。
多数情况下E2键的断裂和形成并非协同的,而且有先有后,为此提出了可变过渡理论。
OCCH 3O 2CH 3OOCCH 3O 2NO 2二、影响消去反应的因素 1、反应物结构的影响被消除原子所连的碳原子上有支链时:如果按双分子反应,在SN2历程反应中亲核试剂进攻(α-碳原子,而在E2历程反应中进攻β-氢原子,支链的空间效应对SN2不利,而相对对E2有利;如果按单分子反应,无论是SN1或E1的历程,在反应速度决定步骤中形成同样的碳正离子,只是第二步不同,若连有较多的烷基按E1消除β-氢后,形成双键可减少分子张力,使分子稳定;按SNl 取代碳正离子与亲核试剂结合,键角被压缩(由120︒减至109.5 ︒) 反而张力增加。
可见无论按双分子或按单分子反应都对消除反应有利。
对E1和E2底物分子α-碳上支链增多,消去反应的活性增大。
E1的α -碳上支链增多,碳正离子更稳定; E2消除β-H 机会增大,形成的烯烃更稳定;C CHB Lδ+δ-C HCL δ+δ-C CHB L δ-δ+CC H Bδ+δ-CC H BLδ-δ+过渡态中C-H 键断裂程度增加过渡态中C-L 键断裂程度增加E1cb E1"似E1"E2"似E1cb"E2协同E2E2而β-C 有弱吸电基时倾向于E1cb 。
2、试剂的碱性碱越强,浓度越大,利于E1cb 、E2机理。
反之,利于E1机理。
强碱有利于E2机理,弱碱有利于取代反应。
3、 离去基团的影响好的离去基团利于E1、 E2历程;带正电荷的离去基团利于E1cb 历程。
好的离去基团利于取代反应( OTs -SN2 );带正电荷的离去基团利于消除反应。
4、溶剂的影响极性强,利于E1或E1cb 机理;极性弱,利于E2机理。
极性增加有利于SN2,不利于E2。
5. 温度的影响升高温度有利于消除反应。
第二节 消除反应的取向 一、消除反应的一般规则 1. Saytzeff 规则氢从含氢较少的 碳上脱去,生成取代基较多的稳定烯烃。
札依采夫(saytzeff )规则: 在ß-消除反应中的主要产物是双键碳C H 3CH 2C CH 3CH 3Br KOH 乙醇C H 3CH CCH 3CH 3C H 3CH 2CCH 2CH 3+上连接烃基最多的烯烃。
2、Hofmann 规则季铵碱(锍盐)的热分解反应,总是得到含取代基最少的烯烃和叔胺。
3、反Saytzeff 规则和反Hofmann 规则 (1)生成共轭体系优先失去β-氢,因为生成稳定的负碳离子。
二、反应历程与消除反应的取向 1、E1消除反应中离去基团完全离开后碳正离子中间体的 -C —H 氢键才断裂因此决定产物取向的是碳正离子转变为烯烃的步骤 1、E1历程遵从Saytyeff 规则,形成热力学稳定的烯烃,如果空阻过大时则遵从Hofmann 消除2、E1cb 历程 遵从Hofmannn 规则CH 3CH 2CH CH 3N(CH 3)3OHCH 3CH 2CH 2N(CH 3)3△CH 3CH 2CHCH 295%PhCH 2CH 2N CH 3CH 3CH 2CH 3ββ'OHPhCH CH 2+C H 3CH 2N (CH 3)2(CH 3)3CCH 2CCH 3Cl CH 3NaOHH 2O(CH 3)3CCH 2CCH 2+CH 3CH 3CCH 3CH 3CH=CMe 23. E2历程(1).中性底物的E2消除按Saytzeff 消除; (1).中性底物的E2消除按Saytzeff 消除;(2).离去基带电荷的底物的E2消除按Hofmann 消除,这时β-H 的酸性不同。
亚甲基氢酸性大于甲基氢。
离去基越难离去时越有利于按Hofmann 消除消除时,不能在桥头碳原子上形成双键(不能共平面)CH 2C CH H XR R'R"B -CHC CH HXRR'R"CHCH CHR R'R"(主要)R CH 2CHCH 3+OH -R'3酸性βH>β'H 易消除βHβ'βRCOPhCN NO 2SO 2R 当β-C 上连有强吸电基时遵从Saytzeff 规则RCCHCHCH 3O共轭稳定RCC H 2CHC H 3ONMe 3OH -第三节消除反应与取代反应的竞争 一、反应物的结构第三节消除反应与取代反应的竞争 一、反应物的结构按此顺序,亲核取代的位阻增大,进攻β-H 的机会增大,产物烯烃更加稳定。
(2)SN1和E1-碳上的支链增多,SN1的快步骤中的位阻增大,有利于消除。
二、碱的影响1.对E1和E2的影响:强碱有利于E2,弱碱或无碱的溶剂有利于E1。
(1)强碱有利于消除,弱碱强亲核试剂有利于取代反应。
碱性 C2H5O->CH3COO- 21% 79% 强碱的浓度越高,有利于双分子,特别是E2。
低浓度碱或不用碱时,质子性溶剂中单分子反应占优势,特别是SN1。
CX C αβZS N 2亲核试剂碱E21°RX 2°RX 3°RXE2比例增加,S N 2比例降低CC H S N 1E1CH 3COO -+(CH 3)2CHBr CH 3COOCH(CH 3)2+Br -C 2H 5O -+(CH 3)2CHBrCH 3CH 2O CH(CH 3)2+CH 2=CHCH 3(2)进攻试剂体积大体积的强碱易发生E2,而不利于SN2(空阻)。
三、离去基团的影响 好的离去基有利于E1和E2,不好的离去基如F-、R4N +有利于E1cb (强吸电性,使β-H 酸性增加)。
四、溶剂的影响极性大的溶剂对单分子有利,对双分子不利,对E2更不利,极性小的溶剂对双分子反应有利,对单分子反应不利,对E2更有利。
定速步骤中,单分子反应的电荷产生很集中,强极性溶剂有利于中间体的溶剂化而稳定,提高反应速率。
双分子反应的过渡态电荷分散,E2比SN2更分散, 极性小溶剂有利于电荷分散。
CH 3(CH 2)15CH 2CH 2Br 回流CH 3(CH 2)15CH=CH 2+CH 3(CH 2)15CH 2CH 2OR-CH 3O -, CH 3OH Me 3CO -, Me 3COH~1%(E2)99%(S N 2)~85%(E2)~15%(S N 2)BCXδδ-δ-δ-CC H BRX +NaOH/H 2O醇 取代RX +NaOH/EtOH烯 消除五、反应温度的影响消去反应的过渡态有C-H拉长和断裂,活化能更大,升温有利于消除。
第四节、消去反应的立体化学1、E2反应的立体化学—E2按反式消除sp3 → sp2 过渡态有部分p键性质消去的H 和X 必须在同一平面上,才能满足逐渐生成的p轨道最大限度的交叠。
考虑顺式共平面消除(顺式消除)(CH3)C Br+C2H5ONaC2H5OHMe3C OEt+CH2=CMe2δ-Bδ-结论:顺式消除比反式消除难发生 采用反式消除,有利于:(1)过渡态中sp3 向 sp2过渡时两个P 轨道的重叠; (2)碱与离去基位阻排斥最小,降低反应阻力。