201X秋九年级化学下册第6章溶解现象第3节物质的溶解性第2课时物质溶解性的定量表示习题课件沪教版
- 格式:ppt
- 大小:1.49 MB
- 文档页数:14
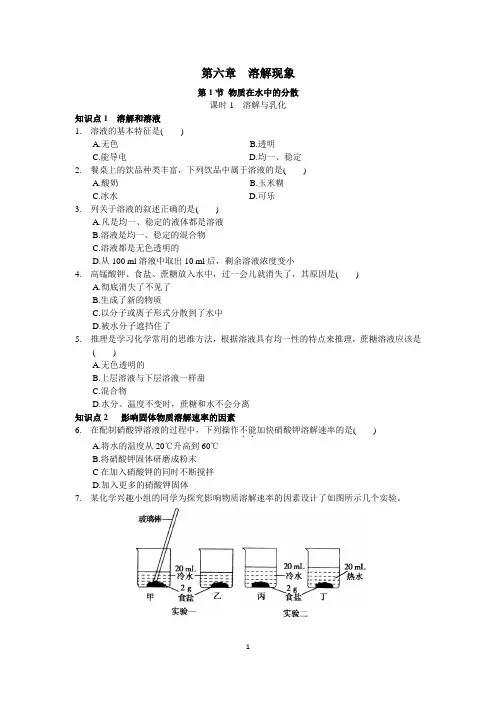
第六章溶解现象第1节物质在水中的分散课时1 溶解与乳化知识点1 溶解和溶液1. 溶液的基本特征是( )A.无色B.透明C.能导电D.均一、稳定2. 餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )A.酸奶B.玉米糊C.冰水D.可乐3. 列关于溶液的叙述正确的是( )A.凡是均一、稳定的液体都是溶液B.溶液是均一、稳定的混合物C.溶液都是无色透明的D.从100 ml溶液中取出10 ml后,剩余溶液浓度变小4. 高锰酸钾、食盐、蔗糖放入水中,过一会儿就消失了,其原因是( )A.彻底消失了不见了B.生成了新的物质C.以分子或离子形式分散到了水中D.被水分子遮挡住了5. 推理是学习化学常用的思维方法,根据溶液具有均一性的特点来推理,蔗糖溶液应该是( )A.无色透明的B.上层溶液与下层溶液一样甜C.混合物D.水分、温度不变时,蔗糖和水不会分离知识点2 影响固体物质溶解速率的因素6. 在配制硝酸钾溶液的过程中,下列操作不能..加快硝酸钾溶解速率的是( )A.将水的温度从20℃升高到60℃B.将硝酸钾固体研磨成粉末C在加入硝酸钾的同时不断搅拌D.加入更多的硝酸钾固体7. 某化学兴趣小组的同学为探究影响物质溶解速率的因素设计了如图所示几个实验。
(1)实验一探究的是对物质溶解速率的影响。
(2)实验二中观察到丁中的食盐比丙中溶解得快,由此得出的结论是。
(3)实验三中观察到.由此得出的结论是固体的颗粒越小,溶解得越快。
知识点3 乳化8. 下列洗涤或除污过程应用乳化原理的是( )A用水清洗沾在手上的蔗糖B.用水洗去盘子上的水果渣C.用洗洁精洗去餐具上的油污D.用稀盐酸清洗长期盛放石灰水的烧杯9. 下列应用与乳化现象无关..的是( )A.用汽油洗去金属表面的油污B.化妆品及乳制饮品的配制C.用洗发水清洗头发上的油脂D.用乳化剂稀释难溶于水的液态农药10. 下列关于溶解和乳化的说法正确的是( )A.利用乳化作用将油污溶解而除去B.向植物油与水的混合物中加入乳化剂,可得到溶液C.用酒精洗去试管中的碘利用了乳化原理D.用肥皂洗衣服利用了乳化原理11. 小刚分别试用以下方法清洗餐具:①只用冷水;②只用热水;③在冷水中加入几滴洗涤剂;④在热水中加入几滴洗涤剂。



初三化学(沪教版)九年级下册-第六章-溶解现象-第三节-物质的溶解性(含答案)一、单选题1. ( 2分) 室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为24%),另一瓶为5%的溶液,下列实验操作中,无法区分这两种溶液的是()A. 加一定量的水B. 加入少量硝酸钾晶体C. 略降低温度D. 室温时,蒸发少量水2. ( 2分) 甲、乙两种固体物质的溶解度曲线如图所示.下列叙述正确的是()A.甲的溶解度大于乙的溶解度B. t2℃时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲C. 将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数比乙大D. 将甲和乙的饱和溶液从t2℃降温至t1℃,甲析出的晶体多3. ( 2分) 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10g水,并冷却到T℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法正确的是( )A. T℃时,甲、乙两种物质的溶解度可能相同B. T℃时,甲物质的溶解度一定大于乙C. T℃时,甲物质的溶解度一定小于乙D. 将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和4. ( 2分) 甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是()A. 20℃时,甲物质的溶解度是40B. 升温可使乙物质的饱和溶液析出固体C. 甲物质的溶解度大于乙物质的溶解度D. 40℃时,将甲、乙两物质饱和溶液分别降温到20℃,二者都变为不饱和溶液5. ( 2分) 下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是()A. t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4B. P点表示甲、丙两种物质的饱和溶液质量相等C. t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液D. 将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质6. ( 2分) 如图是甲、乙两种固体的溶解度曲线,下列说法正确的是()A. 甲的溶解度等于乙的溶解度B. 升高温度可以将甲的不饱和溶液变为饱和溶液C. 20 ℃时,100 g乙的饱和溶液中溶质质量是30 gD. 40 ℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量7. ( 2分) 氢氧化钙的溶解度随温度升高而减小.要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水.其中措施正确的是()A. ①②④B. ①③④C. ①③⑤D. ①②⑤8. ( 2分) 关于硝酸钾溶解度的说法中正确的是()A. 20℃时,20g硝酸钾溶在100g水里,所以20℃时硝酸钾的溶解度是20gB. 20℃时,把20g硝酸钾溶在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20gC. 把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6gD. 20℃时,把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g二、多选题9. ( 3分) 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是()A. t1℃时,三种固体物质的溶解度关系为乙﹥甲=丙B. t2℃100g甲物质饱和溶液中含有60g甲C. 将丙物质饱和溶液变为不饱和溶液,可采用升温的方法D. t2℃时,分别用100g水配制甲、乙的饱和溶液,再降温到t1℃,析出无水晶体的质量:甲﹥乙10. ( 3分) 如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是()A.将20℃时甲、乙两物质的饱和溶液分别升温到40℃, 溶液中两物质的质量均不变B. 20℃时,甲、乙两种物质的溶解度均为30gC. 乙中含有少量甲时,一般采用蒸发溶剂的方法提纯甲D. 40℃时,甲、乙两溶液的溶质质量分数一定不相等11. ( 3分) 物质甲与乙的溶解度曲线如右图所示,下列说法正确的是()A. 温度大于t1℃时甲物质的溶解度大于乙物质的溶解度B. 温度升高可以将甲物质的不饱和溶液后变成饱和溶液C. 将t2℃甲、乙两物质的饱和溶液温度降低到t1℃时都会析出晶体D. t1℃时,甲、乙两物质的饱和溶液中溶质质量相等12. ( 3分) 甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。







初中化学九年级第6章《溶解现象》课堂练习及教学设计第一节《物质在水中的分散》一、自主先学悬浊液、乳浊液和溶液(1)若物质分散到水中后,还是小颗粒(大量分子集合体),则该物质______ (填溶于或不溶于)水,形成浑浊的悬浊液;如______、粉笔灰、碳酸钙等加到水中。
悬浊液静置后会分层,所以它不均一、不稳定。
(2)若物质分散到水中后,还是小液滴(大量分子集合体),则该物质______(填溶于或不溶于)水,形成浑浊的乳浊液;如______加到水中。
乳浊液静置后也会分层,所以它也是不________、不_________。
(3)如果物质分散到水中后,能变成单个的分子或离子,这种物质就能________(填溶于或不溶于)水,并形成透明的溶液;如食盐、________、________等物质加到水中。
溶液静置后不会分层,所以它______、_______。
二、合作助学乳化在油与水的混合物里加点洗洁精,油珠就会被分的更小,比较均匀地悬浮在水中,形成的仍然是乳浊液。
请思考下列说法正确的是(填写序号)。
(提示:植物油能溶解于汽油)①油与水形成的混合物属于乳浊液②在油污上加点乳化剂,油会被分的更小,这样油污就容易被水冲洗掉③在油水混合物里加点乳化剂后,乳浊液就会变成溶液④洗涤剂刷碗、洗头膏洗头等利用了乳化原理⑤用汽油可以洗去衣服上的油污,这也是利用乳化现象三、拓展导学物质溶于水时伴随能量变化如氢氧化钠(NaOH)溶于水,溶液的温度________;硝酸铵(NH4NO3)溶于水,溶液的温度;而食盐(NaCl)、蔗糖溶于水,溶液的温度基本。
加快固体溶解的方法(1)不断;(2)升高;(3)把固体。
水溶液的某些性质(1)酸碱盐的水溶液都能导电。
例如,食盐(属于盐)、硫酸(属于酸)、氢氧化钠(属于碱)的溶液都能导电,这是因为酸碱盐溶于水时产生了_________的。
蔗糖溶液、酒精溶液不导电,因为蔗糖、酒精溶于水时______产生自由移动的离子。
第六章溶解现象第一节物质在水中的一、溶解1、定义:一种或几种物质分散到另一种物质里形成的均一、稳定的混合物2、特征:均一性:溶液内各部分性质完全相同稳定性:外界条件不变时(即温度或压强不改变,溶剂不蒸发),溶液长时间放置不会分层,也不会析出固体物质;混合物:至少包含两种物质3、说明:均一稳定的不一定是溶液,如水、酒精等溶液不一定是无色的,如FeCl3溶液是黄色的,KMnO4溶液是紫红色的4、溶液的微观形成过程:溶质分子(或离子)在溶剂分子的作用下扩散到溶剂中的过程,溶质在溶液中以分子或离子的形式均一地分散在溶剂中,如图NaCl溶于水的微观过程5、水溶液的某些性质:导电性,一些物质在水中溶解时能生成自由移动的离子,使溶液能够导电,例如食盐水、硫酸溶液、氢氧化钠溶液;蔗糖溶于水后,以分子形式存在与水中,不能形成自由移动离子,因此蔗糖水溶液很难导电二、溶液形成中的能量变化1、物质的溶解过程扩散过程(了解):溶质的分子(或离子)向水中扩散,这一过程吸收热量如:硫酸铵水合过程(了解):溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)这一过程放出热量如:硫酸、氢氧化钠、氧化钙与水反应放热溶于水温度不变的物质:氯化钠三、乳化现象1、乳浊液:小液滴分散到液体里形成的混合物;特点:不稳定,静置分层2、悬浊液:一种物质以固体小颗粒的形态分散到液体里形成的不均一、浑浊的混合物,如泥与水混合用力振荡后得到的不均一、不稳定、不透明的液体就是悬浊液;悬浊液不稳定,静置一段时间后,其中的固体小颗粒会沉淀下来,故悬浊液可用过滤法分离3、乳化(1)概念:洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强的现象(2)乳化作用在生活中的应用→洗涤:用乳化剂(洗涤剂)可以将衣服、餐具上的油污洗掉→农药的使用:将农药加入一定量的乳化剂后,再溶解在有机溶剂里,混合均匀后制成的透明液体叫乳油→生活中常用的乳化剂有肥皂、洗洁精等乳化现象第二节溶液组成的表示一、溶质的组成1、溶质:被溶解的物质(溶质可以是固体、液体、气体)溶剂:起溶解作用的物质(通常是水,也可以是其他液体,如:酒精、汽油、氯仿等)溶液:溶解了某种溶质的混合物判断溶质、溶剂:(1)若气体、固体溶于液体,则气体、固体为溶质,液体为溶剂;如食盐水、高锰酸钾溶液、盐酸(2)若液体溶于液体,质量少的为溶质,质量多的为溶剂;如碘酒(3)有水存在的溶液,无论水多少,水都为溶剂;如酒精溶液(4)如有化学反应,则应根据反应情况判断溶质、溶剂二、溶质浓度的表示——溶质质量分数1、定义:溶质质量与溶液质量之比2、表达式:溶质的质量分数= =溶液的质量(g)=溶液的体积(mL)×溶液密度(g。