动力学 习题1
- 格式:ppt
- 大小:169.00 KB
- 文档页数:30

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。

动力学练习题及解答动力学练习题及解答动力学练习题一:小球滑动题目:一个小球位于斜面上,斜面的角度为30度。
小球的质量为0.5kg,通过绳子与一个固定的点相连,绳子的长度为1m,小球从静止开始沿着斜面滑下。
设斜面上摩擦系数为0.2,重力加速度为10m/s²。
(1)求小球滑动的加速度。
(2)求小球滑动的摩擦力。
(3)求小球滑动时的速度。
解答:(1)小球在斜面上受到的合力为斜面上的重力分力与摩擦力之和,根据牛顿第二定律可得\(\Sigma F_x=ma_x \Rightarrow m \cdot a = m \cdot g \cdot sin(\Theta) - F_f = m \cdot g \cdot sin(\Theta) - \mu \cdot m \cdot g \cdot cos(\Theta). \)其中,\(\Theta\)为斜面角度,m为小球质量,g为重力加速度,\(\mu\)为摩擦系数。
代入数值可求得: \(a = g \cdot (sin(\Theta) - \mu \cdot cos(\Theta))\)代入数值可得:\(a = 10 \cdot (sin(30°) - 0.2 \cdot cos(30°)) ≈5.317m/s²\)(2) 小球的摩擦力为:\(F_f = \mu \cdot m \cdot g \cdot cos(\Theta)\)代入数值可得:\(F_f = 0.2 \cdot 0.5 \cdot 10 \cdot cos(30°) ≈ 0.86N\)(3) 小球在滑动过程中会不断加速,因此速度随时间的增加而增加。
根据运动学中的公式可以计算速度\(v\):\( v = v_0 + a \cdot t\)由题可知小球从静止开始滑动,即\(v_0 = 0\),代入数值可得:\(v = 0 + 5.317 \cdot t\)。

化学动力学基础(一、二)习题一、选择题:1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分答案:(B)2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2(B) t1=t2(C) t1﹤t2(D) 不能确定二者关系答案:(B)3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级(B) 一级反应(C) 三级反应(D) 二级反应答案:(B )4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例:(A)提高反应温度(B) 降低反应温度(C) 延长反应时间(D) 加入适当的催化剂答案:C5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则(A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C(B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C(C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C(D)dC D/dt=-K A3C A C C答案:(B)6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1,反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,K2/ K1=(3 t1/2’ C0’/2 t1/2” C0”2)则(A) Ⅰ为零级, Ⅱ为二级(B) Ⅰ为一级,Ⅱ为三级(C) Ⅰ为二级, Ⅱ为零级(D) Ⅰ为二级, Ⅱ为三级答案:(D)7、某反应, 以㏒(-dC/dt) 对㏒C作图得直线, 如果该反应为二级, 则直线的(A)截距=2 (B) 截距=0.3010(C) 斜率=2 (D) 截距/斜率=2答案:(C)8、微观可逆性原则不适用的反应是(A)H2+I2=2HI (B)Cl+Cl=Cl2(C)C12H22O11(蔗糖)+H2O=C6H12O6(葡萄糖)+ C6H12O6(果糖)(D)CH3COOC2H5+OH-=CH3COO-+C2H5OH答案:(A)9、理想气体双分子反应A+B→产物, 反应温度600K, 阈能95KJ.mol-1, 活化能97.5 KJ.mol-1, 其有效碰撞分数是(A)3.25×10-9 (B)5.36×10-9(C)0.606 (D)9.03×10-20答案:(B)10、一基元反应, 正反应的活化能是逆反应活化能的2倍, 反应时吸热120 KJ.mol-1, 正反应的活化能是(A) 120 KJ.mol-1 (B) 240 KJ.mol-1(C) 360 KJ.mol-1(D) 60 KJ.mol-1答案:(B)11、对自由基参加的反应A·+ BD→产物, 已知摩尔等压反应热为-90KJ.mol-1, B—D键能为210 KJ.mol-1, 则逆反应的活化能为:(A)105 KJ.mol-1 (B)153 KJ.mol-1(C)300 KJ.mol-1 (D)101.5 KJ.mol-1答案:(D)12、若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997 (C) K1/K2=1.00 (D) K1/K2=3.33答案:(D)13、对反应A+B→C, 由下列数据C A0/mol.dm-3C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B2答案:(C)14、理想气体反应A+B→(AB)→产物, E a与活化焓△H⊙的关系为:(A) E a=△H⊙+RT (B) E a=△H⊙+2RT(C) E a=△H⊙-RT (D) E a=△H⊙-2RT答案:(B)15、在对峙反应A+B→C+D中加入催化剂时, 那么(A) K1增大K-1增大K1/ K-1增大(B) K1增大K-1减小K1/ K-1增大(C) K1增大K-1增大K1/ K-1不变(D) K1增大K-1增大K1/ K-1减小答案:(C)16、已知25℃时, △f G m⊙(HCl,g)=-92.30 KJ.mol-1, 化学反应H2(g)+C l2(g)→2HCl(g)(25℃)在催化剂作用下, 可大大加快反应速率, 则反应的△r G m⊙(25℃)为:(A) -92.30 KJ.mol -1 (B) -184.6 KJ.mol -1(C) -228.4KJ.mol -1 (D) 不能确定答案:(B)17、作为载体, 以下那种说法是错误的(A) 提高催化剂的强度 (B) 可与催化剂生成稳定的化合物(C) 改善催化剂的热稳定性 (D) 改善催化剂的导热性答案:(B)18、 液相反应的简单机理如下:A+B →[AB]→生成物其中[AB]称为:(A) 中间产物 (B) 活化络合物 (C) 缔合体 (D) 遭遇对答案:(D)19、设某反应机理为:11(k k A B C -+快速平衡) 2k B+D E+F →(慢) 则其速率常数为:(A)K= K 2 (B) K= K 1 K 2/ K -1 (C) K= K 1 / K -1 (D) K= K 1 ﹒ K -1答案:(B)20、对光化反应,下列说法不正确的是:(A) 光化反应的各个基元步骤的速率都与光强度有关(B) 光化反应初级过程的量子效率必等于1(C) 光化反应的活化能来源于光能(D) 光化反应初级过程,1个光子活化1个原子或分子答案:(A )21、对于均相基元反应A=2B ,下列方程中不正确的是(A) -dC A /dt=KC A (B) dC B /dt=KC A (C) d §/Vdt=K A C A (D) 1/2(d §/Vdt=KC A 答案(B )22、关于催化剂的作用,下列说法中不正确的是(A) 催化剂能改变反应途径 (B) 催化剂能改变反应的速率(C) 催化剂能改变体系的始末态 (D) 催化剂能改变反应的活化能答案(C)23、若反应速率常数的量纲是:[浓度]·[时间]-1,则该反应是:(A)三级反应 (B)二级反应 (C) 一级反应 (D) 零级反应答案(D)24、对一级反应,反应物浓度C 与时间t 的关系是:(A) 以1/C 对t 作图为直线 (B) 以C 对t 作图为直线(C) 以㏑C 对t 作图为直线 (D) 以C 对1/t 作图为直线答案(C)25、对基元反应的以下说法中,不正确的是:(A) 只有基元反应才有反应分子数可言(B) 基元反应的活化能才有明确的物理意义(C) 基元反应是质量作用定律建立的基础(D) 从微观上考虑,基元反应一定是双分子反应答案(D)26、关于基元反应的过渡状态有下列说法(1) 过渡状态是反应途径上活化能的最高点(2) 过渡状态是势能面上能量最高的状态(3) 过渡状态是一个反应途径中反应物分子组能量最高的状态(4) 过渡状态就是活化络合物所处的状态其中正确的是:(A)(1) (2) (B)(3) (4) (C) (1) (3) (D)(2) (4)答案(C)27、验证某一反应机理是否正确,首先必需(A) 根据拟定机理导出的速率浓度关系与实验结果是否一致(B) 用仪器确认是否有自由基存在(C) 根据拟定的各基元反应活化能估算得到的总活化能与实验值相符(D) 确定中间产物的浓度答案(A)28、按碰撞理论,双分子反应的频率因子与(A) T成正比 (B) T 无关(C) T1/2成正比 (D) T3/2成正比答案(C)29、H2和O2反应可产生爆炸,其原因是:(A)H2和O2之比正好为2:1 (B) 直链反应速率快(C)反应热不能及时传递散走 (D) 支链反应速率快答案(D)30、若双分子反应A+B→C+D的速率方程为V=K[A]a[B]b,则一定有(A) a+b=2 (B) a+b﹤2 (C) a+b﹥2 (D) a+b﹤2或 a+b=2答案(D)二、问答题1、复杂反应的表观活化能一定等于组成复杂反应的各基元反应活化能代数和,这种说法对吗?为什么?2、微观可逆性原理只适用于基元反应,这种说法对吗?为什么?3、过渡状态理论的基本假设是什么?4、 H2和O2可产生爆炸,其原因是什么?5、碰撞数与温度、分子相对平动速度、与分子大小,与分子浓度的乘积成正比,这种说法对吗?为什么?6、从拟定的反应机理来确定速率与浓度的关系,可采用什么方法?7、对于双分子反应A+B→产物,阈能和Arrhenius活化能的关系为E c=E a+nRT,则n的值为多少?8、影响化学反应速率常数的因素有那些?9、哈柏法制氨过程的催化剂是什么?10、请写出一级反应,二级反应,三级反应的速率常数的量纲。

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。

化学动力学基础(一、二)习题一、选择题:1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分答案:(B)2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2(B) t1=t2(C) t1﹤t2(D) 不能确定二者关系答案:(B)3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级(B) 一级反应(C) 三级反应(D) 二级反应答案:(B )4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例:(A)提高反应温度(B) 降低反应温度(C) 延长反应时间(D) 加入适当的催化剂答案:C5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则(A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C(B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C(C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C(D)dC D/dt=-K A3C A C C答案:(B)6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1,反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,K2/ K1=(3 t1/2’ C0’/2 t1/2” C0”2)则(A) Ⅰ为零级, Ⅱ为二级(B) Ⅰ为一级,Ⅱ为三级(C) Ⅰ为二级, Ⅱ为零级(D) Ⅰ为二级, Ⅱ为三级答案:(D)7、某反应, 以㏒(-dC/dt) 对㏒C作图得直线, 如果该反应为二级, 则直线的(A)截距=2 (B) 截距=0.3010(C) 斜率=2 (D) 截距/斜率=2答案:(C)8、微观可逆性原则不适用的反应是(A)H2+I2=2HI (B)Cl+Cl=Cl2(C)C12H22O11(蔗糖)+H2O=C6H12O6(葡萄糖)+ C6H12O6(果糖)(D)CH3COOC2H5+OH-=CH3COO-+C2H5OH答案:(A)9、理想气体双分子反应A+B→产物, 反应温度600K, 阈能95KJ.mol-1, 活化能97.5 KJ.mol-1, 其有效碰撞分数是(A)3.25×10-9 (B)5.36×10-9(C)0.606 (D)9.03×10-20答案:(B)10、一基元反应, 正反应的活化能是逆反应活化能的2倍, 反应时吸热120 KJ.mol-1, 正反应的活化能是(A) 120 KJ.mol-1 (B) 240 KJ.mol-1(C) 360 KJ.mol-1(D) 60 KJ.mol-1答案:(B)11、对自由基参加的反应A·+ BD→产物, 已知摩尔等压反应热为-90KJ.mol-1, B—D键能为210 KJ.mol-1, 则逆反应的活化能为:(A)105 KJ.mol-1 (B)153 KJ.mol-1(C)300 KJ.mol-1 (D)101.5 KJ.mol-1答案:(D)12、若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997 (C) K1/K2=1.00 (D) K1/K2=3.33答案:(D)13、对反应A+B→C, 由下列数据C A0/mol.dm-3C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B2答案:(C)14、理想气体反应A+B→(AB)→产物, E a与活化焓△H⊙的关系为:(A) E a=△H⊙+RT (B) E a=△H⊙+2RT(C) E a=△H⊙-RT (D) E a=△H⊙-2RT答案:(B)15、在对峙反应A+B→C+D中加入催化剂时, 那么(A) K1增大K-1增大K1/ K-1增大(B) K1增大K-1减小K1/ K-1增大(C) K1增大K-1增大K1/ K-1不变(D) K1增大K-1增大K1/ K-1减小答案:(C)16、已知25℃时, △f G m⊙(HCl,g)=-92.30 KJ.mol-1, 化学反应H2(g)+C l2(g)→2HCl(g)(25℃)在催化剂作用下, 可大大加快反应速率, 则反应的△r G m⊙(25℃)为:(A) -92.30 KJ.mol -1 (B) -184.6 KJ.mol -1(C) -228.4KJ.mol -1 (D) 不能确定答案:(B)17、作为载体, 以下那种说法是错误的(A) 提高催化剂的强度 (B) 可与催化剂生成稳定的化合物(C) 改善催化剂的热稳定性 (D) 改善催化剂的导热性答案:(B)18、 液相反应的简单机理如下:A+B →[AB]→生成物其中[AB]称为:(A) 中间产物 (B) 活化络合物 (C) 缔合体 (D) 遭遇对答案:(D)19、设某反应机理为:11(k k A B C -+快速平衡) 2k B+D E+F →(慢) 则其速率常数为:(A)K= K 2 (B) K= K 1 K 2/ K -1 (C) K= K 1 / K -1 (D) K= K 1 ﹒ K -1答案:(B)20、对光化反应,下列说法不正确的是:(A) 光化反应的各个基元步骤的速率都与光强度有关(B) 光化反应初级过程的量子效率必等于1(C) 光化反应的活化能来源于光能(D) 光化反应初级过程,1个光子活化1个原子或分子答案:(A )21、对于均相基元反应A=2B ,下列方程中不正确的是(A) -dC A /dt=KC A (B) dC B /dt=KC A (C) d §/Vdt=K A C A (D) 1/2(d §/Vdt=KC A 答案(B )22、关于催化剂的作用,下列说法中不正确的是(A) 催化剂能改变反应途径 (B) 催化剂能改变反应的速率(C) 催化剂能改变体系的始末态 (D) 催化剂能改变反应的活化能答案(C)23、若反应速率常数的量纲是:[浓度]·[时间]-1,则该反应是:(A)三级反应 (B)二级反应 (C) 一级反应 (D) 零级反应答案(D)24、对一级反应,反应物浓度C 与时间t 的关系是:(A) 以1/C 对t 作图为直线 (B) 以C 对t 作图为直线(C) 以㏑C 对t 作图为直线 (D) 以C 对1/t 作图为直线答案(C)25、对基元反应的以下说法中,不正确的是:(A) 只有基元反应才有反应分子数可言(B) 基元反应的活化能才有明确的物理意义(C) 基元反应是质量作用定律建立的基础(D) 从微观上考虑,基元反应一定是双分子反应答案(D)26、关于基元反应的过渡状态有下列说法(1) 过渡状态是反应途径上活化能的最高点(2) 过渡状态是势能面上能量最高的状态(3) 过渡状态是一个反应途径中反应物分子组能量最高的状态(4) 过渡状态就是活化络合物所处的状态其中正确的是:(A)(1) (2) (B)(3) (4) (C) (1) (3) (D)(2) (4)答案(C)27、验证某一反应机理是否正确,首先必需(A) 根据拟定机理导出的速率浓度关系与实验结果是否一致(B) 用仪器确认是否有自由基存在(C) 根据拟定的各基元反应活化能估算得到的总活化能与实验值相符(D) 确定中间产物的浓度答案(A)28、按碰撞理论,双分子反应的频率因子与(A) T成正比 (B) T 无关(C) T1/2成正比 (D) T3/2成正比答案(C)29、H2和O2反应可产生爆炸,其原因是:(A)H2和O2之比正好为2:1 (B) 直链反应速率快(C)反应热不能及时传递散走 (D) 支链反应速率快答案(D)30、若双分子反应A+B→C+D的速率方程为V=K[A]a[B]b,则一定有(A) a+b=2 (B) a+b﹤2 (C) a+b﹥2 (D) a+b﹤2或 a+b=2答案(D)二、问答题1、复杂反应的表观活化能一定等于组成复杂反应的各基元反应活化能代数和,这种说法对吗?为什么?2、微观可逆性原理只适用于基元反应,这种说法对吗?为什么?3、过渡状态理论的基本假设是什么?4、 H2和O2可产生爆炸,其原因是什么?5、碰撞数与温度、分子相对平动速度、与分子大小,与分子浓度的乘积成正比,这种说法对吗?为什么?6、从拟定的反应机理来确定速率与浓度的关系,可采用什么方法?7、对于双分子反应A+B→产物,阈能和Arrhenius活化能的关系为E c=E a+nRT,则n的值为多少?8、影响化学反应速率常数的因素有那些?9、哈柏法制氨过程的催化剂是什么?10、请写出一级反应,二级反应,三级反应的速率常数的量纲。

化学动力学基础(一)一、简答题1.反应Pb(C 2H 5)4=Pb+4C 2H 5是否可能为基元反应为什么2.某反应物消耗掉50%和75%时所需要的时间分别为t 1/2和 t 1/4,若反应对该反应物分别是一级、二级和三级,则t 1/2: t 1/4的比值分别是多少3.请总结零级反应、一级反应和二级反应各有哪些特征平行反应、对峙反应和连续反应又有哪些特征4.从反应机理推导速率方程时通常有哪几种近似方法各有什么适用条件5.某一反应进行完全所需时间时有限的,且等于kc 0(C 0为反应物起始浓度),则该反应是几级反应6. 质量作用定律对于总反应式为什么不一定正确7. 根据质量作用定律写出下列基元反应速率表达式:(1)A+B→2P(2)2A+B→2P(3)A+2B→P+2s(4)2Cl 2+M→Cl 2+M8.典型复杂反应的动力学特征如何9.什么是链反应有哪几种 10.如何解释支链反应引起爆炸的高界限和低界限11.催化剂加速化学反应的原因是什么二、证明题1、某环氧烷受热分解,反应机理如下:稳定产物−→−⋅+⋅+⋅−→−⋅++⋅−→−⋅⋅+⋅−→−43213433k k k k CH R CH R CH RH CO CH R H R RH证明反应速率方程为()()RH kc dtCH dc =4 2、证明对理想气体系统的n 级简单反应,其速率常数()n c p RT k k -=1。
三、计算题1、反应2222SO Cl SO +Cl →为一级气相反应,320℃时512.210s k --=⨯。
问在320℃加热90min ,22SO Cl 的分解百分数为若干[答案:%]2、某二级反应A+B C →初速度为133105---⋅⋅⨯s dm mol ,两反应物的初浓度皆为32.0-⋅dm mol ,求k 。
[答案:11325.1---⋅⋅=s mol dm k ]3、781K 时22H +I 2HI →,反应的速率常数3-1-1HI 80.2dm mol s k =⋅⋅,求2H k 。
化学反应动力学练习题一、计算题1.340K 时N 2O 5分解反应有如下实验数据求60s 内和120s 到240s 的平均速率。
2.某基元反应A(g)+2B(g)D(g)+E(g),某温度下,将一定量的A 和B 通入一定体积的容器中。
(1)当A 和B 各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl 2 (g) COCl 2有下列实验数据求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O 52NO 2+21O 2速率常数随温度变化的实验数据如下,求该反应的活化能。
5.反应CO(CH2COOH) 2 CH 3COCH 3+2CO 2,在283K 时速率常数k 为 6.48×10-3 mol 〃L -1〃min -3,在333K 时速率常数k 为3.29mol 〃L -1〃min -1。
求303K时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol〃L-1,cB=0.3mol〃L-1时的反应速率为0.72mol〃L-1〃s-1,若温度不变增大反应物浓度,使 cA=1.2mol〃L-1,cB=0.6mol〃L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol〃L-1,c(O2)=0.080 mol〃L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
试计算C2H6(g) 的压强为1.33×104 Pa 时的起始分解速率υ9.295K时,反应 2 NO + Cl2→ 2 NOCl,反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程。
习题1.1 气瓶容积0.15m3,在303K时,瓶中氧气的压强是5×106N/m 2,求气瓶中氧气的重量。
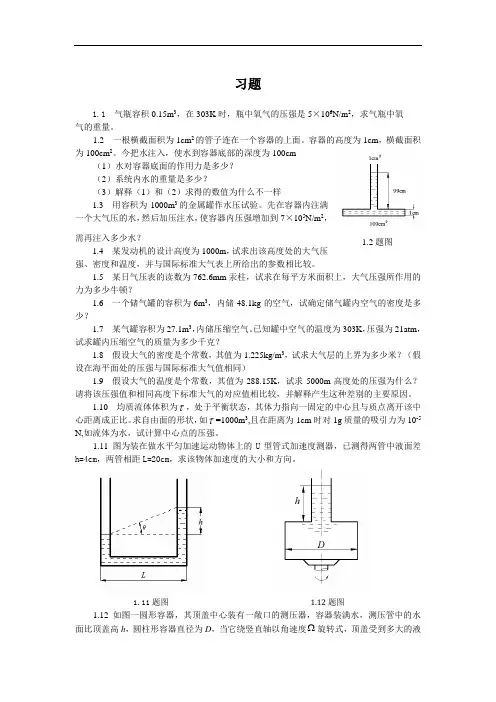
1.2 一根横截面积为1cm2的管子连在一个容器的上面。
容器的高度为1cm,横截面积为100cm2。
今把水注入,使水到容器底部的深度为100cm(1)水对容器底面的作用力是多少?(2)系统内水的重量是多少?(3)解释(1)和(2)求得的数值为什么不一样1.3 用容积为1000m3的金属罐作水压试验。
先在容器内注满一个大气压的水,然后加压注水,使容器内压强增加到7×105N/m2,需再注入多少水?1.2题图1.4 某发动机的设计高度为1000m,试求出该高度处的大气压强、密度和温度,并与国际标准大气表上所给出的参数相比较。
1.5 某日气压表的读数为762.6mm汞柱,试求在每平方米面积上,大气压强所作用的力为多少牛顿?1.6 一个储气罐的容积为6m3,内储48.1kg的空气,试确定储气罐内空气的密度是多少?1.7某气罐容积为27.1m3,内储压缩空气。
已知罐中空气的温度为303K,压强为21atm,试求罐内压缩空气的质量为多少千克?1.8 假设大气的密度是个常数,其值为1.225kg/m3,试求大气层的上界为多少米?(假设在海平面处的压强与国际标准大气值相同)1.9 假设大气的温度是个常数,其值为288.15K,试求5000m高度处的压强为什么?请将该压强值和相同高度下标准大气的对应值相比较,并解释产生这种差别的主要原因。
1.10 均质流体体积为τ,处于平衡状态,其体力指向一固定的中心且与质点离开该中心距离成正比。
求自由面的形状,如τ=1000m3,且在距离为1cm时对1g质量的吸引力为10-5 N,如流体为水,试计算中心点的压强。
1.11 图为装在做水平匀加速运动物体上的U型管式加速度测器,已测得两管中液面差h=4cm,两管相距L=20cm,求该物体加速度的大小和方向。
1.11题图 1.12题图1.12 如图一圆形容器,其顶盖中心装有一敞口的测压器,容器装满水,测压管中的水面比顶盖高h,圆柱形容器直径为D,当它绕竖直轴以角速度Ω旋转式,顶盖受到多大的液体向上总压力? 1.13 设有一质量力场2222222,2,2x y F y yz z F z xz x Fz x xy y λμν=++=++=++,其中,,λμν均为参数,问,,λμν去何数值时,在上述力场作用下的流体才有可能达到平衡。

物理化学(二)练习1(化学动力学)2014级一、选择题( 共15题)1-1. 反应A k1B (I);Ak2D (II),已知反应I 的活化能E1大于反应II 的活化能E2,以下措施中哪一种不能改变获得B 和D 的比例?(A) 提高反应温度(B) 延长反应时间(C) 加入适当催化剂(D) 降低反应温度1-2. 如果某反应的△r H m= 100kJ·mol-1,那么活化能E a将:(A) E a≠100kJ·mol-1(B) E a≥100kJ·mol-1(C) E a≤100kJ·mol-1(D) 都可以1-3. 2A k1产物上述反应对A 为二级,下列何者对时间作图可得一直线,且直线斜率等于速率常数k?(A) 2[A](B) [A]2(C) 1/[A](D) 1/[A]21-4. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度:(A) 成正比(B) 成反比(C) 平方成反比(D) 无关1-5.此反应的速率方程为:(A) r = k c B(B) r = k c A c B(C) r = k c A(c B)2(D) r = k c A1-6.400 K 时,某气相反应的速率常数k p= 10-3(kPa)-1·s-1,如速率常数用k C表示,则k C应为:(A) 3.326 (mol·dm-3)-1·s-1(B) 3.0×10-4 (mol·dm-3)-1·s-1(C) 3326 (mol·dm-3)-1·s-1(D) 3.0×10-7 (mol·dm-3)-1·s-11-7. 均相反应A + B k1C +D , A + Bk2E +F 在反应过程中具有∆[C]/∆[E] = k1/k2的关系,∆[C],∆[E] 为反应前后的浓差,k1,k2是反应(1),(2)的速率常数。

第十一章化学动力学基础1练习题第十一章化学动力学基础(1)练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10. 下列说法是否正确:(1) H2+I2=2HI 是2 分子反应;(2) 单分子反应都是一级反应,双分子反应都是二级反应。
;(3) 反应级数是整数的为简单反应(4) 反应级数是分数的为复杂反应。
11.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
12.若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下k 1一 定小于k 2。
13.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
14.对平衡反应A Y ,在一定温度下反应达平衡时,正逆反应速率常数相等。
15.平行反应C B A 21−→−−→−kk ┤,k 1/k 2的比值不随温度的变化而变化。
16.复杂反应的速率取决于其中最慢的一步。
17.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
18.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O 2 2O 3,其速率方程 -d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t = k '[O 3]2[O 2],那 么k 与k '的关系是:(A) 2k = 3k ' ; (B) k = k ' ; (C) 3k = 2k ' ; (D) ½k = ⅓k ' 。
1.速率方程:速率方程不浮上固体及水的浓度;气体反应物可用分压代替浓度;k-速率常数质量作用定律:对于基元反应:mA+nB→C2. 影响化学反应速率的因素内因:反应物的本性;外因:(1)浓度/分压升高,单位体积分子数增多,单位体积活化分子数增多;(2)催化剂,可降低活化能(3)温度升高,一方面使分子能量普遍升高;另一方面还可以使碰撞次数增多,有效碰撞增多.3. 封闭体系、恒温恒压、只做体积功时,自发反应总是朝着Gibbs自由能减小方向举行,至△rGm=0达平衡,体系自由能降至最小值△rGm<0 正向自发反应;△rGm>0逆向自发反应△G=△H-T△S例一:有基元反应,A+B=C ,下列讲述准确的是( )A. 此反应为一级反应B. 两种反应物中,无论哪一种的浓度增强一倍,都将使反应速度增强一倍C. 两种反应物的浓度同时减半,则反应速度也将减半D. 两种反应物的浓度同时增大一倍,则反应速度增大两倍例二:对于反应速度常数k ,下列说法准确的是( )A. 速度常数值随反应物浓度增大而增大;B. 每个反应惟独一个速度常数;C. 速度常数的大小与浓度有关;D. 速度常数随温度而变化;例三:某化学反应在任何温度下都可以自发举行,此反应需满意的条件是:(A )∆H<0, ∆S>0; (B )∆H>0, ∆S<0;(C )∆H>0, ∆S>0; (D )∆H<0, ∆S<0例四:对于一个化学反应,下列各组中关系准确的是:ΘΘΘΘm m ΘΘΘΘm m (A) ΔrG >0, K <1; (B) ΔrG >0, K <1;(C) ΔrG <0, K =1; (D) ΔrG <0, K <1;例一:答案B 利用基元反应化学反应速率方程式求解例二:答案D 速率常数与温度、活化能、指前因子A有关例三:答案A ∆G=∆H-T∆S<0 能自发举行例四:答案A。
化学动力学练习题(一)填空题1 .物理吸附的吸附热与气体的 相近。
2 .基元反应 H.+Cl 2 —> HCl + Cl-的反应分子数是为100kJ.mol -i 和70 k 『mol -i ,当反应在1000 K 进行时,两个反应的反应速率 系(常)数之比幺=。
k24 .复合反应 2A 点产 B 「口 Y 其 —d c A = ______________________________________ ;" 山以= ;g=。
d t d t5 .将反应物A 和B 置于抽空密闭容器中于等温等容下进行气相反应 3 A +B — 2Y ,此反应的—d P (总)=( )d P (Y )。
d t ---------- d t6 .对元反应 A _JU 2Y,贝U d cj d t = ___ ,一d cj d t = ______ 。
YA.7 .对反应A —P ,实验测得反应物的半衰期与与初始浓度c A ,0成反比,则该反应 为级反应。
8 .建立动力学方程式所需的实验数据是。
处理这些实验 数据以得到反应级数和反应速率常数,通常应用以下三种方法,即 法、 法和 法。
9 .对反应A - P ,反应物浓度的对数ln c A 与时间t 成线性关系,则该反应为 级反应。
10 .直链反应由三个基本步骤组成,即、、。
11 .质量作用定律只适用于 反应。
12 .某化合物与水相作用时,该化合物初浓度为1 mol ・dm -3, 1 h 后其浓度为0.8mol *dm -3, 2 h 后其浓度为0.6 mol *dm -3,则此反应的反应级数为, 此反应的反应速率系(常)数k =。
13 .气相基元反应2A - B 在一恒定的容器中进行,P 为A 的初始压力,P 为 o t反应1和反应2的指前因子(参量)相同,活化能分别3.平行反时间t 时反应体系的总压力,此反应的速率方程dP t / dt =14 .某化学反应在800 K 时加入催化剂后,其反应速率系(常)数增至500倍,如果 指前因子(参量)不因加入催化剂而改变,则其活化能减少。
一、选择题( 共50题99分)1. 2 分(5707)5707在反应A k1B k2C,A k3 D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择:( )(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度2. 2 分(5291)5291某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度:( )(A) 成正比(B) 成反比(C) 平方成反比(D) 无关3. 2 分(5288)5288某反应物反应掉7/8 所需的时间恰好是它反应掉1/2 所需时间的3 倍,则该反应的级数是:( )(A) 零级(B) 一级反应(C) 二级反应(D) 三级反应4. 2 分(5308)53082M →P 为二级反应,若M 的起始浓度为1 mol·dm-3,反应1 h后,M 的浓度减少1/2,则反应2 h后,M 的浓度是:( )(A) 1/4 mol·dm-3(B) 1/3 mol·dm-3(C) 1/6 mol·dm-3(D) 缺少k值无法求5. 2 分(5285)52852A k1产物上述反应对A 为二级,下列何者对时间作图可得一直线,且直线斜率等于速率常数k?( )(A) 2[A](B) [A]2(C) 1/2[A](D) 1/[A]6. 2 分(5776)5776反应 A + BC →AB + C 的焓变∆r H m> 0,A ,C 是自由基,εAB ,εBC是分子AB,BC 的摩尔键焓。
以下哪个关系式可以近似估算该反应的活化能E a?( )(A) 0.055εAB(B) 0.055εAB+ ∆r H m(C) 0.055εBC(D) 0.055εBC- ∆r H m7. 2 分(5276)5276水溶液反应Hg2++ Tl3+─→2Hg2+ + Tl+的速率方程为2r = k[Hg2+][Tl3+]/[Hg2+]。
化学反应动力学练习题一、计算题1.340K时N2O5分解反应有如下实验数据时间0 60 120 180 240c (N2O5)/mol·L-10.160 0.113 0.080 0.056 0.040求60s内和120s到240s的平均速率。
2.某基元反应A(g)+2B(g) D(g)+E(g),某温度下,将一定量的A和B通入一定体积的容器中。
(1)当A和B各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl2 (g) COCl2有下列实验数据时间初始速率/mol-1·ls-1 CO Cl20.100.10 1.20×10-20.0500.10 6.00×10-30.0500.050 2.13×10-3求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O52NO2+21O2速率常数随温度变化的实验数据如下,求该反应的活化能。
T/K273 298 308 318 328 338k/s-17.87×10-7 3.46×10-5 1.35×10-4 4.98×10-4 1.50×10-3 4.87×10-35.反应CO(CH2COOH)2CH3COCH3+2CO2,在283K时速率常数k为 6.48×10-3 mol·L-1·min-3,在333K时速率常数k为3.29mol·L-1·min-1。
求303K 时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol·L-1,cB=0.3mol·L-1时的反应速率为0.72mol·L-1·s-1,若温度不变增大反应物浓度,使 cA=1.2mol·L-1,cB=0.6mol·L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:初始浓度/mol·L-1初始速率/mol·L-1·s-1 c(NO)C(O2)1 2 30.0200.0100.0100.0200.0200.0102.0×10-25.0×10-32.5×10-3(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol·L-1,c(O2)=0.080 mol·L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
动力学练习1与答案-05级(化学、高分子)一、选择题1.反应A k1B (I);Ak2D (II),已知反应I 的活化能E1大于反应II 的活化能E2,以下措施中哪一种不能改变获得B 和D 的比例?( )(A) 提高反应温度(B) 延长反应时间(C) 加入适当催化剂(D) 降低反应温度2 如果某反应的△r H m= 100kJ·mol-1,那么活化能E a将:( )(A) E a≠100kJ·mol-1(B) E a≥100kJ·mol-1(C) E a≤100kJ·mol-1(D) 都可以3. 2A k1产物上述反应对A 为二级,下列何者对时间作图可得一直线,且直线斜率等于速率常数k?( )(A) 2[A](B) [A]2(C) 1/[A](D) 1/[A]24. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度:( )(A) 成正比(B) 成反比(C) 平方成反比(D) 无关5.此反应的速率方程为:( )(A) r = k c B(B) r = k c A c B(C) r = k c A(c B)2(D) r = k c A6. 400 K 时,某气相反应的速率常数k p= 10-3(kPa)-1·s-1,如速率常数用k C表示,则 k C 应为: ( )(A) 3.326 (mol ·dm -3)-1·s -1(B) 3.0×10-4 (mol ·dm -3)-1·s -1(C) 3326 (mol ·dm -3)-1·s -1(D) 3.0×10-7 (mol ·dm -3)-1·s -17. 均相反应 A + B k 1 C + D , A + B k 2 E + F 在反应过程中具有 ∆[C]/∆[E] = k 1/k 2的关系, ∆[C],∆[E] 为反应前后的浓差,k 1,k 2是反应 (1),(2)的速率常数。