2019高考化学大一轮复习第二章化学物质及其变化第8讲氧化还原反应方程式的配平及计算课件鲁科版
- 格式:ppt
- 大小:2.62 MB
- 文档页数:11

高考化学一轮复习目录第一章化学计量在实验中的应用第1讲物质的量、气体摩尔体积第2讲物质的量浓度第二章化学物质及其变化第1讲物质的组成、性质及分类第2讲离子反应离子方程式第3讲氧化还原反应的基本概念第4讲氧化还原反应的规律和应用第三章金属及其化合物第1讲碱金属元素——钠第2讲铁及其化合物第3讲镁及其化合物第4讲铝及其化合物第四章常见的非金属及其化合物第1讲无机非金属材料的主角——硅第2讲富集在海水中的元素——氯第3讲硫及其化合物第4讲氮的氧化物和硝酸第5讲氨和铵盐第五章物质结构与元素周期律第1讲元素周期表第2讲元素周期律第3讲化学键第六章化学反应中的能量变化电化学第1讲化学反应中的能量变化实验探究:中和热的测定第2讲原电池化学电源第3讲电解池金属的电化学腐蚀与防护第七章化学反应速率和化学平衡第1讲化学反应速率第2讲化学反应的方向和限度第3讲化学平衡移动第八章水溶液中的离子平衡第1讲弱电解质的电离平衡第2讲水的电离和溶液的酸碱性第3讲盐类的水解第4讲难溶电解质的溶解平衡第九章认识有机化合物第1讲有机物的结构特点和分类第2讲研究有机化合物的方法第十章烃第1讲脂肪烃第2讲芳香烃第十一章烃的衍生物第1讲卤代烃第2讲醇酚第3讲醛羧酸酯第十二章基本营养物质、高分子化合物第1讲基本营养物质第2讲进入合成有机高分子化合物的时代第十三章化学实验基础第1讲化学实验基础知识实验探究:“仪器改造”与“一器多用”第2讲物质的检验、分离和提纯第3讲实验方案的设计与评价第4讲探究性化学实验。

教学资料参考范本【2019-2020】高考化学一轮综合复习第2章化学物质及其变化课时4 氧化还原反应的综合应用——配平、计算及滴定题型冲关练习撰写人:__________________部门:__________________时间:__________________1.已知aM2++bO2+4H+===cM3++dH2O,则化学计量数c的值为( )A.1 B.2C.3 D.4解析根据质量守恒可得a=c;根据电荷守恒可得2a+4=3c,解得c=4,选项D正确。
答案D2.含有a mol FeBr2的溶液中,通入x mol Cl2。
下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( ) A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-B.x=0.6a,2Br-+Cl2===Br2+2Cl-C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-解析根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。
x=0.4a时,Cl2不能完全氧化Fe2+,只能发生反应2Fe2++Cl2===2Fe3++2Cl-,A项正确;当x=0.6a时,Cl2能将Fe2+完全氧化后,又能氧化的Br-,故B错误;x=a时,Cl2氧化Fe2+后又能氧化a mol的Br-,C正确;x=1.5a时,Cl2能将Fe2+、Br-完全氧化,D正确。
答案B3.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )A.1∶6B.1∶7C.2∶11D.16∶25解析设参加反应的FeS的物质的量为a mol,被还原的HNO3的物质的量为b mol,根据得失电子守恒有:a×(1+8)=×1+×2+×3,b=6a,又因为起酸性作用的HNO3的物质的量为3n[Fe(NO3)3]=3×(a-×2)mol=a mol,故实际参加反应的FeS与HNO3的物质的量之比为a∶(a+b)=1∶7。



第二章 化学物质及其变化第一讲 物质的组成、性质和分类考点1 物质的组成与分类一、元素、微粒及物质间的关系1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
2.元素:具有相同核电荷数(即质子数)的一类原子的总称。
3.元素与物质的关系元素A――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物4.元素在物质中的存在形态(1)游离态:元素以单质形式存在的状态。
(2)化合态:元素以化合物形式存在的状态。
5.混合物和纯净物(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
6.同素异形体(1)同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同 ,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(2)同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化,但不属于氧化还原反应。
7.元素、微粒及物质间的关系图二、物质的分类1.交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)2.树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。
考点2物质的性质与变化一、物质的性质与变化二、单质、氧化物、酸、碱、盐的转化关系1.理解物质转化关系图2.形成转化关系一条线:(氢化物→)单质→氧化物→酸或碱→盐。
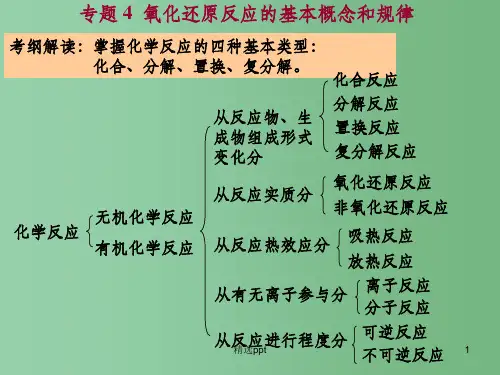
三、化学反应的分类化学反应⎩⎪⎪⎪⎨⎪⎪⎪⎧按反应物、生成物种类及数目多少分为⎩⎪⎨⎪⎧化合反应分解反应置换反应复分解反应按反应中有无离子参与分为⎩⎪⎨⎪⎧离子反应非离子反应按反应中有无电子转移分为⎩⎪⎨⎪⎧氧化还原反应非氧化还原反应按反应进行的程度和方向分为⎩⎪⎨⎪⎧可逆反应不可逆反应按反应的能量变化分为⎩⎪⎨⎪⎧吸热反应放热反应四、物质变化中的“三馏”“四色”“五解”和“十八化”归类考点3分散系与胶体一、分散系1.概念:把一种(或多种)物质(分散质)分散在另一种(或多种)物质(分散剂)中所得到的体系。




一、选择题1.(2019·邢台期末)中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO 3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用的KNO 3的性质是( )A .自燃性B .稳定性C .还原性D .氧化性解析:选D 。
火药爆炸的反应原理为2KNO 3+S +3C=====点燃K 2S +N 2↑+3CO 2↑,反应中N 元素化合价降低,KNO 3为氧化剂,故反应中利用了KNO 3的氧化性,D 项正确。
2.固体硝酸盐加热易分解且产物较复杂。
某学习小组以Mg(NO 3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是( )A .Mg(NO 2)2、O 2B .MgO 、NO 2、O 2C .Mg 3N 2、O 2D .MgO 、NO 2、N 2解析:选D 。
A 、B 、C 三项中均有化合价的升降,符合氧化还原反应发生的条件;D 项中由于产物中化合价只有降低,没有升高,不满足氧化还原反应的特征。
3.(2017·高考海南卷)在酸性条件下,可发生如下反应:ClO -3+2M 3++4H 2O===M 2O n -7+Cl -+8H+,M 2O n -7中M 的化合价是( )A .+4B .+5C .+6D .+7解析:选C 。
根据离子方程式中,反应前后电荷守恒,可得6-1=8-n -1,解得n =2,M 2O 2-7中M 的化合价为+6价,故C 正确。
4.下列实验中,颜色的变化与氧化还原反应有关的是( )A .向紫色石蕊试液中加入盐酸,溶液变红B .饱和FeCl 3溶液在沸水中变成红褐色胶体C .向FeSO 4溶液中滴加NaOH 溶液,生成的沉淀由白色迅速变成灰绿色,最后变成红褐色D .SO 2使滴有酚酞的NaOH 溶液褪色解析:选C 。
向FeSO 4溶液中滴加NaOH 溶液,首先得到白色沉淀Fe(OH)2,Fe(OH)2迅速与空气中的O 2发生氧化还原反应得到红褐色的Fe(OH)3。
