分析化学:第9章 沉淀平衡和沉淀滴定法
- 格式:ppt
- 大小:2.61 MB
- 文档页数:78

第五节沉淀滴定法教学目的:1、掌握沉淀滴定法对反应的要求。
2、掌握银量法确定理论终点的方法原理。
3、明确分级沉淀及沉淀转化的概念。
4、理解测定氯化物的条件。
教学重点与难点:莫尔法(铬酸钾作指示剂)作为教学重点教学内容:一、方法简介沉淀滴定法(precipitationtitration):也称容量分析法(volumetricprecipitationmethod),以沉淀反应为基础的滴定分析方法。
用作沉淀滴定的沉淀反应必须满足以下条件:(1)反应速度快,生成沉淀的溶解度小;(2)反应按一定的化学式定量进行;(3)有准确确定理论终点的方法。
应用范围:含量在1%以上的卤素化合物和硫氰化物的测定。
解释:沉淀反应很多,但能用于沉淀滴定的沉淀反应并不多,因为很多沉淀的组成不恒定,或溶解度较大,或形成过饱和溶液,或达到平衡速度慢,或共沉淀现象严重等。
目前比较有实际意义的是生成微溶性银盐的沉淀反应。
Ag++Cl-=AgClJAg++SCN-二AgSCNJ以这类反应为基础的沉淀滴定法称为银量法。
主要测定Cl-、Br-、I-、Ag+及SCN-等。
如有一些沉淀HgS、PbSO4、BaSO4等也可用于沉淀滴定法,但重要性不及银量法。
二、银量法确定理论终点的方法{莫尔法佛尔哈德法法杨司法1、莫尔法什么是莫尔法?以铬酸钾作指示剂的银量法称为“莫尔法”。
以铬酸钾为指示剂,在中性或弱碱性介质中,用硝酸银标准溶液测定卤素化合物含量。
(1)指示剂作用原理:Ag++Cl-AgCl!白Ksp(Agci)=1.8X10-9Ag++GO42-—Ag2CrO4!橙色Ksp止工小=2X10-12因为AgCl和Ag2CrO4的溶度积不同,因而发生分级沉淀,当AgCl沉淀完全后,稍过量的AgNO3标准溶液与K2CrO4指示剂反应生成Ag2CrO4!砖红色(量少时为橙色)。
平衡时,[Ag+]・[C1-]=Ksp AgC i设溶液中[Cl-]=[CrO4]2-=0.1mol/LKsp AgCl1.8X10-10[Ag+]AgC i===1.8X10-9(mol/L)[Cl-]0.1Ksp(Ag2CrO4)2X10-12[Ag+j===必X10-6(mo l/L)[CrO42-]0.1由此可见:[Ag+][Cl-]首先大于Ksp A gCl,则AgCl开始沉淀。

沉淀平衡A09环工陈瑞摘要:物质在水中的溶解是一个复杂的过程。
一定温度下,把难溶强电解质放入水中,就会发生溶解和沉淀两个相反的过程。
当溶解的速度和沉淀的速度相等时,便达到了平衡状态。
溶解平衡通常用活度积或溶度积表示。
影响沉淀平衡的因素有,同离子效应,盐效应,酸效应,配位效应。
关键词:平衡活度积溶度积影响因素物质在水中的溶解作用是一个较复杂的物理—化学过程。
绝对不溶的物质是没有的。
通常把溶解度小于0.01g/100gH2O的物质叫做不溶物,严格来说,应该叫做难溶物或薇溶物。
上述界限也不是绝对的。
如PbCl(s),Ag Cl(s)等类物质,虽然溶解度很小,但溶解的部分是完全电离的,溶液中不存在未电离的分子,故也常称为难溶物电解质或简称其为难溶盐。
一定温度下,把难溶强电解质放入水中,就会发生溶解和沉淀两个相反的过程。
当溶解的速度和沉淀的速度相等时,便达到了平衡状态。
这时的溶液是饱和溶液。
此时溶液中的离子浓度(严格讲,应是活度)不再改变。
对任何沉淀—溶解达到平衡的系统可表示为Mm An=mM+n+nA-m,KΘSP={a(M+n)}m{a(A-m)}n,KΘSP称为活度积。
严格地说,难溶化合物在水中的溶解平衡MA(s)=M++A-,应以活度表示:a M++a A-= KΘSP (1),KΘSP称为难溶化合物的活度积。
它只是与温度有关的标准平衡常数,不受溶液中离子强度的影响。
根据活度的定义(为简便计写作以下形式):a+=γ+m+/mΘ,a-= γ-m-/mΘ带入活度积表达式(1)中,(m+/ mΘ)γ+(m-/mΘ)γ-= KΘSP(mΘ=1mol/kg)。
令(m+)(m-)=Ksp(2),Ksp称为溶度积,则上式成为Ksp = KΘSP(mΘmΘ/γ+γ-)(3),就是Ksp与KΘSP的关系,它们之间有差别。
由于在活度系数项中,活度系数γ与离子强度有关(即与溶液所有离子的浓度有关),所以Ksp不仅与温度有关,还与溶液中所有离子浓度有关。
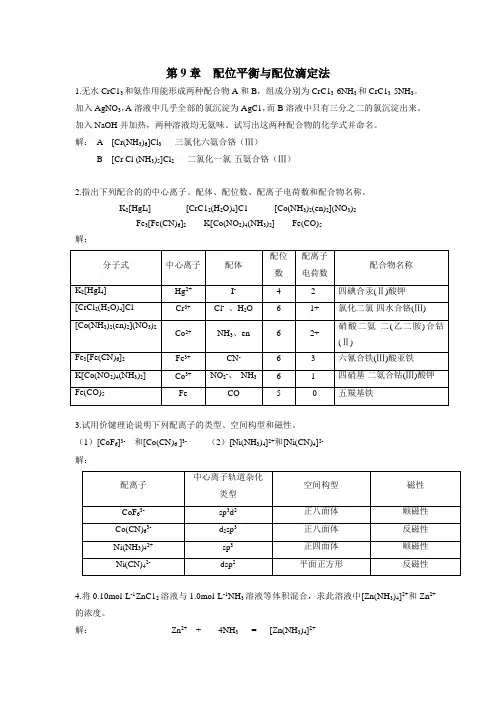
第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成分别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全部的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将0.10mol·L-1ZnC12溶液与1.0mol·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解:Zn2++ 4NH3= [Zn(NH3)4]2+平衡浓度/mol·L -1 x 0.5-4×0.05+4x ≈0.3 0.05-x ≈0.0594342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=2.13×10-9mol·L -15.在100mL0.05mol·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 0.05 0.01 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在0.1mol·L -1氨水中的溶解度。



无机与分析化学习题—沉淀溶解平衡和沉淀滴定法一、单项选择题在每小题的四个备选答案中选出一个正确答案,并将其字母标号填入括号内。
1.金属硫化物中,有的溶于HCl ,有的不溶于HCl 。
主要原因是它们的 ()A . 水 解 能 力 不同B . K 不 同C . 溶 解 速 率 不 同D . 酸 碱 性 不 同2.欲使Mg (OH)2 溶解,可加入 ()A . NH 4 Cl B . NaCl C . NH 3 ·H 2 O D . NaOH3.硫化铜不可以溶于HCl ,而硫化锌可以溶于HCl ,主要原因是它们的()A . 水解能力不同 B . K 不同C . 溶解速率不同D . 酸碱性不同4.已知K ( PbI 2 ) = 7.1 ⨯ 10-9,则其饱和溶液中c ( I - ) = ( )A . 8.4 ⨯ 10-5 mol ·L -1B . 1.2 ⨯ 10-3 mol ·L -1C . 2.4 ⨯ 10-3 mol ·L -1D . 1.9 ⨯ 10-3 mol ·L -15.已知K ( BaSO 4 ) = 1.1 ⨯ 10-10,K (AgCl ) = 1.8 ⨯ 10-10,等体积的0.002 mol ·L -1 Ag 2SO 4与2.0 ⨯ 10-5 mol ·L -1BaCl 2溶液混合,会出现 ( )A . 仅有BaSO 4沉淀B . 仅有AgCl 沉淀C . AgCl 与BaSO 4共沉淀D . 无沉淀6.设AgCl 在水中,在0.01mol·L -1 CaCl 2中, 在0.01mol·L -1 NaCl 中以及在0.05 mol·L -1 AgNO 3 中的溶解度分别是 S 0, S 1, S 2, S 3, 这些量之间的正确关系是 ( )A . S 0> S 1> S 2> S 3B . S 0> S 2> S 1> S 3C . S 0> S 1= S 2> S 3D . S 0> S 2> S 3> S 17.欲使Mn(OH)2 溶解,可加入 ( )A .(NH 4 )2SO 4B . NaOHC . NH 3 ·H 2 OD .NaCl8.难溶电解质CaCO 3在浓度为0.1 mol ⋅L -1的下列溶液中的溶解度比在纯水中的溶解度大的有( )A .Ca(NO 3)2B .HAcC . Na 2CO 3D . Ca(NO 3)29.难溶强电解质AB 2 在水中平衡时〔A 2+〕= x mol / L ,〔B -〕= y mol / L ,下列AB 2 的溶解度(mol / L )表达错误的是 ( )A . xB . 1/2yC . 2yD . (1/4 xy 2)1/310.为使锅垢中难溶于酸的CaSO 4转化为易溶于酸的CaCO 3,常用Na 2CO 3处理,反应式为 CaSO 4+ CO 32-CaCO 3+SO 42-,此反应的标准平衡常数为 ( )A . K (CaCO 3 ) / K (CaSO 4 )B . K (CaSO 4 ) / K (CaCO 3 )C . K (CaSO 4 )·K (CaCO 3 )D . [ K (CaSO 4 )·K (CaCO 3 ) ]1/211.将MnS 溶解在HAc - NaAc 缓冲溶液中,系统的pH 值( )A . 不变B .变小C .变大D . 无法预测12.在AgCl 饱和溶液中,加入少量的NaCl 固体,下列描述正确的是 ()A .AgCl 的溶解度不受影响 B .AgCl 的溶解度变小C.AgCl的K sp变小D.AgCl的K sp变大13.已知CaCO3的摩尔质量为100g·mol-1,若将50 mL 0.80 mol·L-1 Na2CO3和50 mL0.40 mol·L-1 CaCl2混合,所生成CaCO3沉淀的质量为()A.1.0 g B.4.0 g C.2.0 g D.8.0 g 14.已知K(BaSO4)=1.1⨯10-10,K(BaCO3 )=5.1⨯10-9,下列判断正确的是()A.因为K(BaSO4 ) <K(BaCO3 ) ,所以不能把BaSO4转化为BaCO3+ CO32-BaCO3 + SO42-的标准平衡常数很小,所以实际上B.因为BaSOBaSO4沉淀不能转化为BaCO3 沉淀C.改变CO32-浓度,能使溶解度较小的BaSO4沉淀转化为溶解度较大的BaCO3沉淀D.改变CO32-浓度,不能使溶解度较小的BaSO4沉淀转化为溶解度较大的BaCO3沉淀15.已知K(CaC2O4) = 4.0 ⨯ 10-9,若在c ( Ca2+ ) = 0.020 mol·L-1的溶液生成CaC2O4沉淀,溶液中的c ( C2O42- )最小应为()A.4.0 ⨯ 10-9B.2.0 ⨯ 10-7 mol·L-1C.2.0 ⨯10-9 mol·L-1D.8.0 ⨯10-11 mol·L-116.下列沉淀中,可溶于1 mol·L-1NH4Cl 溶液中的是( )A.Fe (OH)3 ( K= 4 ⨯ 10-36 )B.Mg (OH)2 ( K= 1.8 ⨯ 10-11 )C.Al (OH)3( K= 1.3 ⨯10-33)D.Cr(OH)3( K= 6.3 ⨯10-31)二、填空题1.在AgCl、CaCO3、Fe(OH)3等物质中,溶解度不随溶液pH值而变的是⎽⎽⎽⎽⎽⎽⎽⎽⎽,Mg(OH)2在稀盐酸溶液中溶解的离子方程式为⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。



沉淀滴定法氯化钠引言沉淀滴定法是一种常用的分析化学方法,用于测定溶液中特定物质的含量。
本文将重点介绍沉淀滴定法在氯化钠测定中的应用。
实验原理沉淀滴定法是通过将待测物与适当试剂反应生成可观察到的沉淀,并利用滴定法确定待测物的含量。
在氯化钠测定中,常用的试剂是银硝酸(AgNO3)溶液。
实验原理如下: 1. 氯化钠与银离子反应生成白色沉淀:NaCl + AgNO3 → AgCl↓ + NaNO3。
2. 利用标准铬酸钾溶液(K2CrO4)作为指示剂,当所有氯化钠被反应完后,多余的银离子与铬酸根离子反应生成红色络合物:Ag+ + CrO4^2- →AgCrO4↓。
3. 通过滴加银硝酸溶液至颜色由橙红转变为红褐色来判断反应终点。
实验步骤试样处理1.取一定量的待测溶液(含氯化钠)加入烧杯中。
2.加入适量盐酸(HCl)溶液,使溶液酸性增强。
3.加入过量的铬酸钾溶液,使氯化钠与铬酸根离子反应生成沉淀。
滴定过程1.取一定量的标准银硝酸溶液(AgNO3),用滴定管滴加至溶液中。
2.每滴加一滴后搅拌均匀,并观察颜色变化。
3.当颜色由橙红色转变为红褐色时,表示反应终点已达到。
计算结果1.记录滴定所需的标准银硝酸溶液体积(V)。
2.根据已知的银硝酸和氯化钠的反应方程式,计算出待测样品中氯化钠的含量。
实验注意事项1.实验操作时要戴上防护眼镜和实验手套,避免试剂溅到皮肤或眼睛。
2.滴定过程中需要搅拌均匀,以确保反应充分。
3.滴定管在滴加试剂时要垂直放置,避免液滴附着在管壁上。
4.实验前需要进行准确的容量测量和试剂配制,以确保结果的准确性。
实验结果与讨论通过沉淀滴定法测定氯化钠的含量,可以得到样品中氯化钠的浓度。
实验中,通过观察颜色变化来判断反应终点,并计算出滴定所需的标准银硝酸溶液体积。
根据已知的反应方程式和体积数据,可以计算出样品中氯化钠的含量。
实验结果可能会受到实验操作、试剂质量等因素的影响。
为了提高实验结果的准确性,可以进行多次重复实验,并取平均值作为最终结果。

第九章沉淀滴定法一、莫尔(Mohr)法1. 莫尔法测定Cl-采用滴定剂及滴定方式是(B )(A)用Hg2+盐直接滴定(B)用AgNO3直接滴定(C) 用AgNO3沉淀后,返滴定(D)用Pb2+盐沉淀后,返滴定2. 下列试样中的氯在不另加试剂的情况下,可用莫尔法直接测定的是( D )(A) FeCl3(B) BaCl2(C) NaCl+Na2S (D) NaCl+Na2SO43. 用莫尔法测定Cl-的含量时,酸度过高,将使(Ag2CrO4不易形成,不能确定终点),碱性太强,将生成(生成褐色Ag2O,不能进行测定)。
4.关于以K2CrO4为指示剂的莫尔法,下列说法正确的是(C )(A)指示剂K2CrO4的量越少越好(B)滴定应在弱酸性介质中进行(C)本法可测定Cl—和Br—,但不能测定I—或SCN—(D)莫尔法的选择性较强二、佛尔哈德(Volhard)法5.(√)佛尔哈德法是以NH4SCN为标准滴定溶液,铁铵矾为指示剂,在稀硝酸溶液中进行滴定。
6. 佛尔哈德法测定Ag+时, 应在(酸性)(酸性,中性), 这是因为(若在中性介质中,则指示剂Fe3+水解生成Fe(OH)3,影响终点观察)。
7.(×)用佛尔哈德法测定Ag+,滴定时必须剧烈摇动。
用返滴定法测定Cl-时,也应该剧烈摇动。
8.以铁铵矾为指示剂,用返滴法以NH4CNS标准溶液滴定Cl-时,下列错误的是(D )(A)滴定前加入过量定量的AgNO3标准溶液(B)滴定前将AgCl沉淀滤去(C)滴定前加入硝基苯,并振摇(D)应在中性溶液中测定,以防Ag2O析出三、法扬司(Fajans)法9.( √ )在法扬司法中,为了使沉淀具有较强的吸附能力,通常加入适量的糊精或淀粉使沉淀处于胶体状态。
10. 卤化银对卤化物和各种吸附指示剂的吸附能力如下: 二甲基二碘荧光黄>Br ->曙红>Cl ->荧光黄。
如用法扬司法测定Br -时, 应选(曙红或荧光黄)指示剂;若测定Cl -,应选(荧光黄)指示剂。

⽆机及分析化学第9章习题解答第九章化学分析法习题解答习题9-11. 能⽤于滴定分析的化学反应必须具备哪些条件?解①反应要定量完成,没有副反应伴⽣。
②反应速率要快,或有简便的⽅法加速反应。
③有可靠、简便的⽅法指⽰滴定终点。
2. 基准物应具备哪些条件?基准物的称量范围如何估算?解基准物质必须具备以下条件:①试剂的纯度⾜够⾼,含量在99.9%以上,⼀般使⽤基准试剂或优级纯试剂。
②物质组成与化学式完全相符,若含有结晶⽔,其结晶⽔含量应与化学式相符。
③性质稳定,不易和空⽓中的O 2或CO 2等作⽤,不易发⽣风化和潮解。
④最好具有较⼤的相对分⼦量,可减⼩称量误差。
其称量范围是要计算使标准溶液消耗体积控制在20~30mL 之间所需基准物的质量。
3. 下列物质中那些可以⽤直接法配制标准溶液?那些只能⽤间接法配制?24422732232H SO , KOH, KMnO , K Cr O , KIO , Na S O 5H O ?4. 什么是滴定度?滴定度与物质的量浓度如何换算?解滴定度(T )指每毫升标准溶液所相当的待测物的质量,以符号T 待测物/滴定剂表⽰,单位为g ?mL 1-。
若a A~b B ,则两种浓度之间的换算关系为:3A/B B A 10a T c M b-=?。
5. 什么是“等物质的量的规则”,运⽤时基本单元如何选取?解当待测组分A 与滴定剂B 的基本单元选取适当时,两组分所相当的物质的量相等,此规则称为等物质的量的规则。
若a A~b B ,A 与B 之间等物质的量的关系为:11A B n()=n()b a。
其⼀般的选择原则如下:酸碱滴定中,基本单元的选取以⼀个质⼦转移为基准;配位滴定中,以与EDTA 等物质的量反应为基准;氧化还原滴定中,以⼀个电⼦的转移为基准。
6. 已知浓硝酸的相对密度为 1.42,含3HNO 约为70%,求其物质的量浓度。
如欲配制 1.0L 、130.25mol L HNO -?溶液,应取这种浓硝酸多少毫升?解 (1)31000 1.4270/100(HNO )1663.01c ??==(1mol L -?) (2)330.25 1.010(HNO )1616V ??==(mL) 7. 已知密度为1.051g mL -?的冰醋酸(含HAc99.6%),求其物质的量浓度。
沉淀滴定法的原理沉淀滴定法是一种常用的分析化学方法,它主要用于测定溶液中某种特定离子的含量。
这种方法通过加入沉淀剂,使目标离子与沉淀剂生成难溶的沉淀物,然后通过滴定的方式确定目标离子的含量。
下面我们来详细了解一下沉淀滴定法的原理。
首先,沉淀滴定法需要选择适当的沉淀剂。
沉淀剂通常是一种可以与目标离子反应生成难溶沉淀物的化合物,它必须具有良好的选择性和灵敏度。
选择适当的沉淀剂是沉淀滴定法成功的关键。
其次,沉淀滴定法的原理是利用沉淀剂与目标离子在溶液中发生沉淀反应。
当沉淀剂与目标离子混合后,会生成难溶的沉淀物,这种沉淀物的生成是可逆的反应。
沉淀滴定法利用这种反应的平衡特性,通过滴定确定目标离子的含量。
在进行沉淀滴定时,首先需要将待测溶液与适量的沉淀剂混合,使沉淀物充分生成。
然后,用滴定管滴加一定量的沉淀剂,使生成的沉淀物完全沉淀。
在滴加过程中,需要使用指示剂来指示沉淀反应的终点,以确定滴定的终点。
沉淀滴定法的原理是基于化学平衡反应的原理。
在沉淀滴定过程中,沉淀物的生成是一个动态平衡过程,通过滴定可以确定反应的终点,从而计算出目标离子的含量。
因此,沉淀滴定法是一种精确的分析方法,可以用于测定不同离子的含量,具有广泛的应用价值。
总之,沉淀滴定法是一种重要的分析化学方法,它的原理是利用沉淀剂与目标离子在溶液中发生沉淀反应,通过滴定确定目标离子的含量。
选择适当的沉淀剂和合理的滴定条件是沉淀滴定法成功的关键。
沉淀滴定法在化学分析中具有重要的应用价值,对于研究和工业生产都具有重要意义。
希望本文能够帮助大家更好地理解沉淀滴定法的原理和应用。