2019-2020学年新教材鲁科版必修第二册 第1章第2节 元素周期律和元素周期表(第2课时) 学案
- 格式:doc
- 大小:353.50 KB
- 文档页数:5

06高一化学下学期学案第二节元素周期律和元素周期表元素周期表【学习目标】掌握元素周期表的结构1.2. 理解原子结构与元素周期表的关系【学习过程】一、元素周期表w.w.w.k.s.5.u.c.o.m 1. 元素周期表的编排原则递增的顺序从左到右排列(1)按相同的元素排成一个横行2()将相同的元素(He除外)排成一个纵列)把(3元素周期律是元素周期表的理论依据,元素周期表是元素周期律的具体表现形式交流研讨相同,从左到右,原子元素周期表中位于同一横行的元素的原子的相同递增;的最外层电子数从到位于同一列的元素的原子的层数依次增多。
,从上到下原子的(所以化学性质相似) 2. 元素周期表的结构列,七主七副)0 Ⅷ(3 七个周期横着看,三短三长一不全;纵看共有18 、周期,每周期所含元素种数、三短(12、3 、)(个周期7 三长、、、周期,每周期所含元素种数、周期,完全填满可包含元素种数为个横行)(7 一不全()主族(~族,共个)16个族副族(~个)族,共(18个纵列)、三个纵列)、Ⅷ族(0列,即稀有气体族)族(第几个概念3.种元素镧系元素位于第周期,包含种元素周期,包含锕系元素位于第周期元素和主族元素由周期元素组成,副族元素全部由周期元素组成。
106高一化学下学期学案~元素过渡元素包括元素周期表中第列,全部都是原子结构与元素周期表的关系4.=周期序数= 数主族序数= 数最高正价元素周期表中的信息5.、(1)每个方格中提供的信息有、、价电子排布、。
)元素周期表中所给的元素的相对原子质量是用该元素的各种同位素原子的相对(2区别于原子的相对原子质原子质量按照它们在自然界中的百分含量计算出的平均值,量。
)周期表分区(3 元素周期表还可对金属元素和非金属元素进行分区,沿着元素周期表中元素。
元素,右面是虚线的左面是与之间画一条虚线,表现质,又的某些,于位虚线附近的元素通常即表现性是工业上常用的半导体材料。
、Ge的某些性质。





【教材分析】本节是必修2的第二章第一节。
教材在学生已有知识的基础上,建立起化学键的概念,并以“化学键”为桥梁,引导学生从物质变化和能量变化两个角度认识化学反应,使学生懂得在物质发生化学变化的同时也伴随有能量的变化,从而为后面研究化学反应的利用奠定基础。
本节内容框架为:【教学目标】知识与技能目标1、通过了解化学键的含义及离子键和共价键的形成过程与形成条件,使学生更好地认识化学反应的本质。
2、通过了解化学键与物质构成的关系,增进学生对物质构成的认识。
3、让学生了解化学反应中伴随有能量的变化的实质和化学能与其他能量形式之间的转化。
过程与方法目标通过化学键、离子键、共价键的教学,在讨论、猜想、对比的学习过程中培养学生的想象能力和分析比较、归纳推理能力。
情感态度与价值观目标通过生产生活中的实例,了解化学能与热能的相互转化,认识提高燃料的燃烧效率,开发高能清洁能源的重要性,培养学生节约能源及保护环境的意识。
【教学重点、难点】1、化学键、离子键、共价键的含义。
2、对化学键与化学反应实质、化学反应能量的关系的理解。
【教学方法】讨论探究、分析推理、对比归纳等方法。
【教学用品】多媒体设备及课件、实验药品(稀NaOH、稀盐酸、锌粉、消石灰、氯化铵固体)、实验仪器(试管,小烧杯,玻璃片,温度计,镊子,胶头滴管,药匙,单孔塞)。
教学过程】第一课时第二课时附录1:分析表中所列化学反应中“断裂的键”和“形成的键”分别有哪些。
附录2:列表归纳比较共价键、离子键。
附录3:指出下列化合物内部的化学键类型和化合物的类别(离子化合物、共价化合物)。
附录4:。
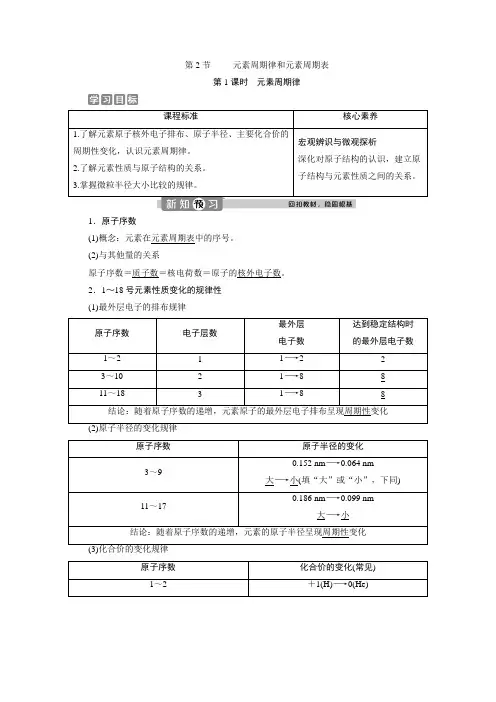
第2节元素周期律和元素周期表第1课时元素周期律课程标准核心素养1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律。
2.了解元素性质与原子结构的关系。
3.掌握微粒半径大小比较的规律。
宏观辨识与微观探析深化对原子结构的认识,建立原子结构与元素性质之间的关系。
1.原子序数(1)概念:元素在元素周期表中的序号。
(2)与其他量的关系原子序数=质子数=核电荷数=原子的核外电子数。
2.1~18号元素性质变化的规律性(1)最外层电子的排布规律原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~2 1 1―→2 2 3~10 2 1―→8 8 11~18 3 1―→8 8 结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化原子序数原子半径的变化3~90.152 nm―→0.064 nm大―→小(填“大”或“小”,下同)11~17 0.186 nm―→0.099 nm大―→小结论:随着原子序数的递增,元素的原子半径呈现周期性变化原子序数化合价的变化(常见) 1~2 +1(H)―→0(He)3~10最高正价:+1―→+5 (O无最高正价、F无正价) 最低负价:-4―→-1Ne:011~18 最高正价:+1―→+7 最低负价:-4―→-1Ar:0结论:随着原子序数的递增,元素的化合价呈现周期性变化3.元素周期律(1)概念:元素的性质随着元素原子序数的递增而呈周期性变化的规律。
(2)实质:元素原子核外电子排布的周期性变化导致元素性质的周期性变化。
1.化合价与最外层电子数的关系(1)一般,元素最高正化合价=最外层电子数(O、F除外);最低负化合价=最外层电子数-8;|最高正化合价|+|最低负化合价|=8。
(2)常见元素化合价的特点①H元素:+1、-1、0价,如H2O、NaH、H2。
②F元素:-1、0价,如NaF、F2,氟元素无正价。
③O元素:常见有-2、-1、0价,如CaO、Na2O2、O2,氧元素无最高正价。




第2节元素周期律和元素周期表
第2课时元素周期表
课程标准核心素养
1.了解元素周期表的编排规则及结构特点。
2.能描述元素在元素周期表中的位置。
3.理解原子结构与元素在周期表中位置的关系。
证据推理与模型认知
构建“位”“构”“性”关系认
识模型;发展对元素及其化合物
化学性质的认识模型。
元素周期表的结构
1.元素周期表方格中的信息
2.元素周期表的结构
(1)元素周期表的编排原则
①横行
⎩⎪
⎨
⎪⎧电子层数相同的元素
由左到右最外层电子数递增
②纵列
⎩⎪
⎨
⎪⎧最外层电子数相同的元素
由上到下电子层数递增
(2)周期
周期
类别
周期
序数
起止元素
原子序数
包括元素种数
核外电子
层数短周期
1 1~
2 2 1
2 3~10 8 2
3 11~18 8 3
长周期
4 19~36 18 4
5 37~54 18 5
6 55~86 32 6
7 87~118 32 7
列
数
1 2 3 4 5 6 7 8 9 10 11 12 13 14
15 16 17 18 族
序
数
Ⅰ
A
Ⅱ
A
Ⅲ
B
Ⅳ
B
Ⅴ
B
Ⅵ
B
Ⅶ
B
Ⅷ
Ⅰ
B
Ⅱ
B
Ⅲ
A
Ⅳ
A
Ⅴ
A
Ⅵ
A
Ⅶ
A
0 类
别
主族副族Ⅷ族副族主族
族最
外
层
电
子
数
1 2 1~2(钯除外) 3 4 5 6 7
8(
H
e
为
2 )
1.元素周期表的结构:七主七副七周期,0族Ⅷ族镧锕系。
2.元素在周期表中位置的推断
(1)原子结构示意图法
(2)稀有气体原子序数(2、10、18、36、54、86、118)定位法
①比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和序数大的0族元素处于同一周期。
②求差值定族数
a.若原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
b.若原子序数比相应的0族元素少5~1时,则应处在同周期的ⅢA~ⅦA族。
c.若原子序数与相应的0族元素相差其他数,则由相应差找出相应的族。
1.判断正误
(1)最外层电子数是2的元素,都是ⅡA族元素。
()
(2)氧元素为第ⅥA族元素,故其最高正价为+6价。
()
(3)周期序数=原子的电子层数,主族序数=原子的最外层电子数。
()
(4)Fe元素位于周期表的ⅧB族。
()
(5)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。
()
答案:(1)×(2)×(3)√(4)×(5)×
2.(1)写出下列元素在周期表中的位置:
Na____________;Si____________;Cl____________;
K______________;Se____________;Br____________。
(2)据报道,某些花岗岩会产生氡(222 86Rn),而对人体产生伤害。
Rn的原子结构示意图为________________________________________________________________________,Rn在周期表中的位置是______________。
答案:(1)第3周期ⅠA族第3周期ⅣA族第3周期ⅦA族第4周期ⅠA族第4周期ⅥA族第4周期ⅦA族
(2)第6周期0族
3.X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。
已知X、Y、Z三种元素的质子数之和为40,请回答:
X
Y Z
(1)写出X、Y、Z
X________,Y________,Z________。
(2)写出Y在周期表中的位置:______________。
解析:(1)假设X的原子序数是a,则与X同一主族的下一周期元素的原子序数是a+8,Y的原子序数是a+9,Z的原子序数是a+10。
X、Y、Z三种元素的质子数之和为40,则a +a+9+a+10=40,a=7,所以X是N元素,Y是S元素,Z是Cl元素。
(2)S元素原子的核外电子排布是2、8、6,即元素原子核外有3个电子层,最外层有6个电子,因此在周期表中的位置是第3周期ⅥA族。
答案:(1)N S Cl(2)第3周期ⅥA族
ⅡA族、ⅤA族与过渡元素的性质
1.ⅡA族元素(碱土金属元素)的性质
元素铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra) 原子核外最外层电子数均为2,电子层数依次增多
电子排布
单质的
物理性质
均为亮白色固体、具有良好的导电性
化学性质均易失去最外层的2个电子,化学性质活泼,在自然界中都以化合态存在
2.焰色试验:多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,亦称焰色反应,这是金属元素的物理(填“物理”或“化学”)性质。
常见金属元素的焰色:钠元素为黄色、钾元素为浅紫色、钡元素为黄绿色、钙元素为砖红色、铜元素为蓝绿色。
[知识拓展]焰色试验的操作步骤
观察K的焰色时要透过蓝色钴玻璃,以滤去黄光,排除Na元素的干扰。
3.ⅤA族元素(氮族元素)的性质
元素氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)
原子核外
电子排布
最外层电子数均为5,电子层数依次增多化学性质得电子能力逐渐减弱,失电子能力逐渐增强
元素元素周期表中第3~12列(副族和Ⅷ族)中的元素,包括了大部分金属元素,如铁、铜、镍、银和金等
原子核外
电子排布
最外层电子数为1~2(钯除外)
单质的物理性质大部分单质既坚硬又有光泽,金、铜等单质具有独特的色泽;均具有良好的导电性
单质的化
学性质
多数单质比较稳定,与空气和水反应缓慢或根本不能反应1.下列有关ⅡA族和ⅤA族的说法正确的是()
A.两族元素在自然界中均无游离态
B.两族元素均含金属元素与非金属元素
C.“生命元素”N元素位于第2周期ⅤA族
D.“国防金属”Mg元素位于第2周期ⅡA族
解析:选C。
N元素存在游离态的N2,A错;ⅡA族只含金属元素(即Be、Mg、Ca、Sr、Ba、Ra),B错;N元素被称为“生命元素”,位于第2周期ⅤA族,C对;Mg被称为“国防金属”,位于第3周期ⅡA族,D错。
2.下列对砷(As)的有关判断正确的是()
A.砷原子序数为33,它与铝同主族
B.砷的原子半径小于磷的原子半径
C.剧毒药品砒霜的主要成分是As2O3,其中砷元素的化合价为+3价
D.砷原子的得电子能力比氮原子的得电子能力强
解析:选C。
砷与氮同主族,位于第ⅤA族,而铝位于第ⅢA 族,A错;砷与磷位于同一主族且在磷的下方,故原子半径砷大于磷,B错;由化学式As2O3可知砷的化合价为+3价,C对;砷与氮同主族且电子层数比氮多,故砷的得电子能力比氮的得电子能力弱,D错。
3.小明同学在灼烧下列物质时,记录了如下现象,你认为不正确的是()
A.Na2O—淡黄色
B.Cu(NO3)2—绿色
C.KCl—紫色(透过蓝色钴玻璃)
D.BaSO4—紫红色
解析:选D。
钡元素焰色试验为黄绿色。
课堂小结。