分子结构的基本知识
- 格式:pptx
- 大小:7.10 MB
- 文档页数:4

分子的知识点总结一、分子的概念分子是物质的基本单位,是一种由原子或原子团组成的结构,具有独立的化学和物理性质。
在化学反应中,分子是化学反应的参与者,是化学键的断裂和形成的基本单位。
分子的大小可以从简单的氢分子到复杂的蛋白质分子。
二、分子的结构1.分子的组成:分子由原子或原子团通过化学键连接而成,通常包括化学键、离子键和范德华力等。
2.分子的形状:分子的形状取决于原子之间的键角或键长度,包括线性、角形、三角形、四面体、六角形等,形状不同会影响化学性质和物理性质。
三、分子的性质1.物理性质:包括分子的颜色、气味、溶解性、沸点、熔点、电导率等。
2.化学性质:包括分子的化学稳定性、反应性、易溶性等,通常通过化学反应来体现。
四、分子的分类1.按组成原子类型:包括单质分子、化合物分子。
2.按分子结构类型:包括非极性分子、极性分子、离子分子等。
3.按原子数目分类:包括双原子分子、多原子分子等。
五、分子的剖析和合成1.分子的剖析:通过化学反应或物理手段将分子分解成原子或原子团的过程。
2.分子的合成:通过化学反应或物理手段将原子或原子团组合成分子的过程。
六、分子在生活和工业中的应用1.药物:许多药物是由分子组成的,包括抗生素、激素、维生素等。
2.材料:许多塑料、橡胶、纤维素等材料都是由分子组成的,其性质取决于分子的结构。
3.食品:食物中的脂肪、蛋白质、碳水化合物等都是由分子构成的,影响其口感、营养、保存等性质。
4.工业:很多化工产品,如肥料、涂料、制药等都是由分子组成的。
以上是对分子的知识点总结,分子是化学研究和应用的基本单位,深入了解分子的结构和性质对于理解化学反应和应用化学在生活中的意义至关重要。
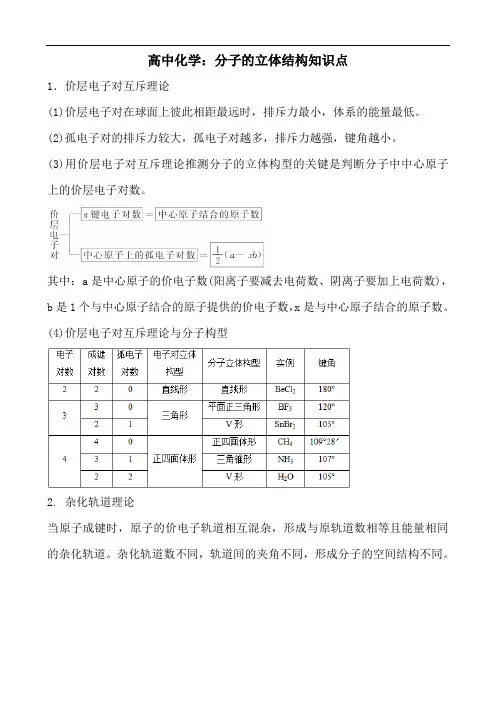
高中化学:分子的立体结构知识点1.价层电子对互斥理论(1)价层电子对在球面上彼此相距最远时,排斥力最小,体系的能量最低。
(2)孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
(3)用价层电子对互斥理论推测分子的立体构型的关键是判断分子中中心原子上的价层电子对数。
其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是1个与中心原子结合的原子提供的价电子数,x是与中心原子结合的原子数。
(4)价层电子对互斥理论与分子构型2. 杂化轨道理论当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。
杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
3.配位键(1)孤电子对分子或离子中没有跟其他原子共用的电子对称孤电子对。
(2)配位键①配位键的形成:成键原子一方提供孤电子对,另一方提供空轨道形成共价键。
②配位键的表示:常用“―→”来表示配位键,箭头指向接受孤电子对的原子,如NH4+可表示如下,在NH4+中,虽然有一个N—H键形成过程与其他3个N—H 键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
(3)配合物如[Cu(NH3)4]SO4配位体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。
中心原子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
【特别提示】(1)价层电子对互斥理论说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
①当中心原子无孤电子对时,两者的构型一致;②当中心原子有孤电子对时,两者的构型不一致。
如:中心原子采取sp3杂化的,其价层电子对模型为四面体形,其分子构型可以为四面体形(如CH4),也可以为三角锥形(如NH3),也可以为V形(如H2O)。
(2)价层电子对互斥理论能预测分子的几何构型,但不能解释分子的成键情况,杂化轨道理论能解释分子的成键情况,但不能预测分子的几何构型。

化学分子结构知识点化学分子结构是化学领域中的重要概念,它描述了化学物质中原子之间的连接方式和空间排列。
了解分子结构对于理解化学反应、性质和应用具有重要意义。
本文将介绍化学分子结构的基本概念和相关知识点。
首先,化学分子结构可以通过化学式来表示。
化学式是用化学符号表示化学物质中元素的种类和数量的一种方式。
例如,H2O表示水分子,其中H表示氢原子,O表示氧原子,数字2表示氢原子的个数。
化学式可以简洁地描述分子的组成,但并不能提供分子结构的详细信息。
其次,分子结构可以通过分子模型来展示。
分子模型是一种图形化的表示方法,用于展示分子中原子之间的连接方式和空间排列。
常见的分子模型有平面式、空间式和简化式等。
平面式将分子中的原子和化学键以平面图的形式展示,简化了分子的空间结构。
空间式则更加准确地展示了分子的三维结构,通过球体表示原子,以及线条或棍球模型表示化学键。
化学键是连接原子的力,它决定了分子的稳定性和性质。
常见的化学键包括共价键、离子键和金属键。
共价键是通过原子间的电子共享形成的,是最常见的化学键类型。
离子键是由正负电荷之间的相互吸引力形成的,常见于离子化合物中。
金属键是金属元素中原子之间的电子云重叠形成的,具有良好的导电性和热导性。
分子的空间排列对于化学反应和性质具有重要影响。
立体异构是指分子在空间中的不同排列方式,导致其化学性质的差异。
立体异构包括构象异构和光学异构。
构象异构是由于化学键的旋转或双键的顺反异构而导致的分子结构的不同。
光学异构是由于手性中心的存在而导致的分子结构的不对称性,使得分子存在镜像异构体。
化学分子结构的研究对于新药物的设计和合成、材料科学的发展以及环境保护等方面具有重要意义。
通过了解分子结构,科学家可以预测分子的性质和行为,从而指导实验和应用。
此外,化学分子结构的研究还有助于揭示物质的微观世界,深化对化学反应机理和分子间相互作用的理解。
总的来说,化学分子结构是化学领域中的重要概念,描述了化学物质中原子之间的连接方式和空间排列。

分子与细胞知识点总结一、分子的结构1.分子的基本概念①分子是由原子通过共价键或离子键连接而成的物质单位。
②分子是一般物质的基本单位,包括有机物质和无机物质。
2.分子的组成①分子由原子组成,原子是构成物质的最基本的微观粒子。
②分子的组成可以是单质原子(O2、N2等)、复合物质(H2O、CO2等)或者大分子化合物(蛋白质、核酸等)。
3.分子的性质①分子的性质由构成它的原子种类和结构决定。
②分子的性质包括物理性质(如颜色、溶解度等)和化学性质(如反应活性、稳定性等)。
二、细胞的结构1.细胞的基本概念①细胞是生物体的基本单位,是生命的基本组成部分。
②细胞是通过细胞分裂产生的,包括原核细胞和真核细胞两种类型。
2.细胞的组成①细胞包括细胞质、细胞膜、细胞核和细胞器等组成部分。
②细胞质包括细胞器和细胞器间质,其中细胞器主要包括内质网、高尔基体、核糖体、线粒体和叶绿体等。
3.细胞的功能①细胞的功能包括新陈代谢、生长、分裂、运动和自我调节等。
②细胞的功能是由细胞的结构和组成决定的,其中各个细胞器都有其特定的功能。
三、细胞膜的结构与功能1.细胞膜的结构①细胞膜是由磷脂双分子层和蛋白质组成的薄膜结构。
②细胞膜的磷脂双分子层包括疏水性头部和亲水性尾部,蛋白质可以是固定在磷脂层上方或者穿过整个膜的跨膜蛋白。
2.细胞膜的功能①细胞膜是细胞的保护壁,保持细胞内外环境的稳定。
②细胞膜是细胞的门控,对物质的进出进行选择性通透。
③细胞膜参与细胞间通讯和信号传递,调控细胞的生理和代谢活动。
四、细胞色素的结构与功能1.叶绿体的结构①叶绿体是植物细胞中的细胞器,具有双膜结构。
②叶绿体内包含叶绿体基质、叶绿体内膜系统和类囊体三个部分。
2.叶绿体的功能①叶绿体是光合作用的场所,其中的叶绿体基质包含叶绿体DNA和叶绿体RNA,可以进行光合作用产生ATP和NADPH。
②叶绿体还可以进行暗反应,将产生的ATP和NADPH用于CO2的固定和还原反应。

分子结构知识点总结化学一、分子的构成分子是物质的最小单元,由一个或多个原子通过共价键相互连接而成。
在分子中,原子的排列和连接方式决定了分子的性质。
分子的构成主要由原子的种类和数量决定。
不同种类的原子组合形成不同的分子,而相同种类的原子通过不同的连接方式也可以形成多种不同的分子。
例如,氧气分子由两个氧原子通过双键相连而成,水分子由一个氧原子和两个氢原子通过两个共价键相连而成。
二、分子的形状分子的形状是由原子间的排列和连接方式决定的,原子间的排列和连接方式受到原子之间的吸引力和排斥力的影响。
根据VSEPR理论(分子的价层电子对云模型),分子的形状是由分子中心原子周围的电子对的排布方式决定的。
根据VSEPR理论,分子的形状可以分为线性分子、三角平面分子、四面体分子、五面体分子等多种形状。
分子的形状直接影响着分子的性质,如分子的极性、电荷分布等。
三、共价键的理论与结构共价键是由原子之间的价电子对相互共享而形成的一种化学键。
共价键的理论通过描述共价键的生成原理和性质对化学反应的机理和过程进行了深入的研究。
根据共价键的理论,分子中的原子通过共价键连接在一起,形成了分子的稳定结构。
根据共价键的结构,可以将分子的形状、极性等性质进行详细的分析和预测。
四、分子结构的测定方法目前,研究人员通过多种方法来测定和研究分子的结构特性,主要包括X射线衍射、核磁共振、红外光谱等多种方法。
其中,X射线衍射是一种能够直接测定分子结构的方法,通过测定分子中原子之间的距离和角度等参数来确定分子的空间结构。
核磁共振可以通过测定分子中原子的核磁共振信号来分析分子中原子的排列和连接方式。
红外光谱可以通过分子吸收、散射不同波长的红外辐射来分析分子的化学键和结构。
总之,分子结构是化学领域中一个重要的研究课题,分子的构成、形状、共价键的理论和结构以及分子结构的测定方法都是理解和研究分子结构的重要知识点。
通过对这些知识点的深入研究,可以更好地理解化学反应的机理,并且为设计新的材料和药物提供理论基础。

分子结构知识点分子结构是有机化学中非常重要的概念。
了解分子结构可以帮助我们理解有机化合物的性质和反应规律。
本文将介绍分子结构的基本知识点,包括键的类型、原子的排列方式以及立体化学等内容。
1. 键的类型1.1 单键单键是最常见也是最简单的键类型。
它由两个原子之间的一个共用电子对组成。
常见的单键包括碳-碳单键、碳-氢单键等。
1.2 双键双键由两个原子之间的两个共用电子对组成。
双键比单键更强,因此分子中存在双键时,分子的化学性质通常更为活泼。
常见的双键有碳-氧双键、碳-氮双键等。
1.3 三键三键由两个原子之间的三个共用电子对组成。
三键是最强的键类型,通常具有较高的键能。
常见的三键有碳-碳三键、碳-氮三键等。
2. 原子的排列方式2.1 直链状分子直链状分子是指分子中的原子按照直线排列的情况。
这种排列方式在碳骨架中非常常见。
例如,丙烷(CH3CH2CH3)就是一种直链状分子。
2.2 支链状分子支链状分子是指分子中的原子按照分支的方式排列的情况。
这种排列方式能够增加分子的空间构型,从而影响分子的立体化学性质。
例如,异丁烷(CH3CH(CH3)CH3)就是一种支链状分子。
2.3 环状分子环状分子是指分子中的原子形成环状结构的情况。
这种排列方式能够使分子呈现出特殊的立体构型。
例如,环己烷(C6H12)就是一种环状分子。
3. 立体化学3.1 手性手性是指分子镜像异构体不能通过旋转重叠的现象。
手性分子非常常见,它们在自然界和生物体系中广泛存在。
为了描述手性分子的构型,我们引入了手性中心、手性碳等概念。
3.2 手性中心手性中心是指一个原子上连接着四个不同的基团。
手性中心的存在是手性分子的必要条件。
例如,丙氨酸中的C原子上连接着一个羧基、一个氨基、一个甲基和一个氢原子,因此这个C原子就是一个手性中心。
3.3 立体异构体立体异构体是指在化学结构上相同但在空间结构上不同的分子。
它们具有不同的物理和化学性质。
立体异构体分为两大类:构象异构体和对映异构体。

分子和结构知识点总结高中一、分子结构1. 分子的概念分子是由两个或更多原子以一定的比例结合而成的,具有一定的结构和化学性质的粒子。
2. 分子的组成分子的组成为原子,原子是构成物质的最小单位,由质子、中子和电子组成。
3. 分子的化学键分子中的原子通过共价键、离子键或金属键相互连接,在结构上构成了不同的化学键。
4. 分子的结构分子的结构包括三维空间构型和构象,三维空间构型是指原子在空间中的排列方式,构象是相同分子的结构在空间中的旋转方式。
二、分子的性质1. 分子的物理性质分子的物理性质包括分子的形状、大小、极性、熔点和沸点等。
2. 分子的化学性质分子的化学性质指的是分子参与化学变化的能力,包括分子间的化学反应、分子的稳定性和分子的反应性等。
三、分子的特性1. 构成分子的原子种类和数量决定了分子的结构和性质。
2. 分子中各个原子的排列和构型决定了分子的稳定性和化学性质。
3. 分子的形状和极性决定了分子的化学反应情况和物理性质。
四、分子的应用1. 化学工业中的分子结构在化学工业中,分子结构的知识被广泛应用于有机合成、材料制备和药物研发等方面。
2. 生物科学中的分子结构在生物科学中,分子结构的知识被应用于研究生物分子的结构和功能,生物分子的相互作用以及分子医学的发展。
3. 环境保护中的分子结构在环境保护中,分子结构的知识被应用于研究环境中有害物质的分子结构和降解方法,以及新型环保材料的开发。
五、分子结构的前沿领域1. 分子设计与合成分子设计与合成是化学领域的前沿研究之一,它以理论化学为基础,通过计算机模拟和实验验证,设计和合成具有特定结构和功能的新型分子。
2. 分子纳米科学分子纳米科学是一种跨学科的研究领域,研究对象是纳米尺度下的分子结构和功能,包括纳米材料的制备、性能和应用等方面。
3. 分子生物学分子生物学是生物学的一个重要分支,研究对象是生物大分子的结构、功能和相互作用,包括蛋白质、核酸和多肽等生物分子。

分子的空间结构知识点总结一、价层电子对互斥理论(VSEPR理论)1. 价层电子对的计算。
- 中心原子的价层电子对数=σ键电子对数+孤电子对数。
- 对于AB_n型分子,σ键电子对数= n(n为与中心原子结合的原子个数)。
- 孤电子对数=(1)/(2)(a - nb),其中a为中心原子的价电子数,b为与中心原子结合的原子最多能接受的电子数。
例如,在H_2O中,中心原子O的价电子数a = 6,与O结合的H原子最多能接受1个电子,n = 2,则孤电子对数=(1)/(2)(6 - 2×1)=2。
2. 价层电子对的空间构型。
- 当价层电子对数为2时,空间构型为直线形,如BeCl_2。
- 当价层电子对数为3时:- 若没有孤电子对,空间构型为平面三角形,如BF_3。
- 若有1个孤电子对,空间构型为V形,如SO_2。
- 当价层电子对数为4时:- 若没有孤电子对,空间构型为正四面体,如CH_4。
- 若有1个孤电子对,空间构型为三角锥形,如NH_3。
- 若有2个孤电子对,空间构型为V形,如H_2O。
二、杂化轨道理论。
1. 杂化类型。
- sp杂化:- 由1个s轨道和1个p轨道杂化形成2个sp杂化轨道。
- 例如BeCl_2,Be原子的电子排布式为1s^22s^2,在成键时,Be原子的1个2s电子激发到2p轨道,然后2s轨道和1个2p轨道杂化形成sp杂化轨道,分子空间构型为直线形。
- sp^2杂化:- 由1个s轨道和2个p轨道杂化形成3个sp^2杂化轨道。
- 如BF_3,B原子的电子排布式为1s^22s^22p^1,B原子的1个2s电子激发到空的2p轨道,然后2s轨道和2个2p轨道杂化形成sp^2杂化轨道,分子空间构型为平面三角形。
- sp^3杂化:- 由1个s轨道和3个p轨道杂化形成4个sp^3杂化轨道。
- 在CH_4中,C原子的电子排布式为1s^22s^22p^2,C原子的1个2s电子激发到空的2p轨道,然后2s轨道和3个2p轨道杂化形成sp^3杂化轨道,分子空间构型为正四面体。

物理分子基本知识点总结一、分子的定义和性质1. 分子的定义:分子是由两个或更多个原子经过化学键结合在一起而形成的粒子。
2. 分子的性质:(1)分子的大小:分子的大小通常以分子的分子量来衡量,分子量越大,分子的大小越大。
(2)分子的形状:分子的形状由分子中原子的排列方式决定,分子可以是线性的、非线性的、扭曲的等。
(3)分子的运动:分子具有热运动,分子不断的运动、振动和旋转,这是分子热学性质的基础。
(4)分子的能级:分子拥有不同的电子能级,分子的能级结构决定了分子在光谱学和化学反应中的表现。
二、分子的结构1. 分子的化学键:分子内的原子通过化学键相互连接而形成分子。
常见的化学键有共价键、离子键、氢键等。
2. 分子的构象:分子的构象是指分子在空间中的排列结构,包括构象异构体、立体异构体等。
3. 分子的对称性:分子的对称性特征对分子的性质有很大的影响,具有对称性的分子通常比较稳定。
4. 分子的性质与结构的关系:分子的性质与其结构密切相关,分子的结构决定了其化学性质和物理性质。
三、分子的热学性质1. 分子的热运动:分子具有运动、振动和旋转的热运动,这是分子热学性质的基础。
2. 分子的热容:分子具有热容,热容是指单位质量的物质升高1摄氏度所需的热量。
3. 分子的热膨胀:分子在受热时会发生膨胀,热膨胀是物体受热后体积增大的现象。
四、分子的光学性质1. 分子的吸收和发射光谱:分子在吸收和发射光谱中表现出特有的能级结构和频谱特征,吸收光谱常用于分子结构的确定和分子的识别。
2. 分子的偏振性:大部分分子对光有选择性的吸收,表现出偏振性。
五、分子的电学性质1. 分子的电荷分布:分子内的原子和原子围绕的电子云分布不均匀,导致分子整体具有偶极矩。
2. 分子的极化性:分子在外电场下会发生极化,具有极化性的分子在电场中表现出特有的性质。
3. 分子的电子能级结构:分子具有一系列的能级,不同的电子能级结构决定了分子在电学性质中的表现。

化学分子结构化学分子结构是研究化学物质的构成和组成方式的重要内容之一。
它描述了化合物中原子之间的连接方式以及它们之间的空间排列关系。
通过了解分子结构,我们可以更深入地理解化学物质的性质和反应行为,为合成新的化合物、改良材料性能和探索新的科学领域开辟了道路。
一、分子结构的基本概念和组成要素化学物质由原子构成,而分子则由原子通过共价键连接而成。
分子结构描述了原子之间的连接方式和它们在空间中的相对位置。
分子结构的主要组成要素包括原子类型、原子间的键、键的角度和键的长度。
1. 原子类型不同种类的化学元素具有不同的原子类型。
每种原子类型都有特定的化学性质和价电子数,从而决定了其参与反应的方式和可能的结构。
常见的原子类型包括氢、氧、碳、氮等。
2. 原子间的键原子之间的连接通过化学键实现。
最常见的化学键类型是共价键,它是通过共享电子对来连接原子的。
共价键可以分为单键、双键和三键,取决于原子之间共享的电子对数量。
除了共价键,还有离子键、金属键和氢键等其他类型的化学键。
3. 键的角度和键的长度键的角度和键的长度也是分子结构的重要特征。
键的角度是指连接两个原子的键的方向相对于分子的相对角度。
键的长度则是指连接两个原子的键的实际长度,它决定了分子的几何形状和空间排列方式。
二、分子结构的表示方法为了更清晰地表达分子结构,化学家们发展了一系列的表示方法。
其中最常见的方法包括结构式、线角式和空间填充式。
1. 结构式结构式是一种二维图形表示方法,它通过化学键和原子符号来描述分子的连接方式。
结构式可以精确地表示化学键的类型、键的角度和键的长度。
其中最常见的结构式包括平面式、简化式和骨架式等。
平面式将分子中的原子和键都画在一个平面上,简化式通过简化分子结构的表示方式来减少图形的复杂性,骨架式则只画出分子的骨架结构。
2. 线角式线角式是一种简化的结构表示方法,它通过线段和角度来描述化学键的连接方式。
线段表示化学键,而角度则表示键的连接方向。

分子的空间结构是指分子中原子的三维排列方式。
了解分子的空间结构有助于理解分子的化学性质和物理性质。
以下是关于分子空间结构的一些基本知识点:
1. 共价键:在分子中,原子通过共价键(covalent bond)结合在一起。
共价键是由原子之间共享电子对形成的。
2. σ键和π键:共价键分为两类:σ键(sigma bond)和π键(pi bond)。
σ键是沿键轴排列的,而π键是垂直于键轴排列的。
3. 键角:相邻两个共价键之间的夹角称为键角。
键角的大小会影响分子的空间结构。
4. 空间构型:分子的空间结构可以通过键角和键长来描述。
常见的空间构型包括直线型、平面三角形、四面体、三角锥形和八面体等。
5. 手性分子:手性分子是指具有镜面对称性质的分子。
这种分子在空间上不能与其镜像重合。
手性分子的空间结构由其四个不同原子或基团围绕一个中心原子所形成的四面
体结构决定。
6. 构象:分子在空间中存在的不同排列方式称为构象。
分子的构象取决于共价键的旋转和振动。
在室温下,大多数分子处于不断变化的构象中。
了解分子的空间结构对于化学、生物和材料科学等领域的研究至关重要。
掌握这些知识点有助于更好地理解物质性
质和应用。
分子和结构知识点总结一、分子和分子结构的概念1. 分子的概念分子是物质的最小单位,由原子组成,是具有一定稳定性和特定化学性质的微粒。
分子是原子通过共价键或离子键结合而成的。
每种物质都具有其特定的分子结构。
2. 分子结构的概念分子结构是指分子中各原子之间的相对位置和运动方式。
分子结构决定了事物的化学性质和物理性质。
二、分子模型1. 杨氏模型杨氏模型是用查特雷尔斯的图形分子构造理论来加以解释的,这是以“简单立方体”如稠密固体分子构造七普林排列更为合理。
这一模型在实验尚未确凿的情况下已通过推理来论证了分子的构造。
2. 平面六边形模型平面六边形模型是分子运动新用查特雷尔斯的图形分子构造理论为主的分子结构模型的简化记载,这种模型在理论预测结果尚未得到实验证实,实体没有确定以后就得已推证确立。
不过这一模型的基础概念是来自物理学中分子运动的图说文献。
3. 三角形分子模型三角形分子构造模型又从图说法中附加了以生成图论为基础的分子结构正面三角形模型更适用的构造分子理论来和辐射系议而较理想的融合型再得以进一步发展。
三、共价键和离子键1. 共价键共价键是由原子间的电子对相互共享而形成的化学键。
共价键又分为单共价键、双共价键和三共价键。
2. 离子键离子键是原子之间的电子迁移而形成的化学键。
在这种键中,金属原子失去电子为阳离子,非金属原子得到电子为阴离子。
四、分子结构的影响因素1. 电子构型原子的电子构型决定了分子的构造,包括了分子是由共价键还是离子键而成。
2. 氧化数氧化数是元素的化合价。
氧化数越高,化合物的共价性越大。
3. 原子大小原子大小对分子结构也有影响。
原子大小决定了分子的空间构型。
4. 分子间力分子间力是决定物质态的重要因素。
分子间力包括范德华力、氢键等。
五、共价分子结构1. 单原子分子单原子分子是由一种元素组成的分子。
例如,氢气、氮气、氧气。
2. 双原子分子双原子分子是由两种元素组成的分子。
例如,氧气(O2)、氮气(N2)。
高二化学分子结构知识点化学是一门研究物质变化和物质组成的科学,而分子结构是化学中的重要概念之一。
了解分子结构的基本知识,对于理解物质的性质和反应机制具有重要意义。
本文将介绍高二化学中的分子结构知识点,帮助读者深入理解这一领域。
1. 原子与分子在化学中,原子是物质的基本组成单位。
分子由两个或更多原子以共价键相互连接而成。
例如,水分子由两个氢原子与一个氧原子通过共价键连接而成。
2. 分子式分子式用于表示分子中原子的种类和数量。
例如,水的分子式为H2O,表示一个水分子中有两个氢原子和一个氧原子。
3. 分子结构表示方法分子结构可以用不同的表示方法来描述。
最常用的方法是结构式,它显示分子中原子的连接方式和键的类型。
另外,还可以使用分子模型或球棍模型等三维图形来表示分子结构。
4. 共价键和 Lewis 结构共价键是分子中两个原子之间的化学键,通过共享电子对来形成。
在 Lewis 结构中,用电子点表示共有的电子对,并用线条表示共价键。
Lewis 结构可以帮助我们确定分子中原子的数量和键的类型。
5. 分子的电荷分布分子中原子的电荷分布可通过为原子分配形象化的部分正负电荷来描述。
正电荷通常位于电负性较低的原子附近,而负电荷通常位于电负性较高的原子附近。
6. 极性分子与非极性分子极性分子是指具有正负电荷分布不对称的分子,这是由于原子间电负性差异引起的。
非极性分子则是指正负电荷分布相对均匀的分子。
极性分子和非极性分子在物理和化学性质方面表现出不同的行为。
7. 分子几何构型分子的几何构型指的是分子中原子的排列方式。
常见的几何构型包括线性、三角形平面、四面体和五角星形等。
分子的几何构型对于物质的稳定性和反应性具有重要影响。
8. 分子间相互作用分子间相互作用是分子之间因电荷相互作用而产生的力。
常见的分子间相互作用包括静电力、氢键和范德华力等。
分子间相互作用对于物质的物理和化学性质以及相变行为具有重要影响。
9. 分子的反应性分子的反应性取决于分子中原子的类型、数量和连接方式。
高中生物dna分子结构知识点dna分子结构DNA分子结构的主要知识点包括:
1. DNA的组成:DNA由核苷酸组成,每个核苷酸由一个磷酸基团、一个脱氧核糖糖分子和一个碱基组成。
2. DNA的碱基:DNA包含四种碱基,分别是腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C)。
这些碱基通过氢键的配对方式互相连接,A和T之间形成两个氢键,G和C之间形成三个氢键。
3. DNA的双螺旋结构:DNA呈现出双螺旋结构,由两个互补的链组成。
两条链以氢键相连,形成一个螺旋的结构。
碱基通过对连对的方式紧密堆叠在中央,而磷酸基团和脱氧核糖则位于外部。
4. DNA的方向性:DNA分子的两条链具有方向性,其中一个链以5'端和3'端表示,另外一个链以3'端和5'端表示。
链上的碱基以3'端与5'端的顺序排列,形成了链的方向性。
5. DNA的超螺旋结构:DNA的双螺旋结构可以进一步形成超螺旋结构,包括正超螺旋和负超螺旋。
这种结构可以帮助DNA进行复制和转录过程。
6. DNA的包装结构:DNA分子会在细胞中经过进一步的包装,形成染色体。
DNA会与核蛋白质相互作用,形成核小体和进一步的组织级别的结构。
这些是高中生物学中关于DNA分子结构的一些基本知识点,也是理解DNA功能和遗传的基础。
化学中的分子结构与性质知识点化学是研究物质构成、性质以及变化规律的科学领域。
而分子结构与性质是化学中重要的概念和知识点。
本文将介绍分子结构的基本概念、分子间相互作用和分子性质的相关知识。
一、分子结构的基本概念1. 原子:分子的基本组成单位,由核心的质子和中性的中子组成,外围环绕着电子。
2. 分子:由两个或更多原子通过化学键连接在一起形成的化合物。
分子可以是由相同元素的原子组成的,也可以是由不同元素的原子组成的。
3. 化学键:原子之间的强有力的相互作用力。
常见的化学键包括离子键、共价键和金属键。
4. 分子式:用来表示分子组成的化学符号。
例如,H₂O表示水分子,CO₂表示二氧化碳分子。
二、分子间相互作用1. 范德华力:分子之间由于极化而产生的瞬时种间相互作用力。
范德华力是所有分子间相互作用中最弱的一种。
2. 电离力:一种分子中带正电荷的离子与另一种分子中带负电荷的离子之间的相互作用力。
3. 氢键:氢原子与高电负性原子(如氧、氮等)之间的强作用力。
氢键是分子间相互作用中比较强的一种。
4. 疏水作用:非极性物质(如油)与水之间的相互作用力。
疏水作用使油与水无法混合。
三、分子性质1. 稳定性:分子结构的稳定性决定了化合物的存在形式和反应性质。
稳定的分子结构能够抵御外界环境的干扰而保持不变。
2. 极性:分子中正负电荷分布不均匀,导致分子具有极性。
极性分子在电场中会受到电场力的作用。
3. 气体、液体和固体状态:分子结构决定了化合物的物态。
气体分子之间的相互作用较弱,液体分子间的相互作用适中,固体分子之间的相互作用最强。
4. 溶解度:分子结构对溶解度有影响。
极性溶剂可以溶解极性分子,而非极性溶剂只能溶解非极性分子。
五、应用领域1. 药物研发:了解分子结构与性质对药物活性和药物代谢的影响,可以设计更有效的药物。
2. 材料科学:通过改变分子结构,可以获得具有特定性能的新型材料,如高效能量材料和高分子材料。
3. 环境保护:研究分子结构与环境中污染物的相互作用,有助于开发环境友好型的处理方法。
高一化学分子结构知识点化学是一门研究物质组成、性质和变化规律的科学。
在高中化学课程中,分子结构是一个非常重要的知识点。
分子结构的理解对于学生进一步深入理解物质性质和化学反应机制至关重要。
本文将从分子的组成、分子结构的类型以及分子结构与物质性质之间的关系等方面进行阐述。
一、分子的组成在化学中,分子是由两个或多个原子组成的。
原子是物质的基本单位,而分子则是物质的最小粒子。
分子可以是由相同的原子组成的,称为单质分子,如氧气(O2)、二氯化碳(CCl2)等;也可以是由不同元素的原子组成的,称为化合物分子,如水(H2O)、乙醇(C2H5OH)等。
分子中的原子通过化学键相互连接,常见的化学键有共价键、离子键和金属键等。
二、分子结构的类型分子结构的类型多种多样,常见的包括线性分子、非线性分子、极性分子和非极性分子等。
线性分子指的是分子中的原子排列成直链状。
例如一氧化碳(CO)的分子中,氧原子和碳原子通过共价键连接,形成了直线排列的结构。
非线性分子则指的是分子中的原子排列成非直线状。
例如二氧化碳(CO2)的分子中,两个氧原子分别与一个碳原子形成共价键,形成了三角形的结构。
极性分子是指分子中存在电荷分布不均的情况,拥有正电荷和负电荷的部分。
例如水(H2O)的分子中,氧原子比氢原子更强吸电子,因此在氧原子周围形成部分负电荷,而氢原子则形成部分正电荷,使得水分子呈现极性。
而非极性分子则指的是分子中电荷分布均匀,没有正负电荷的分布差异。
例如甲烷(CH4)的分子中,碳原子和四个氢原子形成共价键,使得整个分子呈现出电荷分布均匀,没有正负电荷区别的性质。
三、分子结构与物质性质的关系分子结构的不同对物质的性质具有重要影响。
其中,分子结构的稳定性、极性和立体构型是决定物质性质的重要因素。
首先,分子结构的稳定性与物质的化学反应活性密切相关。
分子结构越稳定,其化学反应活性越低。
例如石油中的碳氢化合物(如烷烃)由于其分子中的碳-碳和碳-氢键的强度较高,使得这类化合物相对稳定,不容易发生化学反应。