电泳技术介绍及影响电泳的因素
- 格式:doc
- 大小:54.50 KB
- 文档页数:4


电泳的基本原理电泳是一种常用的生物化学分离技术,它利用生物分子在电场中的迁移性差异来实现分离。
电泳技术广泛应用于蛋白质、核酸等生物大分子的分离和纯化。
在电泳过程中,样品中的生物大分子在电场作用下沿着凝胶或液相介质迁移,根据其迁移速度和迁移距离的差异来实现分离。
本文将介绍电泳的基本原理,包括电泳的原理、影响电泳的因素以及常见的电泳技术。
电泳的原理。
电泳的基本原理是利用生物大分子在电场中的迁移性差异来实现分离。
在电场作用下,带电的生物大分子会向电极迁移,迁移速度与其电荷大小、形状、分子大小等因素有关。
通常情况下,带负电的生物大分子向阳极迁移,带正电的生物大分子向阴极迁移。
在电泳过程中,样品中的生物大分子会在凝胶或液相介质中迁移,根据其迁移速度和迁移距离的差异来实现分离。
影响电泳的因素。
影响电泳的因素有很多,主要包括电场强度、凝胶或液相介质、pH值、温度等。
电场强度是影响电泳速度的重要因素,电场强度越大,生物大分子的迁移速度越快。
凝胶或液相介质的选择也会影响电泳分离的效果,不同的凝胶或液相介质对生物大分子的迁移特性有不同的影响。
此外,pH值和温度也会影响生物大分子的电泳迁移性,因此在进行电泳实验时需要对这些因素进行合理的控制。
常见的电泳技术。
常见的电泳技术包括琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、毛细管电泳等。
琼脂糖凝胶电泳是一种常用的核酸分离技术,通过琼脂糖凝胶的孔隙大小来实现核酸的分离。
聚丙烯酰胺凝胶电泳则常用于蛋白质的分离,其孔隙大小可以根据需要进行调控。
毛细管电泳是一种高效的分离技术,其分离速度快、分辨率高,广泛应用于生物大分子的分离和分析。
总结。
电泳是一种重要的生物化学分离技术,利用生物大分子在电场中的迁移性差异来实现分离。
在电泳过程中,样品中的生物大分子会在凝胶或液相介质中迁移,根据其迁移速度和迁移距离的差异来实现分离。
影响电泳的因素包括电场强度、凝胶或液相介质、pH值、温度等。
常见的电泳技术包括琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、毛细管电泳等。




电泳高考知识点总结电泳是一种常见的生物技术实验方法,广泛应用于基因分析、蛋白质研究以及法医学等领域。
在高考生物考试中,电泳是一个重要的知识点。
本文将对电泳的相关知识进行总结,以帮助考生更好地掌握这一内容。
一、电泳的基本原理电泳是利用物质在电场作用下的迁移运动的原理,通过电场的引导,使待分离的生物分子在凝胶中迁移,从而实现分离和检测。
电泳过程中,需要考虑电场强度、凝胶类型以及DNA的大小等因素。
1. 凝胶电泳凝胶电泳是最常见的电泳方法之一。
凝胶中含有孔隙结构,根据分子的大小差异,使得分子在凝胶中的迁移速度不同,从而实现分离。
常用的凝胶有瓊脂糖凝胶和聚丙烯酰胺凝胶等。
2. 离子电泳离子电泳是利用溶液中带电粒子在电场中的迁移来实现分离的方法。
它主要应用于离子的检测和分离,如常见的离子交换色谱。
二、电泳的应用领域电泳在生物学和医学领域有着广泛的应用。
主要包括基因分析、蛋白质研究和法医学等方面。
1. 基因分析基因电泳是研究DNA序列和变异的重要方法之一。
通过对DNA片段的分离,可以实现基因突变的检测、亲子鉴定等应用。
2. 蛋白质分析蛋白质电泳是研究蛋白质的结构和功能的重要手段。
通过对蛋白质的分离和鉴定,可以了解其复杂的结构和功能特点。
3. 法医学应用电泳在法医学中也有重要应用。
例如,通过DNA电泳可以进行犯罪嫌疑人的DNA比对,从而确定罪犯。
三、常见的电泳技术电泳技术发展迅速,现在有多种不同的电泳方法,常见的有聚合酶链式反应(PCR)电泳、蛋白质凝胶电泳和全基因组扩增片段长度多态性(AFLP)等。
1. PCR电泳PCR电泳是将PCR扩增得到的目的序列通过凝胶电泳进行分离和检测的方法。
它可以用于基因检测、突变鉴定等。
2. 蛋白质凝胶电泳蛋白质凝胶电泳是通过凝胶电泳的方式对蛋白质进行分离和检测的方法。
根据蛋白质的大小和电荷,可以实现对蛋白质的精确分离。
3. AFLPAFLP是一种用于检测DNA序列差异的分子生物学技术。


第二节电泳技术若将两个电极插在电解质溶液中,通上直流电,正离子则向负极移动,而负离子向正极移动,这种现象就是我们熟悉的电泳现象,也称“电泳”。
概括而言,电泳是指带电粒子在电场中向与自身带相反电荷的电极移动的现象。
例如蛋白质具有两性电离性质,当溶液pH 值大于蛋白质等电点时,蛋白质带负电荷,在电场中向正极移动,反之则带正电荷,向负极移动。
当蛋白质溶液pH值与蛋白质的等电点相等,净电荷为零时则不移动。
各种电泳技术具有以下特点:①凡是带电物质均可应用某一电泳技术进行分离,并可进行定性或定量分析;②样品用量极少;③设备简单;④可在常温进行;⑤操作简便省时;⑥分辨率高。
目前,电泳技术已经广泛应用于基础理论研究、临床诊断及工业制造等方面。
例如用醋酸纤维薄膜电泳分析血清蛋白;用琼脂对流免疫电泳分析病人血清,为原发性肝癌的早期诊断提供依据;用高压电泳研究蛋白质核酸的一级结构;用具有高分辨率的凝胶电泳分离酶、蛋白质、核酸等大分子的研究工作,对生物化学与分子生物学的发展起了重要作用。
一、电泳技术的基本原理带电荷的质点,在一定条件的电场作用下,可向一极移动,如带正电荷的质点移向负极。
许多生物分子都带有电荷,其电荷的多少取决于分子性质及其所在介质的pH和组成,由于混合物中各组分所带电荷性质、电荷数量以及分子量的不同,在同一电场的作用下,各组分泳动的方向和速度也各异。
因此,在一定时间内,由于各组分移动距离的不同,而达到分离鉴定各组分的目的。
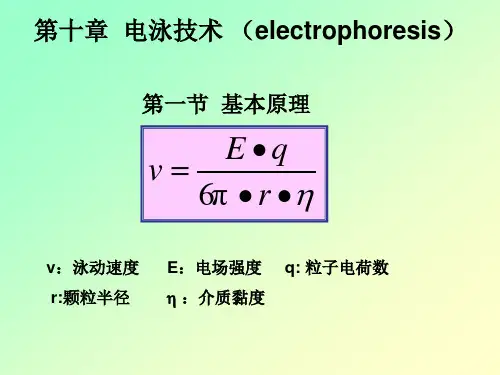
在电场中,推动带电质点运动的力(F)等于质点所带净电荷量(Q)与电场强度(E)的乘积:F=QE质点的前移同样要受到阻力(F)的影响,对于一个球形质点,服从Stoke定律,即:F′=6πrην式中r为质点半径,η为介质粘度,ν为质点移动速度。
当质点在电场中作稳定运动时:F=F′即 QE=6πrην可见,球形质点的迁移率,首先取决于自身状态,即与所带电量成正比,与其半径及介质粘度成反比。
除了自身状态的因素外,电泳体系中其它因素也影响质点的电泳迁移率。

电泳技术电泳技术电泳法,是指带电荷的供试品(蛋白质、核苷酸等)在惰性支持介质(如纸、醋酸纤维素、琼脂糖凝胶、聚丙烯酰胺凝胶等)中,于电场的作用下,向其对应的电极方向按各自的速度进行泳动,使组分分离成狭窄的区带,用适宜的检测方法记录其电泳区带图谱或计算其百分含量的方法。
电泳技术的基本原理和分类在电场中,推动带电质点运动的力(F)等于质点所带净电荷量(Q)与电场强度(E)的乘积。
F=QE质点的前移同样要受到阻力(F)的影响,对于一个球形质点,服从Stoke定律,即:F′=6πrην式中r为质点半径,η为介质粘度,ν为质点移动速度,当质点在电场中作稳定运动时:F=F′即QE=6πrην可见,球形质点的迁移率,首先取决于自身状态,即与所带电量成正比,与其半径及介质粘度成反比。
除了自身状态的因素外,电泳体系中其它因素也影响质点的电泳迁移率。
电泳法可分为自由电泳(无支持体)及区带电泳(有支持体)两大类。
前者包括Tise-leas 式微量电泳、显微电泳、等电聚焦电泳、等速电泳及密度梯度电泳。
区带电泳则包括滤纸电泳(常压及高压)、薄层电泳(薄膜及薄板)、凝胶电泳(琼脂、琼脂糖、淀粉胶、聚丙烯酰胺凝胶)等。
自由电泳法的发展并不迅速,因为其电泳仪构造复杂、体积庞大,操作要求严格,价格昂贵等。
而区带电泳可用各种类型的物质作支持体,其应用比较广泛。
本节仅对常用的几种区带电泳分别加以叙述。
影响电泳迁移率的因素⒈电场强度电场强度是指单位长度(cm)的电位降,也称电势梯度。
如以滤纸作支持物,其两端浸入到电极液中,电极液与滤纸交界面的纸长为20cm,测得的电位降为200V,那么电场强度为200V/20cm=10V/cm。
当电压在500V以下,电场强度在2-10v/cm时为常压电泳。
电压在500V以上,电场强度在20-200V/cm时为高压电泳。
电场强度大,带电质点的迁移率加速,因此省时,但因产生大量热量,应配备冷却装置以维持恒温。

电泳技术综述电泳技术有着八十年的发展史,是一种先进的检测手段。
它广泛用于多个领域,还能与其他先进技术相配合,创造出惊人的结果。
它对解决当前人类所面临的食品、能源、环境和疾病等一系列迫切问题,都有积极作用。
一、电泳发展史1809年,俄国物理学家Рейсе 首次发现电泳现象。
他在湿粘土中插上带玻璃管的正负两个电极,加电压后发现正极玻璃管中原有的水层变混浊,即带负电荷的粘土颗粒向正极移动,这就是电泳现象,但是当时还不叫电泳。
1909年,Michaelis 首次将胶体离子在电场中的移动称为电泳。
他用不同pH 的溶液在U 形管中测定了转化酶和过氧化氢酶的电泳移动和等电点。
1937年,瑞典Uppsala 大学的Tiselius 对电泳仪器作了改进,创造了Tiselius 电泳仪,建立了研究蛋白质的移动界面电泳方法,并发现了血清蛋白可分为白蛋白及α、β、γ 球蛋白,使电泳技术开始用于临床研究。
但这电泳结构复杂,价格昂贵不易推广。
1948年Wieland 和Fischer 等,发明了用滤纸作为支持介质的电泳方法使该技术大为简化,而且可以使许多组分相互分离为区带,所以这类电泳被称为区带电泳。
纸电泳发明后在临床上得到广泛的应用。
1950年Durrum 用纸电泳进行了各种蛋白质的分离以后,开创了利用各种固体物质(如各种滤纸、醋酸纤维素薄膜、琼脂凝胶、淀粉凝胶等)作为支持介质的区带电泳方法。
1959年Raymond 和Weintraub 利用人工合成的凝胶作为支持介质,创建了聚丙烯酰胺凝胶电泳,极大地提高了电泳技术的分辨率,开创了近代电泳的新时代。
30多年来,聚丙烯酰胺凝胶电泳仍是生物化学和分子生物学中对蛋白质、多肽、核酸等生物大分子使用最普遍,分辨率最高的分析鉴定技术,是检验生化物质的最高纯度:即”电泳纯”(一维电泳一条带或二维电泳一个点)的标准分析鉴定方法,至今仍被人们称为是对生物大分子进行分析鉴定的最后、最准确的手段,即”Last Check”。
电泳主要影响因素1、电压电压由树脂本身的结构决定,不同产品都有一个不同的操作范围,在此范围内,如果电压过低,漆膜会变薄,泳透率会降低,工件内腔及夹缝处漆膜会很薄,甚至上不了漆,严重影响漆膜的性能,比如耐盐雾性能降低。
电压过高,沉积速度快,过高的电压会产生漆膜缺陷,会产生漆膜粗糙,桔皮,严重时还会出现漆膜被击穿。
所以,应根据不同的产品调整不同的电压。
2、时间在同一电压下电泳时间和漆膜厚度成正比,电泳时间越长,漆膜越厚,相对漆膜走位会更好,电泳时间越短,漆膜越薄,走位也会变差,同样,不同工件电泳的时间也应进行调整。
3、槽液固体份槽液固体份是指电泳槽液中的成膜物质(树脂和颜料)的含量,现场生产一般通过糖度计来测量,不过糖度计测出来的含量跟实际的含量比,会有一定的偏差,例如,糖度计测出来槽液固体份12个点,实际槽液固体份约在10%。
实验室测试槽液固体份用烘干法测量,就是在槽液里取样约2克,放在规定的测量杯里,置于烤箱里120度,烘烤120分钟后,槽液剩余物质除以取样量乘以百分之百即为槽液固体份。
槽液固体份对槽液的稳定性,泳透率以及漆膜厚度,漆膜性能都有一定的影响。
4、温度电泳槽液温度对漆膜厚度,槽液稳定性都有很大的影响,当温度过高时,电极反应和电泳沉积速度会加快,会让膜厚增加,泳透率和附着力变差,外观容易出现起皱,针孔,粗糙等现象,同时温度过高会让溶剂蒸发太快,加速槽液老化,使槽液产生结块和沉淀;温度过低,电泳沉积速度减慢,粘度增加漆膜变薄,外观会产生厚薄不匀和针孔问题,同时槽液循环减慢,颜料沉积加快,槽液稳定性会下降。
5、PH值电泳槽液的PH值是电泳漆槽液的一个重要参数,影响到电泳漆的导电性,从而影响树脂在槽液中的泳动,适当的PH值能确保树脂的水溶性和稳定性。
PH过高时,槽液稳定性变差,会产生漆膜发粗、发光、结块、针孔,槽液中出现大量不溶性颗粒、槽液分层、导电性能下降。
当PH过低时,会增加漆膜返溶,严重时可能上不了漆。
在电泳过程中,带电粒子的移动速度v除与粒子所带电荷量Q及电场强度X有关外,还与粒子半径r及介质的粘度η有关:v=QX/6πrη上式中,6π是适用于球形带电粒子的经验数值,对椭圆形或半径很大的粒子则数值有所不同。
可见,带电粒子的移动速度和粒子的本身的性质有密切关系,粒子表面所带电荷量和物质的组成结构有密切关系。
此外,粒子的大小(分子量)及粒子的形状等也有重要的影响。
所以,在一定电场强度下,不同种类的带电物质在电泳时的移动速度就不能完全一致,这种移动速度的差异就是电泳技术的基本依据。
1.样品带电化合物的性质在几个方面影响着它们的迁移率。
(1)电荷:迁移率随净电荷的增加而增加。
电荷的大小一般由pH决定。
(2)分子大小:对于较大的分子,由于周围介质所引起的摩擦力和静电力的增加,迁移率下降。
(3)形状:同样大小的,但是具有不同形状的分子,如纤维状的蛋白质和球状蛋白质,因摩擦力作用不同,而表现有不同的迁移特征。
2.电场欧姆定律表示了电流A(安培)、电压V(伏特)和电阻Ω(欧姆)之间的关系:A=V/Ω。
因此,离子在电场中的分离受到这三个因素的影响。
(1)电流:由于在二个电极之间溶液中的电流完全由缓冲液和样品的离子来传导,因此,迁移率与电流成正比。
离子迁移的距离与通电时间成正比。
因此,为了得到最好的重复性,在电泳时电流必须保持恒定。
当然必须使用直流电。
(2)电压:电压控制着电流,因此,迁移率与加在支持介质两端的电位差成正比。
这是电压梯度,一般用伏特/厘米(V/cm)来表示(即,所加的电压除以支持介质的长度)。
可以使用低电压(100-500伏),或者高电压(500-10,000伏),电压梯度分别可达20和200伏/厘米。
高电压主要是用于分离小分子的化合物。
(3)电阻:迁移率与电阻成反比,电阻由支持介质的类型和大小,以及缓冲液的离子强度所决定。
电阻随支持介质的长度而增加,随支持介质的宽度和缓冲液离子强度的增加而降低。
电泳技术介绍及影响电泳的因素
一、基本知识和种类
电泳是指带粒子在电场中向与自身带相反电荷的电极移动的现象。
例如蛋白质具有两性电离性质。
当蛋白质溶液的pH在蛋白质等电点的碱侧时,该蛋白质带负电荷,在电场中向正极移动,相反则带正电荷,在电场中向负极移动,只有蛋白质溶液pH在蛋白质的等电点时静电荷是零,在电场中不向任何一极移动。
电泳现象早在1890年就被发现,1907年有人曾在琼脂中电泳,研究白喉毒素。
1937年由Tiselius制成界面电泳仪,并开始用于蛋白质的研究。
从此,人们才逐渐认识到电泳技术对于生物科学研究是一种重要工具。
然而,界面电泳结构复杂,价格昂贵难于普及。
1940年左右,以纸为支持物的电泳问世后,电泳技术得到迅速发展。
电泳技术以支持物分,可分为:纸电泳,醋酸纤维素薄膜电泳,淀粉凝胶电泳,琼脂(糖)凝胶电泳及聚丙烯酰胺凝胶电泳等。
经凝胶形状分有水平平板电泳,园盘柱状电泳及垂直平板电泳。
各种类型的电泳技术概括如表。
各类电泳技术已经广泛地用于基础理论研究,临床诊断及工业制造等方面。
例如用醋酸纤维
薄膜电泳分析血清蛋白;用琼脂对流免疫电泳分析病人血清,为早期诊断原发性肝癌提供资料;用高压电泳分离肽段,研究蛋白质一级结构;用高压电泳和层析结合研究核酸的一级结构。
凝胶龟泳技术在分离分析酶。
蛋白质,核酸等生物大分子方面具有较高的分辩力,为生物化学,分子生物学的发展作出了重大贡献。
二、影响电泳的因素
不同的带电颗粒在同一电场中泳动的速度不同。
常用泳动度(或迁移率)来表示。
泳动度是指带电颗粒在单位电场强度下泳的速度。
影响泳动度的主要因素有:
1、首先决定于带颗粒的性质,即颗粒所带净电荷的数量,大小及形状
一般说来,颗粒带净电荷多,直径小而接近于球形,则在电场中泳动速度快,反之则慢。
泳动度还与分子的形状,介质粘度,颗粒所带电荷有关,泳动度与颗表面电荷成正比,与介质粘度及颗粒半径反比。
带电荷的高分子在电解质溶液中把一些带有相反电荷的离子吸引在其周围,形成一离子扩散层。
加以电场时,颗粒向符号相反的电极移动即带阳电荷颗粒移向负极,带阴电荷颗粒移向正移;离子扩散层由于带有过剩的与颗粒符号相反的电荷,可以向相反方向移动。
结果颗粒与离子扩散之间的静电引力使颗粒的泳动度减慢,另外,高分了颗粒表面有一层水,在电场影响下,它与颗粒一起移动,可以认为是颗粒的一部分。
2、电场强度
电场强度也称电位梯度,是指单位长度(每一厘米)支持物体上的电位降,它对泳动度起着十分重要的作用。
例如纸电泳。
测量25厘米长纸条两端电压为250伏特,则电场强度为250伏特/25厘米=10伏特/厘米。
一般,电场强度越高,带电颗粒移动速度越快。
根据电场强度大小,可将电泳分为常压电泳
和高压电泳,前者的电压在100-500伏特,电场强度一般是2-10伏特/厘米;后者电压可高达500-1000伏特,电场强度在200-2000伏特/厘米。
常压电泳分离时间需数小时至数天,高压电泳时间短,有时仅几分钟即可,高压电泳主要用于分离氨基酸,肽,核苷酸,由于电压升高,电压也随之增大,故需冷却装置。
3、溶液的pH值
溶液的pH值决定了带电颗粒解离的程度,也决定了物质所带净电荷的多少,对于蛋白质,氨基酸等两性电解质而言,溶液pH值离电点越远,颗粒所带净电荷越多;电泳速度越快;反之则越慢。
例如血清中几种主要蛋白质的等电点各不相同,白蛋白等电点是4.0。
α2球蛋白等电点是5.06,β球蛋白等电点是5.1,γ球蛋白等电点是7.1。
当在pH8.6的电泳缓冲液中电泳时,这些蛋白质都带负电荷,它们的泳动速度是白蛋白< α2球蛋白>β球蛋白>γ球蛋白。
因此,当要分离一种蛋白质混合物时,应选择一种能扩大各种蛋白质所带电荷量差异的pH值,以利于各种蛋白质分子的解离。
同时,为保持电泳过程中溶液pH恒定也须使用缓冲液。
4、溶液的离子强度
溶液的离子强度是另一个重要选择的条件,在保持足够缓冲能力前提下,离子强度要最小。
溶液的离子强度越高,带电颗粒泳动速度越慢,反之越快。
浓度大的缓冲液在合适电压下,有较低的电阻和较大的电流,产热较高。
如果这种额外的热可以驱散,高浓度的缓冲液扩散常数较低,可以产生较窄细的电泳区带。
离子强度很高时要用低电压,避免过多产热,这样又导致长的电泳时间,以致增加变性和区带分离困难。
5、电渗作用
在支持物的电泳中,影响电泳的另一个重要因素是电渗作用。
所谓电渗就是指在电场中液体对固体支持物的相对移动,例如在pH8.6时,血清蛋白质进行纸电泳时,γ球蛋白与其他。