骨髓间充质干细胞和成纤维细胞的蛋白质组学比较
- 格式:doc
- 大小:27.50 KB
- 文档页数:9

人骨髓间充质干细胞促进乳腺癌细胞系MCF7上皮间质转化许峰;金晓霞;施民新【摘要】目的探讨在人骨髓间充质干细胞(hBMSCs)与乳腺癌细胞系MCF-7共培养后,MCF-7细胞上皮间质转化(MET)能力是否受到影响,并检测共培养条件下上皮间质转化是否是通过旁分泌因素影响MCF-7细胞的增殖及迁移能力的.方法体外成功分离hBMSCs,利用Transwell小室共培养hBMSCs与乳腺癌细胞系MCF-7,光镜观察MCF-7细胞的形态结构,是否发生上皮间质转化的特征性改变.利用实时定量PCR、Western blot、免疫荧光检测上皮间质转化标志蛋白E-cadherin、vimentin、α-SMA及β-catenin的表达.收集共培养体系中的条件培养液,作用MCF-7细胞,Western blot鉴定MCF-7细胞上皮间质转化的分子标志物的水平;CCK8法检测MCF-7细胞的增殖活力;流式细胞计量术检测细胞增殖周期的变化;Transwell小室法检测MCF-7细胞侵袭及转移能力.结果与对照组相比,与hBMSCs共培养之后的MCF-7细胞表现出明显增强的上皮间质转化能力(P<0.05).培养体系中的条件培养液刺激MCF-7细胞,其上皮间质转化特征及增殖和迁移能力增强(P<0.01).结论人骨髓间充质干细胞可诱导乳腺癌细胞系发生上皮间质转化.骨髓间充质干细胞与乳腺癌细胞系可以通过旁分泌信号促进乳腺癌上皮间质转化,进一步增强其增殖及转移能力.【期刊名称】《基础医学与临床》【年(卷),期】2018(038)009【总页数】7页(P1244-1250)【关键词】人骨髓间充质干细胞;乳腺癌;上皮间质转化;旁分泌机制【作者】许峰;金晓霞;施民新【作者单位】南通大学附属肿瘤医院南通市肿瘤医院胸外科,江苏南通226361;南通大学附属肿瘤医院南通市肿瘤医院病理科,江苏南通226361;南通大学附属肿瘤医院南通市肿瘤医院胸外科,江苏南通226361【正文语种】中文【中图分类】R394.2中国乳腺癌的发病率和致死率正逐年增加,是女性最常罹患的恶性肿瘤,癌细胞发生侵袭与转移影响是乳腺癌患者生存期的根本原因之一[1]。

蛋白质组学在骨关节疾病研究中的应用【关键词】蛋白质蛋白质作为细胞中的活性大分子,其表达水平的改变与疾病、药物作用或毒素作用直接相关。
蛋白质组学的理论和技术的进展与完善令人们从组织或细胞的蛋白质整体水平去熟悉疾病成为可能。
这一技术将是发觉疾病标志物、鉴定和评判药物靶蛋白等十分有效的工具。
1 蛋白质组学的概念及研究意义蛋白质组(Proteome)与蛋白质组学(Proteomics)的提出至今已有10年左右的时刻。
蛋白质组一词,源于蛋白质(protein)与基因组(genome)两个词的杂合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全数蛋白质。
蛋白质组是一个动态的概念,在同一个机体的不同组织和细胞中不相同,在同一机体的不同发育时期,不同的生理状态下,乃至不同的外界环境下也不相同。
各类复杂的生命活动,都是特定蛋白质群体在不同时刻和空间不同组合的结果。
蛋白质组学那么是大规模、系统地在蛋白质组整体水平进行研究的一门新兴学科[1],包括研究细胞内动态转变的蛋白质组成成份、表达水平和翻译后修饰状态、蛋白质之间的彼此作用和联系。
蛋白质组学可分为比较蛋白质组学和表达蛋白质组学[2]。
前者通过比较分析不同生理、病理条件下细胞、组织或体液中表达的蛋白质异同,挑选出许多具有临床标志意义的蛋白质关键分子。
后者目的在于成立蛋白质表达谱和修饰谱的数据库、细胞定位图、蛋白质作用连锁图,探讨和说明生命现象的本质。
将蛋白质组表达信息与基因组信息有效结合,这既可显示蛋白质翻译后加工修饰方式,又可克服分离蛋白质与理论蛋白质不一致的局限,从而使病理生理机制的说明更为完全和准确。
2 骨关节疾病的蛋白质组学研究各类骨关节疾病,包括退行性关节炎、滑囊炎、滑膜炎、肩周炎、风湿性关节炎、类风湿性关节炎、股骨头坏死等,都是较难治愈的慢性疾患,患病后关节肿、痛、积液、僵硬、增生、骨刺,活动艰巨乃至致使残疾!蛋白质组学的进展将极大的增进骨关节疾病的研究,尽管目前还处于起步时期,但从基因组向蛋白质组方向转变不失为尔后骨关节疾病研究的一种新模式。

GFP的简介和应用【摘要】源于多管水母属等海洋无脊椎动物的绿色荧光蛋白(GFP),是一种极具应用潜力的标记物,有着极其广泛的应用前景。
本文就GFP的理化性质、荧光特性、改进以及它在科学研究中发挥的作用进行了综述。
【关键词】绿色荧光蛋白(GFP)、标记物、荧光特性、进展、改进、应用、干细胞移植【正文】一、GFP的简介1. GFP的理化性质,荧光特性及其改进1.1 GFP的理化性质从水母体内分离到的GFP基因,长达2.6kD,由3个外显子组成,分别编码69、98和71个氨基酸。
GFP本身是一种酸性,球状,可溶性天然荧光蛋白。
Aequoria GFP分子量约27×103,一级结构为一个由238 个氨基酸残基组成的单链多肽;而Renilla GFP是分子量为54kD的同型二聚体。
两种GFP有不同的激发光谱,Aequoria GFP在395 nm具有最高光吸收峰,肩峰为473 nm;Renilla GFP在498 nm具有强烈的光吸收,肩峰为470 nm。
两种GFP含有相同的生色团,发射光谱基本相同(λmax= 508~ 509 nm)。
GFP性质极其稳定,易耐受高温处理,甲醛固定和石蜡包埋不影响其荧光性质。
其变性需在90℃或pH<4.0或pH>12.0的条件下用6mol/L盐酸胍处理,一旦恢复中性环境,或去除变性剂,虽然变性的蛋白质并不能完全复性,但是复性蛋白质同天然蛋白质对温度、pH变化的耐受性、抗胰蛋白酶消解的能力是相同的。
更重要的是,它们在很大的pH范围内的吸收、发射光谱也是相同的。
Renilla GFP的稳定性就更为显著。
它在上述一系列的变性条件下都很稳定,不易变性。
根据Sheen等的研究,GFP在受体内表达时,其稳定性并不亚于CAT 蛋白,因而可以得到持续时间较长的荧光。
1.2 GFP的荧光原理GFP的性质和发射光谱的稳定性是同其生色团结构的稳定性密不可分的。
GFP表达后折叠,在氧存在的条件下,使66位氨基酸残基的α、β键间脱氢。

随着社会人口老龄化的加剧,各种老年慢性疾病引起了医务工作者和社会各界的重视,其中7.5%的老年性疾病约为骨骼和肌肉类疾病[1]。
骨质疏松症是一种以骨量降低、骨组织微观结构退化和骨脆性增大为特征的,导致机体易发生微创性骨折的全身性骨骼性疾病。
肌肉减少症多发生于老年人,是一种以全身肌量减少、肌力下降和生理功能衰退等为特点的慢性综合征。
骨量在人体30岁时达到巅峰,然后开始下降,绝经后的女性骨量下降尤为快速;肌肉量在25岁时达到峰值, 40岁后每年肌肉质量会以约1%~2%的速度流失,80岁时肌量已流失约30%,其中肌肉力量和强度的下降速度明显大于肌肉质量[2]。
骨质疏松会增加跌倒的风险;而肌量减少和功能下降,会降低力量,导致活动功能受限,也提高了跌倒和骨折的风险[3]。
因此对“肌少-骨质疏松症”及早进行干预可降低跌倒和骨折的风险。
然而目前对“肌少-骨质疏松症”还没有直接有效的治疗方法,运动营养、干细胞治疗以及分子药物治疗等相关研究成为该病治疗的主要方向。
该文就目前老年人骨质DOI:10.16662/ki.1674-0742.2021.09.196老年人骨质疏松症合并肌少症治疗的研究进展陈周韬1,陈光华2,吴新诱2,谭小艳2,黄贵芝21.广东医科大学研究生院,广东湛江524023;2.广东医科大学附属医院骨科,广东湛江524001[摘要]社会人口老龄化导致许多老年慢性病的患病率逐年上升,而骨质疏松症和肌肉减少症正是与增龄明显相关的退行性疾病。
越来越多的研究表明肌肉和骨骼、肌肉减少症和骨质疏松症之间互相影响,它们使老年人的骨脆性增加和虚弱,导致其功能衰退、跌倒、骨折、住院、丧失独立性和死亡的风险升高,并降低了老年人的生活质量。
近年关于两者发病机制的研究取得了重大进展,但针对“肌少-骨质疏松症”共同靶点的治疗方法和药物比较缺乏。
但有文献表明有效的运动营养、干细胞治疗以及一些分子药物可以同时对肌肉和骨骼产生积极的影响,这些治疗方法都能使老年人发生跌倒及骨折的风险大大降低。

骨形态发生蛋白-2在骨形成过程中的作用机制(一)骨和软骨组织中含有多种参与调节骨骼发育及生长的多肽类生长因子。
此类因子通过自分泌、旁分泌或者内分泌的方式,在细胞与细胞之间,细胞与细胞外基质之间传递信息,参与复杂的骨形成调节过程。
在诸多因子中,骨形态发生蛋白(bonemorphogeneticproteins,BMPs)是唯一能够单独诱导骨组织形成的局部生长因子。
由于BMPs与转化因子在C端都含有7个保留的半胱氨酸残基,所以属于转化生长因子-B超家族(transforminggrowthfactor-batesuperfamily,TGF-βs)成员。
本文仅对骨形态发生蛋白-2(BMP-2)在骨形成过程中分子生物学作用机制综述如下。
1骨形态发生蛋白研究概况1965年,Urist首次将0.6M盐酸制备的脱钙骨基质(decalcifiiedbonematrix,DBM)植入鼠股肌内,成功诱导异位骨形成,从而提出了骨诱导理论(Osteoimductivetheory)。
Urist认为DBM 中存在着非特异性物质,其降解片段能够诱导血管周围的未分化间充质细胞分化为骨系细胞。
在异位或常位的骨组织或软骨组织中形成过程中〔1〕,这类骨诱导物质作为形态原(Morphogen),可以为反应细胞所感知,通过激活或抑制细胞内的基因,调节骨系细胞的分化和增生。
1971年,Urist将这类诱导成骨物质定义为骨形态发生蛋白(BMPs)〔2〕。
在近20年中,人们不仅从多种动物骨组织中分离和纯化出天然的BMP-1、BMP-2、BMP-3和BMP-4,而且还通过基因重组技术进一步在中国仓鼠的卵母细胞和大肠杆菌中表达出了人类基因重组的骨形态发生蛋白(rhbMPs)〔3,4〕。
迄今为止,已经报导了13种BMPs,而且数目仍在继续增加〔5〕。
研究结果表明,在动物生长发育中,BMPs及其相应的受体几乎遍及动物体内所有内脏及体表器官。
因此,BMPs的功能远远地超出了单纯的骨诱导作用。
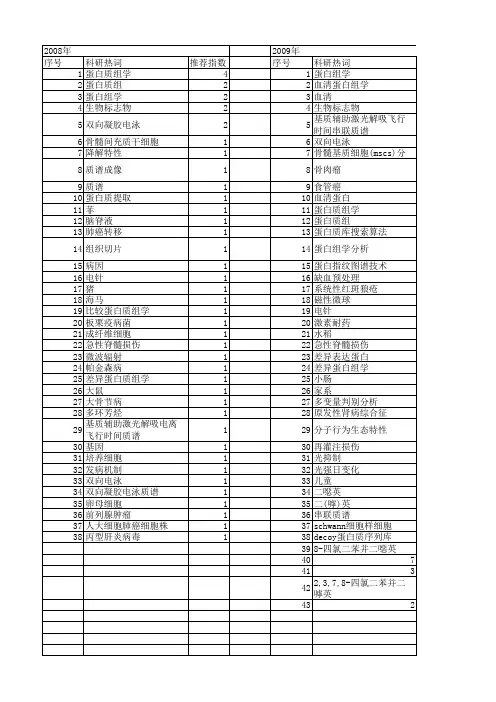
![骨髓活检诊断病理学基本知识介绍[1]](https://uimg.taocdn.com/758f935f804d2b160b4ec0a2.webp)
骨髓活检诊断病理学基本知识介绍一、骨髓组织的结构与功能(图1)(一)支持造血组织的骨组织结构1.骨小梁:骨小梁是骨皮质在松质骨内的延伸部分,即骨小梁与骨皮质相连接,在骨髓腔中呈不规则立体网状结构,如丝瓜络样或海绵状,起支持造血组织的作用。
正常情况下,骨小梁具有一定的长度,它们之间有一定距离。
骨小梁形成后至20岁左右,骨小梁表面被覆一层骨原细胞(osteogenic cell)或成骨细胞(o ast),因为都在骨髓腔内表面,故通称骨内膜细胞(endosteal cell)。
成骨细胞,排列在骨小梁表面,胞浆突起可与周围的成骨细胞胞浆相接,它是由紧贴骨表面扁平的骨原细胞发育来的(1)。
图1 骨髓组织基本结构图2 骨与骨髓组织结构从左到右:骨外膜、皮质骨、骨小梁及骨髓造血组和血管。
石蜡切片H-E 染色100 ×2.骨原细胞:骨原细胞可认为是松质骨或骨小梁表面处于静止状态的“干细胞”,具有多向分化的潜能,在不同的因子刺激下可转化为不同类型的细胞。
它常常与附近窦内皮相连续,在骨改建过程中它转化为成骨细胞,由扁平状变为立方状。
成骨细胞的作用是分泌骨胶原,合成骨基质中的有机成分(胶原和糖蛋白等)并身包埋在骨基质中。
在20岁以前的骨皮质内侧可见软骨基质(HE染色呈蓝色)及成串排列的软骨细胞,骨内膜面成骨细胞、破骨细胞也较多,软骨基质嗜呈浅灰蓝色。
20岁以后软骨细胞及软骨基质逐渐减少,成熟骨组织逐渐增多,25岁以后均为成熟板层骨(HE染色呈红色),成骨细胞及破骨细胞也明显减少Islam HHA(1985)认为在适当的造血因子作用下,骨原细胞还可能转化为造血干细胞并发育或演变为某些造血细胞,如可分化发育为粒系造血细胞。
因常骨髓幼稚粒系造血细胞总是靠近骨小梁表面生长的,并将逐步发育成熟的粒细胞推向骨小梁之间中央区。
即越靠近骨小梁粒系细胞越幼稚,越远离骨小系细胞越成熟。
3.破骨细胞:破骨细胞(osteoclast)是一种大型分支状游动细胞,胞体直径可长100μm ,其分支不规则,形状和大小不一,胞核大小也不一致,数目可由6~50个或更多不相连。

专题七细胞的衰老、凋亡和癌变1.(2012·新课标全国卷Ⅱ.2)下列关于细胞癌变的叙述,错误的是()A.癌细胞在条件适宜时可以无限增殖B.癌变前后,细胞的形态结构有明显差别C.病毒癌基因可整合到宿主基因组诱发癌变D.原癌基因的主要功能是阻止细胞发生异常增殖【答案】D【解析】本题主要考查细胞癌变的知识。
原癌基因主要负责调节细胞周期,控制细胞生长和分裂的进程;而抑癌基因才是阻止细胞不正常的增殖。
2.(2015·新课标Ⅱ卷,2)端粒酶由RNA和蛋白质组成,该酶能结合到端粒上,以自身的RNA 为模板合成端粒DNA 的一条链。
下列叙述正确的是()A.大肠杆菌拟核的DNA 中含有端粒B.端粒酶中的蛋白质为RNA聚合酶C.正常人细胞的每条染色体两端都含有端粒DNAD.正常体细胞的端粒DNA随细胞分裂次数增加而变长【答案】C【解析】每条染色体的两端都有一段特殊序列的DNA,称为端粒。
大肠杆菌是原核生物,原核生物中没有染色体,不含端粒,A项错误;从试题信息可知,端粒酶中的蛋白质是逆转录酶,而非RNA聚合酶,B项错误;正常人细胞的每条染色体两端都含有端粒DNA,C项正确;端粒DNA序列在每次细胞分裂后会缩短一截,所以正常体细胞的端粒DNA随细胞分裂次数增加而变短,D项错误。
3.(2016全国卷Ⅱ,1)在细胞的生命历程中,会出现分裂、分化等现象。
下列叙述错误..的是()A.细胞的有丝分裂对生物性状的遗传有贡献B.哺乳动物的造血干细胞是未经分化的细胞C.细胞分化是细胞内基因选择性表达的结果D.通过组织培养可将植物叶肉细胞培育成新的植株【答案】B【解析】解析:哺乳动物的受精卵是未经分化的细胞,而哺乳动物的造血干细胞是由受精卵分化形成的,属于已分化的细胞,只是分化程度不高,仍保留分裂和分化能力,B项错误。
4.(2018年全国卷Ⅱ,6)在致癌因子的作用下,正常动物细胞可转变为癌细胞。
有关癌细胞特点的叙述错误的是( )A.细胞中可能发生单一基因突变,细胞间黏着性增加B.细胞中可能发生多个基因突变,细胞的形态发生变化C.细胞中的染色体可能受到损伤,细胞的增殖失去控制D.细胞中遗传物质可能受到损伤,细胞表面糖蛋白减少【答案】A【解析】本题主要考查细胞癌变的原因和特点。

骨髓间充质干细胞成软骨分化机制研究进展张佳瑶同济大学口腔医学院·同济大学附属口腔医院修复科,上海牙组织修复与再生工程技术研究中心 200072刘玛丽浙江杭州师范大学 310000摘要:近年来,随着我国科技实力的不断增强,骨组织工程飞速发展,为骨修复带来了全新的期盼。
骨髓间充质干细胞是骨组织工程中的种子细胞,通过诱导骨髓间充质干细胞定向分化为软骨细胞能够有效治疗骨关节炎、软骨缺损等疾病,由于骨髓间充质干细胞在分化过程中不仅涉及众多信号通路,并且还会受到蛋白质、药物、RNA以及基因等多种因素的影响,因此,为进一步提升骨髓间充质干细胞在科学研究和临床中的应用效果,本篇文章将依据国内外的相关研究,对骨髓间充质干细胞成软骨分化机制的研究进展展开综述。
关键词:骨髓间充质干细胞;软骨细胞;分化机制引言:骨髓间充质干细胞是一种尚未分化充分的类中胚层细胞,具有多向分化潜能,能够在特定的条件下分化为成骨细胞、软骨细胞、脂肪细胞、心肌细胞以及神经元等[1-5]。
由于骨髓间充质干细胞取材方便、对身体损伤小并免疫原性相对较低,所以,它在组织工程学中的应用非常广泛,是骨组织工程中不可或缺的种子细胞。
近年来,随着我国人口老龄化的加剧,软骨病变、骨关节炎等疾病的发病率显著提升,对广大老年人群的机体健康和日常生活造成了严重的影响。
软骨组织主要由细胞外基质和软骨细胞共同组成,属于一种结缔组织,由于该组织内缺少血管和神经支配,一般无法自我再生,再加之软骨细胞的增殖能力也非常薄弱,所以,软骨损伤通常无法自我修复,如何有效治疗软骨相关疾病一直深受医学界的关注。
随着骨组织工程的高速发展,诱导骨髓间充质干细胞向软骨细胞分化在治疗软骨病变、骨关节炎等疾病中的优势作用日益凸显,但是,由于骨髓间充质干细胞成软骨在分化过程中很容易因发生肥大变性而生成纤维软骨,从而导致治疗陷入中断或者失败,故此,总结分析骨髓间充质干细胞成软骨分化机制的研究进展对于相关科学研究及临床治疗具有重要意义[6-10]。

骨髓间充质干细胞形态骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类存在于骨髓、脂肪组织和其他组织中的多能干细胞。
它们具有自我更新和多向分化的能力,可以分化为骨细胞、软骨细胞、脂肪细胞等不同类型的细胞。
骨髓间充质干细胞的形态特征对于研究其生物学特性和应用具有重要意义。
骨髓间充质干细胞在体外培养条件下呈现出一种纤维状或星状的形态。
它们具有较大的细胞体积和多个突起,这些突起可以与周围细胞或基质相互作用。
骨髓间充质干细胞的细胞质富含丰富的内质网和高尔基体,这些细胞器对于蛋白质合成和分泌起着重要作用。
骨髓间充质干细胞的细胞核通常呈椭圆形或不规则形状。
细胞核包含着遗传信息,控制着细胞的生长和分化。
骨髓间充质干细胞的细胞核内含有染色质和核仁,染色质是细胞遗传物质的主要组成部分,核仁参与核糖体的合成和蛋白质合成。
骨髓间充质干细胞的形态特征对于其功能和应用具有重要影响。
研究发现,骨髓间充质干细胞的形态与其增殖和分化能力密切相关。
较大的细胞体积和多个突起可以增加细胞与周围环境的接触面积,促进细胞间的信号传导和物质交换。
丰富的内质网和高尔基体可以提供足够的蛋白质合成能力,支持细胞的增殖和分化。
骨髓间充质干细胞的形态特征还可以用于鉴定和分离。
通过观察细胞的形态特征,可以初步判断细胞的纯度和活性。
一般来说,纤维状形态和较大的细胞体积是骨髓间充质干细胞的典型特征,而脱落细胞和变形细胞则可能是其他细胞类型的污染。
近年来,骨髓间充质干细胞作为一种重要的干细胞资源,被广泛应用于组织工程、再生医学和免疫治疗等领域。
其形态特征的研究不仅有助于深入了解其生物学特性和功能,还可以为其应用提供理论基础和实践指导。
骨髓间充质干细胞具有纤维状或星状的形态特征,具有较大的细胞体积和多个突起。
细胞核呈椭圆形或不规则形状,包含着遗传信息。
这些形态特征对于骨髓间充质干细胞的生物学特性、功能和应用具有重要意义。
通过研究骨髓间充质干细胞的形态特征,可以更好地理解其生物学行为和应用潜力,推动干细胞研究和临床应用的发展。
大学细胞生物学考试(试卷编号1151)1.[单选题]丙酮酸→二氧化碳+水的过程发生在:A)细胞质基质B)内质网C)溶酶体D)线粒体E.核糖体答案:D解析:2.[单选题]下列与微管的功能无关的是( )A)细胞内物质运输B)支持功能C)细胞运动D)胞质分裂答案:D解析:3.[单选题]下列过程中未体现生物膜信息传递功能的是 ( )A)蔗糖溶液使洋葱表皮细胞发生质壁分离B)抗原刺激引发记忆细胞增殖分化C)胰岛素调节靶细胞对葡萄糖的摄取D)传出神经细胞兴奋引起肌肉收缩答案:A解析:4.[单选题]中间纤维中的结蛋白主要存在于( )A)肌细胞B)上皮细胞C)神经细胞D)间质细胞答案:A解析:5.[单选题]间隙连接的基本单位是连接子,每个连接子由 ( ) 个相同或相似的跨膜蛋白亚单位环绕。
A)4B)6C)8解析:6.[单选题]关于核孔的描述不正确的是( )A)核孔的数目在代谢旺盛的细胞中较多B)核孔复合体是不对称结构C)核孔复合体是可以用“捕鱼笼”模型来解释D)在高等真核生物的细胞核上均匀分布有核孔答案:D解析:7.[单选题]一根完整的中间纤维,其横切面上有( )个蛋白分子。
A)4B)8C)16D)32答案:D解析:8.[单选题]电子显微镜使用( )替代光学显微镜的聚光镜、目镜和物镜A)电极B)滤色片C)气压D)液压答案:A解析:9.[单选题]有关细胞骨架下列哪个选项不正确?A)细胞骨架是指存在于整合细胞中的蛋白质网架系统。
B)广义的概念包括细胞质骨架和细胞核骨架。
C)细胞质骨架主要由微管、微丝和中间纤维组成。
D)核纤层属于细胞核骨架答案:D解析:10.[单选题]HPLC需要一个特殊的( )系统,因此能迫使溶液快速地通过柱子A)孔径B)电荷C)配体D)高压泵答案:D11.[单选题]由细胞外信号转换为细胞内信使,从而使细胞对外界信号做出相应的反应,这是通过下列哪种机制完成的( )A)信号转导B)cAMPC)第二信使D)信号分子答案:A解析:12.[单选题]能抑制CDK活性的酶是( )A)WellB)CAKC)CDC25D)p21答案:D解析:13.[单选题]下列哪种分子不是细胞的第二信使( )A)cAMPB)cGMPC)DAGD)GTP答案:D解析:14.[单选题]在细胞培养基中加入H-胸腺嘧啶核苷,培养30min,随后取样进行固定及放射自显影,结果发现( )A)所有进行有丝分裂的细胞的染色体中都掺入了标记的胸腺嘧啶核苷B)所有进行有丝分裂的细胞的染色体中都没有掺入标记的胸腺嘧啶核苷C)有的细胞,不论是否进行有丝分裂,其染色体中均掺入标记的胸腺嘧啶核苷D)所有的细胞,不论是否进行有丝分裂,其染色体中均没有掺入标记的胸腺嘧啶核苷答案:B解析:15.[单选题]下列连接方式中,除了( )外,都有通讯的作用。
间充质干细胞来源外泌体治疗骨关节炎的研究进展刘文彬摘要:骨性关节炎(OA )是一种最常见的关节退行性疾病,其病理变化主要是细胞炎症介导的软骨细胞凋亡和软骨细胞外基质(ECM )降解。
由于间充质干细胞(MSC )在特定条件培养基诱导下可以分化为软骨细胞,基于此,MSC 细胞疗法给OA 的治疗带来了新的希望。
然而,MSC 细胞疗法在技术上存在局限性,包括MSC 扩增时去分化,注射后再生效率降低,以及大规模细胞生产时质量控制不一致。
为了克服这些缺点,学者探讨了基于MSC 外泌体介导的软骨组织再生。
由于MSC 的外泌体为细胞间的通讯载体,能在细胞间传递脂质、核酸以及蛋白质等生物活性分子,因此可以作为治疗OA 的替代疗法。
近期的一系列体内研究表明,给予MSC 来源外泌体可有效减少软骨细胞中炎症细胞因子的产生,增加软骨ECM 成分的表达,最终增强软骨组织再生。
因此,本综述通过检索文献对MSC 来源外泌体治疗OA 的研究进展进行综述,为OA 的治疗提供新的思路。
关键词: 间充质干细胞;外泌体;骨性关节炎中图分类号:R684.3 文献标识码:A 文章编号:1007-6948(2021)03-0545-04doi :10.3969/j.issn.1007-6948.2021.03.036软骨组织是一种具有弹性的结缔组织,由透明质酸、胶原纤维、蛋白多糖和软骨细胞组成。
软骨组织无血管及神经结构。
这些结构特征往往限制了软骨中氧气和营养物质的充足供应,从而限制了受损软骨组织的有效再生[1-2]。
因此软骨组织在创伤、持续负重后易发生骨性关节炎(osteoarthritis, OA )[3-4]。
目前,OA 的发病机制尚不明确。
因此,针对OA 的治疗尚无有效的治疗手段。
目前,OA 的治疗方法主要包括:关节镜清理术、截骨畸形矫正术、单髁表面置换术和全膝关节表面置换术。
这些手段往往存在外源植入物感染、植入物或组织替代物寿命短、需要二次手术、新形成组织与天然软骨界面不一致等 缺点[5]。
骨髓间充质干细胞和成纤维细胞的蛋白质组学比较word格式论文骨髓间充质干细胞和成纤维细胞的蛋白质组学比较作者,赵亮,魏旭峰,孙阳,陈瑜,易定华【摘要】目的,采用蛋白质组学方法研究人骨髓间充质干细胞(hBMSCs)和成纤维细胞中的蛋白表达差异.方法,对hBMSCs和成纤维细胞的蛋白样本进行双向凝胶电泳分离,通过比较两种细胞的蛋白组学图谱,确定差异表达的蛋白点,而后对差异点进行基质辅助激光解析电离飞行时间质谱分析和蛋白数据库信息检索,最后选取其中的5种蛋白进行WesternBlot实验验证蛋白质组学的研究结果.结果,在hBMSCs和成纤维细胞中鉴定出29种差异表达蛋白,其中有17种蛋白在两种细胞中有显著差别地表达,另外12种蛋白在两种细胞中有相同丰度地表达.WesternBlot 的实验结果进一步验证了蛋白质组学分析的结果.结论,hBMSCs与成纤维细胞中蛋白的差异表达体现了两种细胞在细胞形态、结构和功能上的异同性,这对于研究hBMSCs向成纤维细胞分化以及应用 hBMSCs构建组织工程瓣膜具有重要意义.【关键词】骨髓间充质干细胞成纤维细胞蛋白质组学【Abstract】AIM:TofindoutthedifferencesandsimilaritiesontheprotEinexpressionsbetween humanbonemarrowmesenchymalstemcells(hBMSCs)andhumanfibroblasts,word格式论文whichhavedifferentcellcharacteristicsandsimilarcellmorphology.METHODS: TheprotEInextractswereobtainedfromhBMSCsandfibroblasts,andseparatedbytw o-dimensionalgelelectrophoresis(2-DE).Andthenthedifferentialproteinspotswereidentifiedbymatrix-assistedlaserdesorptionionization-timeofflight-massspectrometry(MALDI-TOF-MS).TheresultsfromsimultaneousproteomicprofilingwerefurthervalidatedbyWe sternBlotofselectedproteins.RESULTS:Twenty-ninedifferentialproteinsweresuccessfullyidentifiedinhBMSCsandfibroblasts .Amongthem,17proteinswereexpressedsignificantlydifferentlyinhBMSCsfromth atinfibroblasts,andanother12proteinsequallyexpressedinthe2typesofcells.C ONCLUSION:ThedifferentialproteinexpressionsbetweenhBMSCsandfibroblastspr ovideanewinsightintothedifferentialcellstructuresandfunctionsbetweenthe2 typesofcells,whichmightbevaluableforfurtherstudyoffibroblastsdifferentia tionfromhBMSCsandtheapplicationofhBMSCsforcreatingtissueengineeredheartv alvesinthefuture.【Keywords】bonemarrowmesenchymalstemcells,fibroblasts,proteomics0引言骨髓间充质干细胞,BMSCs,是目前理想的组织工程瓣膜间质细胞的种子细胞,相对于血管来源的种子细胞,MSCs具有获取方便、多向分化潜能, 以及独特的免疫特性,能够在同种异体微环境中组织中产生免疫耐受的优点,1-2,.该研究拟全面比较hBMSCs和成纤维细胞中蛋白表达的差异,进一步word格式论文在蛋白水平理解两种在细胞结构和功能差异.这对今后研究hBMSCs在体外向成纤维细胞的分化诱导,以及应用hBMSCs构建组织工程瓣膜是非常必要的.1材料和方法1.1材料人骨髓来源于本院骨髓穿刺室,经过骨髓细胞学检查排除了血液系统的恶性疾病.人成纤维细胞,HDF,是购自CellApplications公司,/index.htm,.细胞分离、培养的主要试剂,Percoll 淋巴细胞分离液(密度为1.073g/mL),DMEM/F12,低糖,,磷酸盐缓冲液(PBS),硫酸链霉素、青霉素,均自Gibco,USA,,胎牛血清,CD34,CD44,CD29和CD105抗体,Sigma,USA,.双向凝胶电泳的主要试剂,尿素、硫脲和甘油,均自Sigma,USA,,CHAPS(美国Merck),两性电解液、IPG预制胶条(pH3,10,130mm)和碘乙酰胺,均自Bio,Rad,USA,,Bradford蛋白质检测试剂盒(上海申能博彩生物科技有限公司).WesternBlot实验所用抗体,Sigma,USA,.1.2方法(1)细胞培养和hBMSCs的鉴定:骨髓经肝素钠生理盐水(1200U/mL)肝素化后,PBS液洗涤、离心,弃掉骨髓中的脂滴等杂质,而后采用Percall淋巴细胞分离液进行密度梯度离心,获得的单核细胞静置培养于DMEM/F12培养液,含100mL/L 的胎牛血清,2mmol/L谷氨酰胺(Bio-Whittaker)和50U/mL青霉素,50mg/mL庆大霉素.原代细胞在2,3d可见少量贴壁细胞,细胞形态多样、不均一,继续培养,细胞多呈梭形,漩涡样或放射状平行排列,形成较多的细胞集落.10,14d后细胞即达80%,90%融合,传代后细胞集落消失,细胞均匀分布,平行排列,较紧密,3,4d即可传1代.当hBMSCs扩增至第3代时,采用流式细胞术分析hBMSCs的表面分子.细胞不表达造血标志CD34,CD45,而强表达CD29,CD105,阳性率分别为99.4%和99.5%,3-4,.同时,在培养的第word格式论文3代细胞体系中加入成骨细胞和脂肪细胞诱导剂,可成功地诱导向成骨细胞和脂肪细胞分化,5,.这表明分离培养的细胞为具有多向分化能力的hBMSCs.成纤维细胞在上述细胞培养液中进行常规培养和扩增.,2,hBMSCs和成纤维细胞的双向凝胶电泳,2-DE,,将hBMSCs和成纤维细胞细胞分别悬于裂解液(8mol/L尿素,40mL/L的CHAPS,40mmol/LTris,适量PMSF)中,混匀后用液氮反复冻融,再加入适量RNA酶和DNA酶,冰浴20min.4?离心(14000g,30min),收集上清液.用Bradford法测定蛋白含量,其余蛋白样品在-80?中保存.双向凝胶电泳,2,DE,分离细胞蛋白提取物,第一向固相PH梯度等电聚焦(IEF),取适量蛋白样品与水化上样缓冲液(8mol/L尿素+40g/L的CHAPS+20mmol/LDTT+5μL/LIPG缓冲液+痕量溴酚蓝)混合,银染检测时蛋白质的上样量为100,200μg,考染检测时的上样量为800,1500μg,上样总体积350μL.按程序等电聚焦结束后,将胶条在平衡液?(6mol/L尿素+375mmol/LTris+20g/L的甘油+20g/L的SDS+20g/L的DTT)中平衡10min,清洗后再置入平衡液?(6mol/L尿素+375mmol/LTris+200g/L的甘油+20g/L的SDS+100mmol/L碘乙酰胺)中平衡10min.第二向垂直平板电泳,SDS2PAGE,,将胶条移至130mL/L的丙烯酰胺胶上分离.参照文献 ,6,的方法对凝胶进行银染并扫描成像,.3,图像分析,凝胶用AGFADuoScanT1200凝胶图像扫描仪扫描,比较分析hBMSCs和成纤维细胞全蛋白凝胶数字化图像,比对分析采用ImagingMaster2DElite5.0软件完成.确定有显著性差别的蛋白表达丰度比值标准为n,2或n,0.5.,4,质谱分析及数据库检索,对选取的蛋白点进行胶内酶切,提取多肽混合物,纯化后,取1μL溶液和等体积饱和基质溶液混合,加至不锈钢靶上,室温干燥,采用基质辅助激光解吸飞行时间质谱分析法,MALDI-TOF-MS,检测蛋白多肽.通过两种检索引擎Aldente(SCs和成纤维细word格式论文胞蛋白质组学研究的可靠性,从中选取5种差异表达的蛋白,α-smoothmuscleactin,α-SMA,,enolase1,vimentin,60SacidicribosomalproteinP0andcofilin-1,进行蛋白质印迹(WesternBlot)分析.各取两种细胞进行蛋白质组学分析的蛋白样品于100?变性5min.在具有10道双垂直电泳槽内每孔内加入60μg蛋白质,120ml/LSDS-PAGE电泳,转膜,50ml/L脱脂牛奶封闭2h,杂交一抗,4?过夜.PBST洗膜3次,每次10min.杂交二抗,室温摇床上1h,PBST洗膜3次,每次10min,DAB试剂盒显色.运用BandScanV5.0软件对免疫反应条带进行定量分析.统计学处理,资料用SPSSV10.0数据处理软件包进行统计学处理.计量资料以x?s表示,P0.05为有统计学意义.2结果2.1hBMSCs和成纤维细胞蛋白的差异表达hBMSCs和成纤维细胞全蛋白提取后,进行双向凝胶电泳分析,共进行3次实验得到银染结果,两张电泳图谱的蛋白斑点分布模式有相似性,图1,.1,17,两种细胞中不同表达丰度的蛋白;18,29,两种细胞有相同表达丰度的蛋白.图1hBMSCs(A)和人成纤维细胞(B)的双向凝胶电泳图,略,3次重复实验结果经ImagingMaster2DElite510软件分析,发现hBMSCs可以检测到782?65个点,成纤维细胞可以检测到760?57个点,这些蛋白质等电点和相对分子质量分布范围较广,但大多数集中于pH4,8,相对分子质word格式论文量15,100ku区域.对其中29个稳定表达的差异蛋白质斑点进行切割,用胰蛋白酶消化后进行MALDI-TOF-MS分析,通过UniProtKB/Swiss-PROT和NCBInonredundantproteindatabases蛋白数据库搜索,成功地鉴定出29种差异表达的蛋白,其中1,17种蛋白为两种细胞中有显著差别表达的蛋白点,18,29种蛋白为两种细胞中有相同丰度表达的蛋白点,表1,.表1hBMSCs和成纤维细胞中表达的29种蛋白,略,a,9.1,b,2.0,c,2.2,在hMBSCs中表达高出倍数,,d,10.5,在成纤维细胞中的表达高于的倍数,.2.2WesternBlot结果为验证双向电泳分析的准确性,选取其中的5种蛋白,α-平滑肌肌动蛋白,enolase1,vimentin,60SacidicribosomalprotEinP0andcofilin-1作进一步的蛋白质印迹分析,5种蛋白表达量比较与双向凝胶电泳蛋白表达丰度的比较结果一致,图2,.图2hBMSCs和人成纤维细胞中5种蛋白的WesternBlot结果,略,3讨论hBMSCs是目前理想的组织工程瓣膜的间质种子细胞,成纤维细胞较肌成纤维细胞对于维持正常心脏瓣膜的结构和功能具有更重要的意义,7-10,.但尚不清楚hBMSCs向成纤维细胞进行分化的机制, 应用 hBMSCs构建的组织工程瓣膜均需移植入动物体内后一段时间才能完成组织工程瓣膜的成纤维细胞表型和基质的最后重塑.但是,有研究表明组织工程产品在体内复杂的生物word格式论文环境中重塑会存在个体差异性,11,,可能会导致组织工程瓣膜不能被很好的重塑而导致再次衰败.因此,通过比较hBMSCs和成纤维细胞中的蛋白表达差异,从细胞的蛋白水平理解两种细胞的结构和功能上的差异,对于研究在体外诱导hBMSCs向成纤维细胞分化,以及应用hBMSCs构建TEHV是非常必要的.hBMSCs最初被定义为骨髓中在体外能够粘附生长、增殖和具有自我更新和多向分化能力的“成纤维细胞”样细胞,5,,它们在形态上和成纤维细胞非常的相似.免疫细胞化学分析显示hBMSCs具有肌成纤维细胞样的表型特点,7-8,.通过流式细胞分析技术研究,一系列的表面分子在hBMSCs中被发现,3-4,,然而,有研究发现那些细胞表面分子在成纤维细胞表面有同样的表达.此后,进一步通过基因组学的方法研究发现,在两种细胞中确实存在一些差异基因.蛋白质组,作为细胞基因组的最后表达,能够更详尽、更直接地描述细胞的结构和功能特点,12,.我们第一次采用比较蛋白质组学的方法研究了hBMSCs和人成纤维细胞的蛋白表达差异.采用2-DE分离细胞蛋白样本,银染凝胶,而后挖取蛋白点进行质谱分析仍是目前有效的蛋白质组学研究方法.在这项研究中,通过比较hBMSCs和成纤维细胞蛋白的2-DE图谱,对其中29个稳定表达的差异蛋白质斑点进行了质谱分析、鉴定,相应蛋白数据库信息检索和功能分析.在hBMSCs和成细胞中具有等量高丰度的表达.这种蛋白在两种细胞中的相同表达显示了两种细胞在形态和组织来源上相似性.为了验证蛋白组结果的可靠性,我们进行鉴定、分析的29种差异蛋白中,选出5种蛋白进行了word格式论文WesternBlot实验.两种实验得出了相同的结果,进一步证实采用蛋白质组学方法在蛋白水平研究细胞的形态、结构和功能的可靠性,13,.实验通过分析hBMSCs和成纤维细胞中的蛋白差异表达清楚看到了两种细胞性质不同的hBMSCs和成纤维细胞在形态、结构和功能上异同性.这些结果对于我们今后研究hBMSCs向成纤维细胞分化和应用hBMSCs构建TEHV 是非常有意义的.【参考文献】,1,ProckopDJ.Marrowstromalcellsasstemcellsfornonhematopoietictissues,J, .Science,1997,276:71-74.,2,LiechtyKW,MackenzieTC,ShaabanAF,etal.Humanmesenchymalstemcellsengraf tanddemonstratesite-specificdifferentiationafterinuterotransplantationinsheep,J,.NatMed,2000 ,6:1282-1286.,3,BrentonS,Nathalie,B,TeresaOS,etal.MesenchymalStemCells,J,.ArchMed Res,2003,34:565-571.,4,HaynesworthSE,BaberMA,CaplanAI.Cellsurfaceantigensonhumanmarrow-deri word格式论文vedmesenchymalcellsaredetectedbymonoclonalantibodies,J,.Bone,1992,13:69-80.,5,FriedenstEInAJ,ChailakhyanRK,LalykinaKS. The developmentoffibroblastcoloniesinmonolayerculturesofguineapigbonemarrowa ndspleencells,J,.CellTissueKinet,1970,3:393-402.,6,CandianoG,BruschiM,MusanteL,etal.Bluesilver:avery-sensitivecolloidalCoomassieG-250stainingforproteomeanalysis ,J,.Electrophoresis,2004,25:1327-1333.,7,HoerstrupSP,KadnerA,MelnitchoukS,etal.Tissueengineeringoffunctionalt rileafletheartvalvesfromhumanmarrowstromalcells,J,.Circulation,2002,106:1143-1150.,8,AlexanderK,SimonPH,GregorZ,etal.Anewsourceforcardiovasculartissueeng ineering:humanbonemarrowstromalcells,J,.EurJCardiothoracSurg,2002,21:1055-1160.word格式论文,9,ReyesM,LundT,LenvikT,etal.Purificationandexvivoexpansionofpostnatalh umanmarrowmesodermalprogenitorcells,J,.Blood,2001,98:2615-2625.,10,PittengerMF,MackayAM,BeckSC,etal.Multilineagepotentialofadultmesench ymalstemcells,J,.Science,1999,284:143-147.,11,McBreartyBA,ClarkLD,ZhangXM,etal.Geneticanalysisofamammalianwound-healingtrait,J,.ProcNatlAcadSciUSA,1998,95:11792-11797.,12,BlackstockWP,WeirMP.Proteomics:quantitativeandphysicalmappingofcellu larproteins,J,.TrendsBiotechnol,1999,17:121-127.,13,PanepucciRA,SiufiJL,SilvaWAJr,parisonofgeneexpressionofumbil icalcordveinandbonemarrow-derivedmesenchymalstemcells,J,.StemCells,2004,22:1263-1278.。