2018版高考化学二轮复习难点增分四化学平衡图像专题训练
- 格式:doc
- 大小:314.50 KB
- 文档页数:8
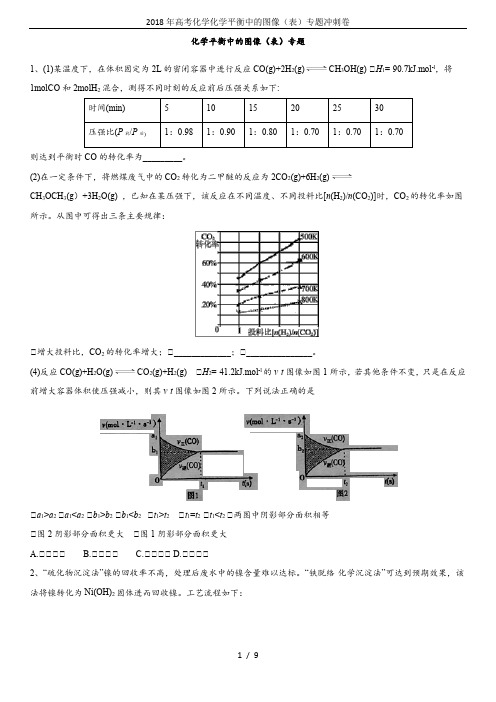
化学平衡中的图像(表)专题1、(1)某温度下,在体积固定为2L的密闭容器中进行反应CO(g)+2H 2(g)CH3OH(g) △H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:则达到平衡时CO的转化率为_________。
(2)在一定条件下,将燃煤废气中的CO 2转化为二甲醚的反应为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ,已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图所示。
从图中可得出三条主要规律:①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应CO(g)+H 2O(g)CO2(g)+H2(g) △H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。
下列说法正确的是①a1>a2 ②a1<a2③b1>b2④b1<b2 ⑤t1>t2⑥t1=t2⑦t1<t2 ⑧两图中阴影部分面积相等⑨图2阴影部分面积更大⑩图1阴影部分面积更大A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩2、“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。
“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。
工艺流程如下:“脱络”(指镍元素由络合物NiR2转化成游离的Ni2+)过程中,R—与中间产物·OH(羟基自由基)反应生成难以与Ni2+络合的·R(有机物自由基),但·OH也能与H2O2发生反应。
反应的方程式如下:Fe2+ + H2O2Fe3+ + OH- + —OH iR- +—OH OH-+ —R iiH2O2 +2—OH O2↑ + 2H2O iii实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是_________。
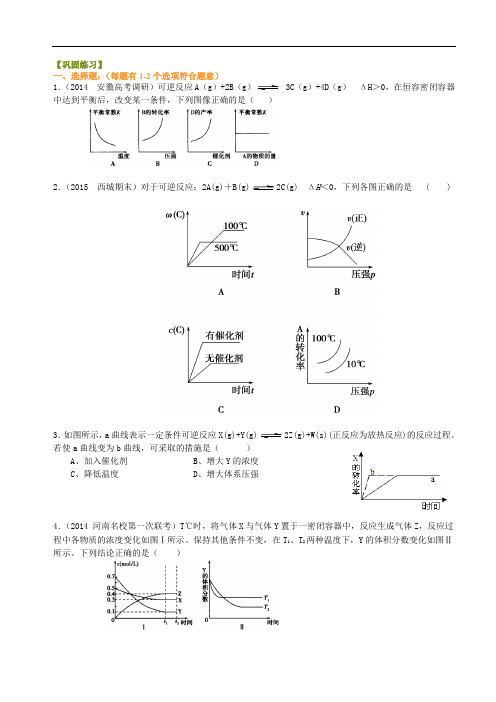
【巩固练习】一、选择题:(每题有1-2个选项符合题意)1.(2014 安徽高考调研)可逆反应A(g)+2B(g) 3C(g)+4D(g)ΔH>0,在恒容密闭容器中达到平衡后,改变某一条件,下列图像正确的是()2.(2015 西城期末)对于可逆反应:2A(g)+B(g)2C(g) ΔH<0,下列各图正确的是 ( )3.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A、加入催化剂B、增大Y的浓度C、降低温度D、增大体系压强4.(2014 河南名校第一次联考)T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图Ⅰ所示。
保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图Ⅱ所示。
下列结论正确的是()A.t2时,保持其他条件和物质状态不变,增大压强,化学平衡向逆反应方向移动B.其他条件不变,若升高温度,正、逆反应速率均增大,且X的转化率增大C.图Ⅱ中T1>T2,正反应是吸热反应D.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L5.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H= -1025kJ/mol该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )6.I2在KI溶液中存在下列平衡:I2 (aq) + I-(aq)I3-(aq)。
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是A.反应I2 (aq) + I-(aq)I3-(aq)的△H >0B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 > K2C.若反应进行到状态D时,一定有υ正> υ逆D.状态A与状态B相比,状态A的c(I2)大7.已知反应:2CH3COCH3(l)CH3COCH2COH(CH3)2(l)。

2018年全国卷高考化学总复习《化学平衡》专题集训一、选择题(每题有1-2个选项符合题意)1.对可逆反应,R (g)+P (g) Q (g)+S (g),达到平衡状态的标志是( )A .R 、P 、Q 、S 浓度相等B .反应前后压强不变C .反应前后质量不变D .R 、P 、Q 、S 浓度不变2.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应: A (s)+2B (g) C (g)+D (g)已达平衡的是( )A .混合气体的压强B .混合气体的密度C .B 的物质的量浓度D .气体的总物质的量3.下列关于平衡常数K 的说法中,正确的是( )A .在任何条件下,化学平衡常数是一个恒定值B .改变反应物浓度或生成物浓度都会改变平衡常数KC .平衡常数K 只与温度有关,与反应浓度、压强无关D .从平衡常数K 的大小不能推断一个反应进行的程度4.高温下,某反应达平衡,平衡常数222(CO)(H O)(CO )(H )c c K c c ⋅=⋅。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是( )A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C.升高温度,逆反应速率减小5.在密闭容器中进行如下反应:X g Y g Z g 222()()()+ ,已知、、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )A .Z 为0.3mol/LB .为0.35mol/LC .为0.2mol/LD .为0.4mol/L6.在容积可变的密闭容器中,2mo1N 2和8mo1H 2在一定条件下发生反应,达到平衡时,H 2的转化率为25%,则平衡时的氮气的体积分数接近于( )A .5%B .10%C .15%D .20%7.在25℃时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表:下列说法错误..的是( ) A .反应达到平衡时,X 的转化率为50%B.反应可表示为X+3Y2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数8.在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)4C(g)+D(g) ΔH<0。


化学平衡图像知识归纳化学平衡图像基本分析方法(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。
例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
常见的化学平衡图象以反应mA(g)+nB(g)pC(g)+qD(g),m+n>p+q且△H>0为例(1)v—t图象(2)c——t图象(3)c——p(T)图象图像问题解题技巧(1)看图象:一看轴,即纵、横坐标的意义;二看点,即起点、拐点、交点、终点;三看线,即线的走向和变化趋势;四看辅助线,即等温线、等压线、平衡线等;五看量的变化,如浓度变化、温度变化、转化率变化、物质的量的变化等。
(2)依据图象信息,利用平衡移动原理,分析可逆反应的特征:吸热还是放热,气体计量数增大、减小还是不变,有无固体或纯液体参加或生成等。
(3)先拐先平:在化学平衡图象中,先出现拐点的反应先达到平衡,可能是该反应的温度高、浓度大、压强大或使用了催化剂。
(4)定一议二:勒夏特列原理只适用于一个条件的改变,所以图象中有三个变量时,先固定一个量,再讨论另外两个量的关系。
例题精讲例1、在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO 2(g)+c(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。
下列说法正确的是()A.反应CO2(g)+c(s)2CO(g) △S>0、△H<0B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)【答案】BC【考点定位】考查熵变、焓变、勒夏特列原理、等效平衡知识。

2018年全国卷高考化学总复习《化学平衡移动》专题集训一、选择题:(每题有1-2个选项符合题意)1.将BaO2放入密闭的真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡.保持温度不变,缩小容器体积,体系重新达到平衡,下列说法正确的是()A.平衡常数减小B.BaO量不变C.氧气压强不变D.BaO2量增加2.对于平衡CO2 (g)CO2 (aq);ΔH=―19.75 kJ·mol―1。
为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压C.升温减压D.降温增压3.在密闭容器中充入1 mol CO和1 mol H2O(g)在一定条件下,达到平衡时生成了2/3mol CO2(反应为CO+H2O(g)CO2+H2)。
其他条件不变,充入的水蒸气改变为2 mol时,平衡时生成CO2的物质的量可能是()A.0.5 mol B.0.95 mol C.1 mol D.2/3 mol4.恒温条件下,把装入带活塞的密闭容器中,当反应达到平衡后,慢慢压缩,下列叙述正确的是()A.体积减半,则压强为原来的两倍B.平衡向右移动,混合气体的颜色一定会变浅C.体积减半,压强增大,但小于原来的2倍D.平衡向右移动,混合气体密度增大5.在一定固定的密闭容器中,放入3mol X(g)和2mol Y(g),在一定条件下发生反应:达平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是()A.3 B.4 C.5 D.66.某温度下,在固定容积的密闭容器中,可逆反应A (g)+3B (g)2C (g)达到平衡时,各物质的物质的量之比为n (A)∶n (B)∶n (C)=2∶2∶1。
保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则()A.平衡不移动B.再达平衡时,n (A)∶n (B)∶n (C)仍为2∶2∶1C.再达平衡时,C的体积分数增大D.再达平衡时,正反应速率增大,逆反应速率减小7、体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等。
3课时化学平衡图像、等效平衡[学习目标定位] 1.认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。
2.知道等效平衡的含义,学会等效平衡的分析判断方法。
一化学平衡图像1.在2 L刚性密闭容器中,某一反应有关物质A(g)、B(g)、C(g)的物质的量变化如图所示。
根据图像回答下列问题:(1)横坐标表示________________________,纵坐标表示________________________。
(2)该反应的化学方程式是__________________________________________________。
(3)在反应进行到2 min时,正反应速率与逆反应速率之间的关系是________。
(4)若用A物质的量浓度的变化表示反应达平衡(2 min)时的正反应速率,则v(A)=________。
2.在化学平衡图像中,包括纵坐标、横坐标和曲线,所表示的意义共三个量。
确定横坐标所表示的量后,讨论纵坐标与曲线的关系;或者确定纵坐标所表示的量,讨论横坐标与曲线的关系。
即“定一议二”原则。
解题过程中,可以作辅助线帮助分析。
例如反应a A(g)+b B(g)c C(g)在不同温度下(T1<T2),压强(p)与混合气体中C的含量(C%)的关系图像如图所示。
根据图像回答下列问题:(1)T1为一条等温线,随着压强的增大,C%________,化学平衡________移动,a+b________c。
(2)在压强一定时(如p3),温度升高,C%的变化是______,化学平衡______移动,正反应是________反应。
3.在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图1)或表示的压强较大(如图2)[仍以a A(g)+b B(g)c C(g)为例]。
根据图像回答下列问题:(1)图1中,温度T1、T2的大小关系是________,温度升高,C%(C的含量)的变化是________,化学平衡______移动,正反应是________反应。
专题训练(四)化学平衡图像1.在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,其中正确的是( )解析:选B 由p2>p1可推得反应图像中p2先出现拐点,故A、C两项错误;此反应为反应前后气体体积增大的反应,增大压强,平衡逆向移动,Z的体积分数减小,D错误,B正确。
2.COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是( )A.①表示随温度升高,平衡常数的变化B.②表示t1时刻加入催化剂,反应速率随时间的变化C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化D.④表示CO的体积分数随充入Cl2量的变化解析:选D 反应是吸热反应,升高温度平衡正向移动,平衡常数增大,A错误;催化剂改变反应速率不改变化学平衡,速率同等程度增大,速率变化曲线不符合,B错误;恒压容器中加入与平衡无关的气体,体积增大,压强减小,平衡正向进行,反应物转化率增大,C错误;充入Cl2,平衡逆向移动,CO的体积分数减小,D正确。
3.(2017·西安模拟)在容积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立化学平衡:a A(g)+b B(g) x C(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。
在图中,Y轴是指( )A.反应物A的百分含量B.平衡混合气中物质B的百分含量C.平衡混合气的密度D.平衡混合气的平均摩尔质量解析:选D 由左图可知,在相同温度下,增大压强(p2>p1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x;在相同压强下,升高温度(T1>T2),C的百分含量降低,说明升高温度平衡向逆反应移动,该反应的正反应为放热反应。
增大压强平衡向正反应方向移动,A的百分含量减小,与图像不符,A错误;增大压强平衡向正反应方向移动,B的百分含量减小,与图像不符,B错误;由于反应容器的容积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,C错误;升高温度,平衡向逆反应方向移动,混合气体的物质的量增多,质量不变,平衡混合气的平均摩尔质量减小,增大压强,平衡向正反应方向移动,平衡混合气的平均摩尔质量增大,与图像相符合,D正确。
4.(2017·成都七中月考)在2 L恒容密闭容器中充入2 mol X和1mol Y,发生反应:2X(g)+Y(g) 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。
下列推断正确的是( )A.Q点时,Y的转化率最大B.升高温度,平衡常数增大C.W点X的正反应速率等于M点X的正反应速率D.平衡时充入Z,达到新平衡时Z的体积分数增大解析:选A 从开始到Q点是正向建立平衡的过程,转化率逐渐增大,从Q点到M点升高温度,平衡向左移动,X的转化率降低,Q点最大,A正确;分析图像,X的体积分数先减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,X的体积分数增大,说明升温平衡左移,平衡常数减小,B错误;M点温度高,故反应速率快,C错误;平衡时再充入Z,相当于增大压强,平衡不移动,体积分数相等,D错误。
5.甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g) ΔH=Q,甲醇的平衡转化率随温度变化曲线如图所示。
下列有关说法正确的是( ) A.Q<0B.600 K时,Y点甲醇的v(正)<v(逆)C.从Y点到Z点可通过增大压强实现D.从Y点到X点可通过使用催化剂实现解析:选B 由图可知,温度越高甲醇的平衡转化率越高,说明升高温度化学平衡正向移动,反应为吸热反应,ΔΗ>0,A错误;600 K时,Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行,即v(正)<v(逆),B正确;由图可知Y点和Z点甲醇转化率相等,若在Y点增大压强,平衡向逆反应方向移动,甲醇转化率减小,则甲醇的转化率将小于Z 点甲醇转化率,C错误;Y点和X点两点甲醇的平衡转化率不同,如果从Y点到X点平衡发生移动,不能使用催化剂,D错误。
6.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+x B(g) 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( )A .30~40 min 内该反应使用了催化剂B .化学方程式中的x =1,正反应为吸热反应C .30 min 时降低温度,40 min 时升高温度D .8 min 前A 的平均反应速率为0.08 mol·L -1·min -1解析:选D 若使用催化剂,则化学反应速率增大,A 错误;由左图知,A 、B 的浓度变化相同,故A 、B 的化学计量数相同,都为1;由右图知,30 min 时改变的条件为减小压强,40 min 时改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应为放热反应,B 、C 错误;8 min 前A 的平均反应速率为 2.00-1.36 mol·L -18 min=0.08 mol·L -1·min -1,D 正确。
7.(2017·青岛模拟)T ℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ΔH <0,按照不同配比充入A 、B ,达到平衡时容器中A 、B 浓度变化如图中曲线(实线)所示,下列判断正确的是( )A .T ℃时,该反应的平衡常数值为4B .c 点没有达到平衡,此时反应向逆向进行C .若c 点为平衡点,则此时容器内的温度高于T ℃D .T ℃时,直线cd 上的点均为平衡状态解析:选C 由A(g)+B(g) C(s) ΔH <0知,平衡常数K =1c A ·c B =11×4=0.25,A 错误;依据图像可知,c 点浓度商Q <K ,反应正向进行,B 错误;反应是放热反应,若c 点为平衡点,此时平衡常数小于T ℃平衡常数,说明平衡逆向进行,是升温的结果,温度高于T ℃,C 正确;T ℃时平衡常数不变,曲线上各点处于平衡状态,c 点不在曲线上,在该温度下不是平衡状态,D 错误。
8.(2015·四川高考)一定量的CO 2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2(g) 2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p 分)=气体总压(p 总)×体积分数。
下列说法正确的是( )A .550 ℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动B .650 ℃时,反应达平衡后CO 2的转化率为25.0%C .T ℃时,若充入等体积的CO 2和CO ,平衡向逆反应方向移动D .925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p =24.0p 总解析:选B A 项,550 ℃时,若充入惰性气体,v 正、v 逆均减小,由于压强不变,相当于扩大了体积,平衡正向移动,错误;B 项,根据图示可知,在650 ℃时,CO 的体积分数为40%,根据反应方程式:C(s)+CO 2(g) 2CO(g),设开始加入1 mol CO 2,反应掉了x mol CO 2,则C(s) + CO 2(g) 2CO(g)起始(mol) 1 0变化(mol) x 2x平衡(mol) (1-x ) 2x因此有:2x 1-x +2x ×100%=40%,解得x =0.25,则CO 2的平衡转化率为0.25 mol 1 mol×100%=25%,正确;C 项,由图可知,T ℃时,CO 与CO 2的体积分数相等,在等压下充入等体积的CO 和CO 2,对原平衡条件无影响,平衡不移动,错误;D 项,925 ℃时,CO 的体积分数为96%,故K p =c 2 CO c CO 2 = 96%p 总 24%p 总=23.04p 总,错误。
9.(2017·武汉模拟)T ℃时,在2 L 密闭容器中使X(g)与Y(g)发生反应生成Z(g)。
反应过程中X 、Y 、Z 的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T 1和T 2时,Z 的百分含量与时间的关系如图2所示。
则下列结论正确的是( )A .容器中发生的反应可表示为3X(g)+Y(g) ===2Z(g)B .反应进行的前3 min 内,用X 表示的反应速率v (X)=0.2 mol·L -1·min -1C .保持其他条件不变,升高温度,反应的化学平衡常数K 减小D .若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强解析:选C A项,由图1知,X、Y为反应物,Z为生成物,且该反应为可逆反应,Δn(X)∶Δn(Y)∶Δn(Z)=0.6∶0.2∶0.4=3∶1∶2,所以反应的化学方程式为3X(g)+Y(g) 2Z(g),错误;B项,反应进行的前3 min内,v(X)=0.6 mol2 L×3 min=0.1 mol·L-1·min-1,错误;C项,由图2知,T2>T1温度升高时Z的百分含量降低,说明平衡向逆反应方向移动,平衡常数减小,正确;D项,图3与图1比较,图3到达平衡所用的时间短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,错误。
10.(2017·临沂模拟)工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。
为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=________mol·L-1·min-1。
(2)氢气的转化率=________。
(3)求此温度下该反应的平衡常数K=________。
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________。
A.将H2O(g)从体系中分离出去B.充入He(g),使体系压强增大C.升高温度D.再充入1 mol CO2和3 mol H2(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1______c2(填“>”“<”或“=”)。