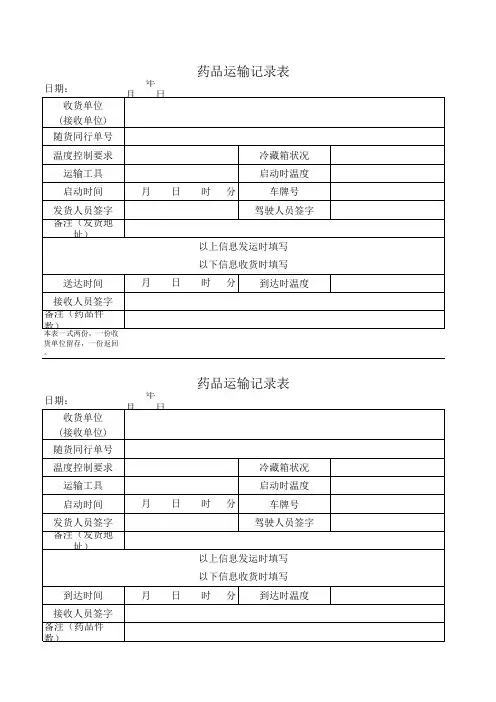
购进药品收货记录表
- 格式:doc
- 大小:50.50 KB
- 文档页数:1

药品经营企业在质量管理中的每一个环节,都应有相应的文字记录,质量管理工作是否完善,实际操作是否到位,从原始记录就能查看出来。
因此GSP记录是否完整、规范最能体现门店对质量管理是否重视,门店的各项管理工作是否到位,认真做好每一项记录,是门店全体员工的必修课。
记录填写指导一、基本要求1、统一用黑色水性笔填写。
2、记录不得涂改、粘贴、不得留有空行。
3、记录时逐行填写,不得打省略号。
4、记录有误时,用直尺划一横线(红色)并在旁边注明更正日期和更正人姓名,另取一行重新填写正确的内容。
5、每项记录都要有专用封面,装订固定后放入资料盒中备查。
6、记录封面应填写记录名称及起始日期。
二、温湿度记录1、记录前先填好店名、月份。
2、手工填写适宜温度范围。
3、营业场所:0~30 ℃;冷藏柜:2~10 ℃;阴凉柜:20℃以下4、适宜相对湿度范围35﹪~75﹪5、每天上午9:00~10:00、下午3:00~4:00各填写一次,每次记录完毕应及时签名。
6、调控措施后应将调控到适宜范围内温湿度数据重新填写。
三、养护设备使用及维护记录1、夏季室温达到30℃以上是开空调降温,时间从上午8时开始,至晚上21时左右为止。
作好记录。
(设施设备使用记录,应与温湿度记录相对应)2、相对湿度达到或超过75﹪时,采用通风或开空调的方法除湿。
3、生物制品等需2℃~10 ℃以内保存的药品应放入冷藏柜密封保存(如:人血白蛋白注射液、人免疫球蛋白、诺和灵30R笔芯、胰岛素制剂、重组人干扰素α-2b凝胶等)。
4、室温达到或超过20℃时,需20 ℃以下保存的药品应放入阴凉柜密封保存,如:乌体林斯注射液;卡介菌多糖核酸注射液/斯奇康注射液;阿托伐他汀片/阿乐;非洛地平缓释片/波依定;双氯芬酸钠双释放肠溶胶囊/戴芬胶囊;去氧孕烯炔雌醇片/妈富隆;阿卡波糖片/拜糖平片;糠酸莫米松软膏/艾洛松氟伐他汀胶囊/来适可胶囊;阿司匹林维生素C泡腾片/拜阿司匹灵等。
5、填写时应标明以下内容:门店名称、设备名称、规格型号、设备编号、年份等。

GSP药品验收管理操作规程1、目的:建立药品验收操作规程,规范药品验收工作,确保符合法定标准和有关规定的要求。
2、依据:《药品经营质量管理规范》。
3、适用范围:适用于购进和销后退回药品的验收工作。
4、职责:药品质量验收员对本规程的实施负责。
5、内容:5.1《购进药品验收记录》5.1.1 检查随货同行单是否项目完整齐全、清晰可辨。
随货同行单应有供货单位、药品的通用名称、生产厂商、剂型、规格、批号、数量、收货单位、收货地址、发货日期等内容,并加盖供货单位药品出库专用章原印章。
如单据不合格,不得验收并通知采购部门处理。
5.1.2 随货同行单审核合格后,根据采购部的《采购订单》和供货方的随货同行单,在药品管理系统制作《购进药品验收记录》,并对照实物进行质量验收。
《采购订单》与供货方的随货同行单不相符的,不得验收并通知采购部处理。
5.2《销后退回药品验收记录》:依据销售部门的《药品销后退回通知单》在药品管理系统制作《销后退回药品验收记录》,并对照实物进行质量验收。
5.3 药品验收:5.3.1 验收的内容:外观、包装、标签、说明书及有关证明文件的检查。
5.3.2 验收的标准:种类:操作规程编号:DGYX-QP-03-04 版号:第4 版页码:第2 页,共5 页5.3.2.1 国家药品标准:《中国药典》、《中国生物制品规程》、局(部)颁标准等。
5.3.2.2 与供应商签订的购货合同或质量保证协议。
5.3.3 验收原则验收人员应对购进药品和销后退回药品进行逐批抽样验收;5.3.4 抽样的原则:验收抽取的样品应具有代表性,采用逐批随机原则抽取。
5.3.5 抽样检查的方法:5.3.5.1 对到货的同一批号的整件药品按照堆码情况随机抽样检查,整件数量在2 件及以下的应当全部抽样检查;整件数量在2 件以上至50 件以下的至少抽样检查3 件;整件数量在50 件以上的每增加50 件,至少增加抽样检查1 件,不足50 件的按50 件计。
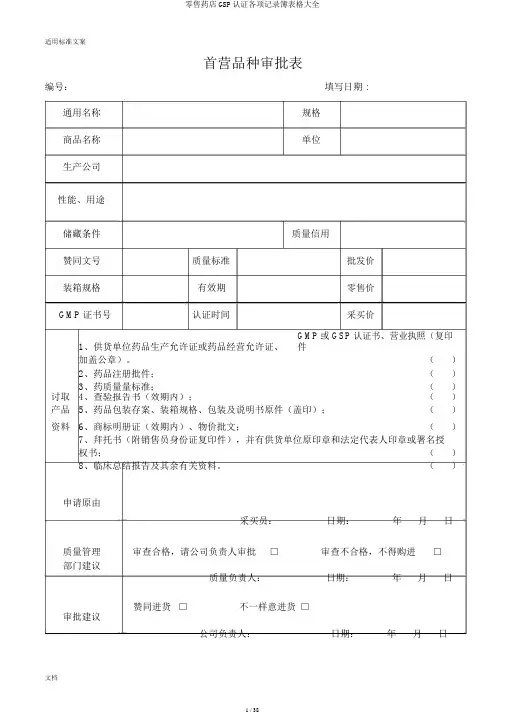
首营品种审批表编号:填写日期 :通用名称规格商品名称单位生产公司性能、用途储藏条件质量信用赞同文号质量标准批发价装箱规格有效期零售价GMP证书号认证时间采买价1、供货单位药品生产允许证或药品经营允许证、GMP或 GSP认证书、营业执照(复印件加盖公章)。
()2、药品注册批件;()讨取3、药质量量标准;()4、查验报告书(效期内);()产品5、药品包装存案、装箱规格、包装及说明书原件(盖印);()资料6、商标明册证(效期内)、物价批文;()7、拜托书(附销售员身份证复印件),并有供货单位原印章和法定代表人印章或署名授权书;()8、临床总结报告及其余有关资料。
()申请原由采买员:日期:年月日质量管理审查合格,请公司负责人审批□审查不合格,不得购进□部门建议质量负责人:日期:年月日赞同进货□不一样意进货□审批建议公司负责人:日期:年月日备注适用标准文案首营公司审批表编号:填表日期:公司名称类型□药品生产公司拟供品种□药品经营公司详尽地址邮政编码联系人联系电话传真允许证名称允许证号许 公司名称负责人可允许范围有效期至年 月 日证公司地址发证机关及日期营 公司名称注册号业 法定代表人 经济性质注册资本 执 经营范围经营方式照 公司地址 发证机关及日期年 月 日质量认证证书与编号有效限期1、供货单位合法证件:药品生产允许证或药品经营允许证、营业执照复印件(加 盖公章); ( )2、供货单位 GMP 或 GSP 认证证书; ( ) 需讨取3、质量系统检查表或合格供货方档案表; ( )4、质量保证协议; ( ) 公司相5、开户信息(户名、开户银行及账号) ; ( )关资料6、印章印模、随货同行单、 发票样表;( )7、拜托书(附销售员身份证复印件),并有供货单位原印章和法定代表人印章或署名受权书; ( )8、其余证件。
(详细内容:) ( )负责人:年 月 日实地观察结论:观察人:年月 日审查合格,请公司负责人审批。
任务二 药品验收验收是指验收人员依据国家相关法律法规和有关规定、企业验收标准对采购药品的质量状况进行检查的过程。
包括查验药品检验报告书、抽样、查验药品质量状况、记录等。
验收员应按照药品验收程序,严格对药品外观性状、内外包装、标识以及相关证明文件等进行检查,确保药品的质量。
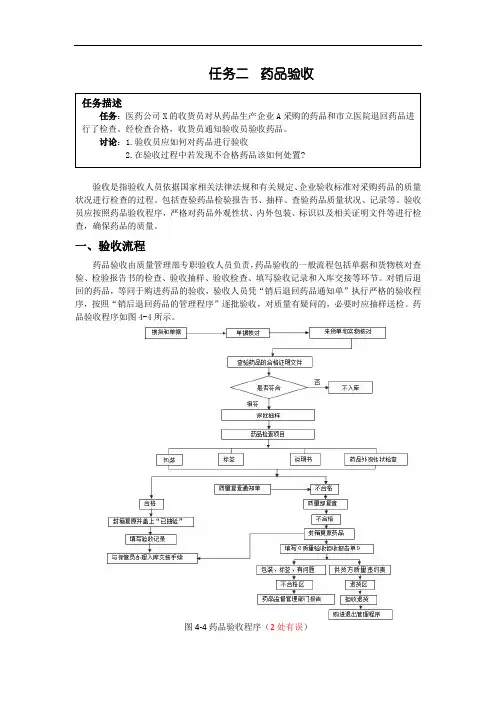
一、验收流程药品验收由质量管理部专职验收人员负责,药品验收的一般流程包括单据和货物核对查验、检验报告书的检查、验收抽样、验收检查、填写验收记录和入库交接等环节。
对销后退回的药品,等同于购进药品的验收,验收人员凭“销后退回药品通知单”执行严格的验收程序,按照“销后退回药品的管理程序”逐批验收,对质量有疑问的,必要时应抽样送检。
药品验收程序如图4-4所示。
图4-4药品验收程序(2处有误)(一)待验收货人员对符合收货要求的药品,按品种特性要求放于相应待验区域,或者设置黄色待验状态标志,通知验收。
验收员接过收货员交接的随货同行单和同批号药品检验报告书到待验区进行验收,验收员应在规定时限内进行验收。
冷藏、冷冻药品应当在冷库内待验。
(二)单据、货物核对查验1.单据核对验收员调出计算机软件系统中的验收记录单,再次与随货同行单核对。
2.单据与实货核对首先清点大件数量,然后根据随货同行单逐一核对品名、规格、数量、生产批号、有效期至、生产企业、批准文号。
(三)检验报告书的检查验收药品应当按照批号逐批查验药品的合格证明文件,对于相关证明文件不全或内容与到货药品不符的,不得入库,并交质量管理部门处理。
验收药品应当按照药品批号查验同批号的检验报告书。
1.供货单位为药品生产企业检验报告书应加盖供货单位检验专用章或质量管理专用原印章。
2.供货单位为药品批发企业检验报告书应当加盖药品批发企业质量管理专用章原印章。
3.实施批签发管理的生物制品查验加盖供货单位药品检验专用章或质量管理专用章原印章的《生物制品批签发合格证》复印件。
4.进口药品查验加盖供货单位质量管理专用章原印章的相关证明文件:(1)《进口药品注册证》或《医药产品注册证》。

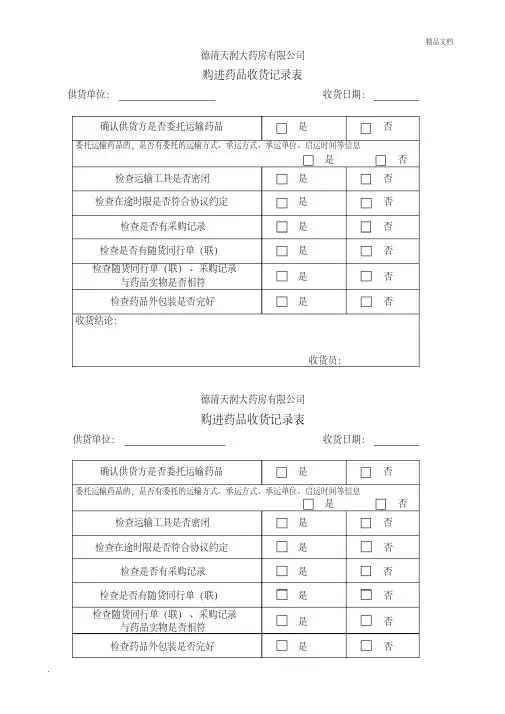
一、目的:规范药品收货工作,防止不合格药品流入。
二、依据:《药品收货管理制度》。
三、适用范围:适用于公司药品收货全过程的质量控制。
四、责任:公司收货员对本操作规程实施负责。
五、内容:1.药品到货时,应当对药品的运输工具和运输状况进行检查。
1.1.应当检查车厢是否密闭,如发现车厢内有雨淋、腐蚀、污染等可能影响药品质量的现象,及时通知采购员并报质量管理部处理;1.2.供货方委托运输药品的,收货员在药品到货后,要逐一核对承运方式、承运单位、启用时间等信息,不一致的应当通知采购部门并报质量管理部门处理;1.3.冷藏药品到货时,应当检查冷藏车、车载冷藏箱或保温箱的温度状况,核实并留存运输过程的温度记录;对未采用规定的冷藏设施运输的或者不符合温度要求的不得收货,并报质量管理部处理;1.4.销后退回的冷藏药品,应当有退货单位提供的药品售出期间储存、运输质量控制情况说明,确认符合规定储运条件的方可收货。
2.药品到货时,若是采购药品,收货员应当根据系统内调出的采购订单对药品随货同行单进行查验;若是销售退回药品,收货员应当根据经过审批的销售退回审批记录表对药品随货同行单进行查验。
2.1.收货员应当查验药品随货同行单,没有随货同行单或随货同行单与备案样式不符的,不得收货;2.2.收货员应当对照随货同行单查询采购订单或销售退回申请单,没有采购订单或销售退回申请单的不得收货,并立即通知采购部或销售部核实;2.3.收货员应当对照随货同行单与采购订单或销售退回申请单内容进行核对,如随货同行单中供货单位、生产厂商、药品的通用名称、剂型、规格、数量、收货单位、收货地址、上市许可持有人等内容与采购订单或销售退回申请单内容不符的,不得收货,并通知采购部或销售部进行处理;2.4.采购部或销售部应当与来货单位核实随货同行单相应内容不符的原因,由于来货单位操作原因造成的随货同行单内容差错的,应当由来货单位提供正确的随货同行单后,收货员方可收货;2.5.因我方操作失误的应当立即重新制作采购订单或销售退回申请单;2.6.对方操作失误的,可按采购订单或销售退回申请单的数量收货或者全部拒收;2.7.不属于以上情形的,应当报质量管理部进行处理。

药品收货管理制度模板一、目的为确保药品的质量和安全,规范药品收货流程,防止不合格药品进入药品流通环节,特制定本管理制度。
二、适用范围本制度适用于所有药品收货环节的相关人员和操作。
三、职责1. 采购部门负责药品的采购计划和供应商的选择。
2. 仓库管理人员负责药品的收货、验收、存储和记录。
3. 质量管理部门负责对药品的质量进行监督和审核。
四、收货流程1. 准备:仓库管理人员应提前准备收货区域,确保收货环境符合药品存放要求。
2. 核对:收货时,仓库管理人员应核对送货车辆的相关信息,包括车牌号、司机信息等。
3. 检查:对药品外包装进行检查,确保无破损、污染或可疑痕迹。
4. 清点:对照送货单,清点药品数量,确保与送货单一致。
5. 验收:对药品的批号、生产日期、有效期等信息进行核对,确保药品符合规定。
6. 记录:所有收货信息应详细记录在药品收货记录表中,并由相关人员签字确认。
7. 存储:合格药品应按照规定存储于相应的仓库区域。
五、不合格药品处理1. 发现不合格药品,应立即停止收货流程,并将情况报告给质量管理部门。
2. 质量管理部门应进行复核,并决定是否拒收。
3. 如需拒收,应填写不合格药品拒收记录,并通知采购部门处理。
六、记录与存档1. 所有收货记录应详细、准确,并妥善保存。
2. 记录保存期限应符合相关法律法规要求。
七、培训与考核1. 定期对相关人员进行药品收货管理制度的培训。
2. 对执行情况进行定期考核,确保制度的有效实施。
八、监督与改进1. 质量管理部门应定期对收货流程进行监督和检查。
2. 根据监督结果和实际操作中发现的问题,不断改进收货流程。
九、附则1. 本制度自发布之日起生效,由质量管理部门负责解释。
2. 对本制度的任何修改和补充,应经过质量管理部门审核,并发布更新版本。
请根据实际情况调整上述模板内容,以确保其符合具体操作要求和法律法规。

药店GSP记录全套填写指南记录填写指导一、基本要求1、统一用黑色水性笔填写。
2、记录不得涂改、粘贴、不得留有空行。
3、记录时逐行填写,不得打省略号。
4、记录有误时,用直尺划一横线(红色)并在旁边注明更正日期和更正人姓名,另取一行重新填写正确的内容。
5、每项记录都要加上公司统一印制的专用封面,用塑料杆夹固定放入资料盒中备查。
6、记录封面应填写记录名称及起始日期。
二、温湿度记录1、记录前先填好店名、月份。
2、手工填写适宜温度范围。
3、营业间:0~30 ℃;冷藏柜:2~8 ℃4、适宜相对湿度范围35﹪~75﹪5、每天上午9:00~10:00、下午3:00~4:00各填写一次,每次记录完毕应及时签名。
6、调控措施后应将调控到适宜范围内温湿度数据重新填写。
三、养护设备使用及维护记录1、夏季开机时间从上午9时开始,至晚上21时左右为止,中间时间可视情况(室温降至26℃以下时)停机。
2、相对湿度达到或超过75﹪时,采用通风或开空调的方法除湿。
3、室温达到或超过8 ℃时,生物制品等需2℃~8 ℃以内保存的药品应放入冷藏柜密封保存(如:人血白蛋白注射液、人免疫球蛋白、诺和灵30R笔芯、胰岛素制剂、重组人干扰素α-2b凝胶等)。
4、室温达到或超过25℃时,需25 ℃以下保存的药品应放入冷藏柜密封保存,如:乌体林斯注射液;卡介菌多糖核酸注射液/斯奇康注射液;阿托伐他汀片/阿乐;非洛地平缓释片/波依定;双氯芬酸钠双释放肠溶胶囊/戴芬胶囊;去氧孕烯炔雌醇片/妈富隆;阿卡波糖片/拜糖平片;糠酸莫米松软膏/艾洛松氟伐他汀胶囊/来适可胶囊;阿司匹林维生素C泡腾片/拜阿司匹灵等。
5、填写时应标明以下内容:门店名称、设备名称、规格型号、设备编号、年份等。
6、空调、冷藏柜(无药品)未使用时,保持清洁卫生,保持随时启用状态,按月试机,作好记录。
四、药品养护记录、中药饮片养护记录1、对陈列的药品每月进行检查。
2、近效期的药品、易霉变、易潮解的药品、拆零药品、冷藏药品作为重点养护品种,每月定期做好养护记录(可集中在每月的26日左右填写)。

药店GSP记录全套填写指南记录填写指导一、基本要求1、统一用黑色水性笔填写。
2、记录不得涂改、粘贴、不得留有空行。
3、记录时逐行填写,不得打省略号。
4、记录有误时,用直尺划一横线(红色)并在旁边注明更正日期和更正人姓名,另取一行重新填写正确的内容。
5、每项记录都要加上公司统一印制的专用封面,用塑料杆夹固定放入资料盒中备查。
6、记录封面应填写记录名称及起始日期。
二、温湿度记录1、记录前先填好店名、月份。
2、手工填写适宜温度范围。
3、营业间:0~30 ℃;冷藏柜:2~8 ℃4、适宜相对湿度范围35﹪~75﹪5、每天上午9:00~10:00、下午3:00~4:00各填写一次,每次记录完毕应及时签名。
6、调控措施后应将调控到适宜范围内温湿度数据重新填写。
三、养护设备使用及维护记录1、夏季开机时间从上午9时开始,至晚上21时左右为止,中间时间可视情况(室温降至26℃以下时)停机。
2、相对湿度达到或超过75﹪时,采用通风或开空调的方法除湿。
3、室温达到或超过8 ℃时,生物制品等需2℃~8 ℃以内保存的药品应放入冷藏柜密封保存(如:人血白蛋白注射液、人免疫球蛋白、诺和灵30R笔芯、胰岛素制剂、重组人干扰素α-2b凝胶等)。
4、室温达到或超过25℃时,需25 ℃以下保存的药品应放入冷藏柜密封保存,如:乌体林斯注射液;卡介菌多糖核酸注射液/斯奇康注射液;阿托伐他汀片/阿乐;非洛地平缓释片/波依定;双氯芬酸钠双释放肠溶胶囊/戴芬胶囊;去氧孕烯炔雌醇片/妈富隆;阿卡波糖片/拜糖平片;糠酸莫米松软膏/艾洛松氟伐他汀胶囊/来适可胶囊;阿司匹林维生素C泡腾片/拜阿司匹灵等。
5、填写时应标明以下内容:门店名称、设备名称、规格型号、设备编号、年份等。
6、空调、冷藏柜(无药品)未使用时,保持清洁卫生,保持随时启用状态,按月试机,作好记录。
四、药品养护记录、中药饮片养护记录1、对陈列的药品每月进行检查。
2、近效期的药品、易霉变、易潮解的药品、拆零药品、冷藏药品作为重点养护品种,每月定期做好养护记录(可集中在每月的26日左右填写)。

药店GSP记录全套填写指南记录填写指导一、基本要求1、统一用黑色水性笔填写.2、记录不得涂改、粘贴、不得留有空行。
3、记录时逐行填写,不得打省略号。
4、记录有误时,用直尺划一横线(红色)并在旁边注明更正日期和更正人姓名,另取一行重新填写正确的内容。
5、每项记录都要加上公司统一印制的专用封面,用塑料杆夹固定放入资料盒中备查。
6、记录封面应填写记录名称及起始日期.二、温湿度记录1、记录前先填好店名、月份。
2、手工填写适宜温度范围。
3、营业间:0~30 ℃;冷藏柜:2~8 ℃4、适宜相对湿度范围35﹪~75﹪5、每天上午9:00~10:00、下午3:00~4:00各填写一次,每次记录完毕应及时签名。
6、调控措施后应将调控到适宜范围内温湿度数据重新填写.三、养护设备使用及维护记录1、夏季开机时间从上午9时开始,至晚上21时左右为止,中间时间可视情况(室温降至26℃以下时)停机。
2、相对湿度达到或超过75﹪时,采用通风或开空调的方法除湿。
3、室温达到或超过8 ℃时,生物制品等需2℃~8 ℃以内保存的药品应放入冷藏柜密封保存(如:人血白蛋白注射液、人免疫球蛋白、诺和灵30R笔芯、胰岛素制剂、重组人干扰素α-2b凝胶等)。
4、室温达到或超过25℃时,需25 ℃以下保存的药品应放入冷藏柜密封保存,如:乌体林斯注射液;卡介菌多糖核酸注射液/斯奇康注射液;阿托伐他汀片/阿乐;非洛地平缓释片/波依定;双氯芬酸钠双释放肠溶胶囊/戴芬胶囊;去氧孕烯炔雌醇片/妈富隆;阿卡波糖片/拜糖平片;糠酸莫米松软膏/艾洛松氟伐他汀胶囊/来适可胶囊;阿司匹林维生素C泡腾片/拜阿司匹灵等。
5、填写时应标明以下内容:门店名称、设备名称、规格型号、设备编号、年份等。
6、空调、冷藏柜(无药品)未使用时,保持清洁卫生,保持随时启用状态,按月试机,作好记录。
四、药品养护记录、中药饮片养护记录1、对陈列的药品每月进行检查.2、近效期的药品、易霉变、易潮解的药品、拆零药品、冷藏药品作为重点养护品种,每月定期做好养护记录(可集中在每月的26日左右填写)。
简述采购员到货药品的收货流程1.采购员收到通知后,前往收货地点。
The purchaser goes to the delivery location upon receiving the notification.2.检查送货清单与订单是否一致。
Check if the delivery list matches the order.3.检查包装是否完好。
Inspect if the packaging is intact.4.检查产品的生产日期和有效期。
Check the production date and expiration date of the products.5.对比实际收货数量和订单数量。
Compare the actual quantity received with the order quantity.6.将药品按分类摆放。
Arrange the drugs according to categories.7.进行质量抽检。
Conduct quality sampling inspection.8.签署收货确认单。
Sign the receipt confirmation form.9.更新库存信息。
Update the inventory information.10.在系统中录入收货信息。
Enter the receiving information into the system.11.通知相关部门进行验收。
Notify the relevant departments for acceptance.12.确保收货区域整洁干净。
Ensure the receiving area is clean and tidy.13.登记药品的批号和生产厂家。
Register the batch number and manufacturer of the drugs.14.确保安全防范措施已经采取。
制剂药品收货记录1. 引言制剂药品收货记录是指对制剂药品进行收货时所需记录的信息,旨在确保药品的质量和安全性,并提供追溯的依据。
本文将详细介绍制剂药品收货记录的内容和要求。
2. 收货记录内容制剂药品收货记录应包括以下内容:2.1 药品基本信息•药品名称:列出所收货物的药品名称。
•药品批号:填写每个批次的唯一标识符。
•规格:记录药物规格,例如片剂、胶囊等。
•生产日期:标明该批次药物的生产日期。
•过期日期:填写该批次药物的过期日期。
2.2 供应商信息•供应商名称:记录供应该批次药物的供应商名称。
•供应商地址:填写供应商的联系地址。
•联系人:列出与供应商联系人的姓名。
•联系电话:填写与供应商联系人沟通所用电话号码。
2.3 收货信息•收货数量:记录实际收到的该批次药物数量。
•单位:填写收到该批次药物的单位,例如盒、瓶等。
•外包装完好情况:描述外包装的完好程度,如是否有破损、变形等。
•内容物是否齐全:确认内部药品是否完整,如是否有缺失、破损等。
2.4 质量检验•外观检查:记录药品外观的情况,如颜色、形状等。
•包装标签检查:核对包装标签与实际药品是否一致。
•药品标识检查:确认药品上的标识符与规定要求一致。
•检验员签名:记录进行质量检验的人员签名和日期。
3. 收货记录要求制剂药品收货记录应符合以下要求:3.1 完整性和准确性收货记录应详尽而准确地记录每次收货的信息,确保关键信息不遗漏或错误。
3.2 及时性收货记录应及时完成,以便能够在需要时进行追溯和查询。
3.3 安全保密收货记录应妥善保存,并且只能由授权人员访问和修改。
确保数据安全和机密性。
3.4 文件管理收货记录应按时间顺序归档存储,便于查找和管理。
3.5 审核和审批收货记录应经过相关人员的审核和审批,以确保数据的可靠性和合规性。
4. 结论制剂药品收货记录是确保药品质量和安全性的重要环节。
通过详细记录药品基本信息、供应商信息、收货信息和质量检验等内容,可以有效追溯药品来源并及时发现问题。
千方百剂操作流程一、采购入库:1、采购员—[采购管理]/[采购订单]:单据编号-往来单位-经手人-商品名称-数量-单价-审核人-审核单据。
2、采购员—[采购管理]/[购进药品到货通知单]:调草稿数据-选单-确定-填加进项发票号-通知人-退出-存入草稿。
3、收货员—[采购管理]/[购进药品到货通知单]:调草稿数据-选单-确定-双击批量填签收人-单据审核。
4、收货员—[采购管理]/[药品收货记录]:调草稿数据-选单-确定-录入收货数量-收货人-退出-单据审核。
5、收货员—[采购管理]/[购进药品到货请验单]:调草稿数据-选单-全部确定-填请验人-存入草稿。
6、验收员—[采购管理]/[购进药品到货请验单]:调草稿数据-选单-确定-双击批量填验收人-退出-单据审核。
7、验收员—[采购管理]/[采购质量验收]:调草稿数据-选单-确定-填加批号-生产日期-验收数量-合格数量-抽样数量-外观质量状况-验收结论-验收员签名-退出-单据审核。
拒收部分-[GSP管理]-[检查与验收]-[药品拒收报告单]-填加药品名称-供货单位-数量-产品批号-生产厂家-生产日期-拒收原因-采购部门意见-质量管理部门意见-质量负责人审核。
8、仓管员—[采购管理]/[药品验收入库通知单]:调草稿数据-选单-确定-选仓库-入库时间-仓管员签字-退出-单据审核。
9、仓管员—采购入库:[其他]/[业务草稿]-选择单据-单据编号-填审核人-单据过账。
二、采购退货:1、采购员—[采购管理]/[购进药品退出通知单]:单据编号-供货单位-发货仓库-经手人-部门全名-商品名称-数量-单价-发货仓库-退货原因-审核人-单据审核。
2、仓管员—[采购管理]/[退货出库复核记录]:调草稿数据-选单-确定-发货人-质量状况-出库日期-存入草稿。
3、复核人—[采购管理]/[退货出库复核记录]:调草稿数据-选单-确定-填复核人-审核单据。
4、仓管员—[采购管理]/[购进药品退出记录]调草稿数据-选单-确定-退货原因-业务员-出库日期-审核单据。