侯氏制碱法-课件·PPT
- 格式:ppt
- 大小:1.47 MB
- 文档页数:29

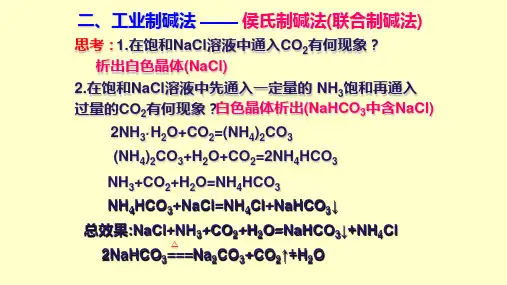


侯氏制碱法侯氏制碱法氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃ ) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
索氏制碱法原理NH3+CO2+H2O=NH4HCO3NH4HCO3+NaCl=NaHCO3↓+NH4Cl总反应方程式:NaCl + CO2 + H2O + NH3= NaHCO3 ↓ + NH4Cl2NaHCO3====Na2CO3+H2O+CO2↑(CO2循环使用)侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序注:纯碱就是碳酸钠侯德榜1890年8月9日出生于福建省闽侯县自幼半耕半读,勤奋好学,有“挂车攻读”美名。
1903—1906年得姑妈资助在福州英华书院学习。
他目睹外国工头蛮横欺凌我码头工人,耳闻美国的旧金山种族主义者大规模迫害华侨、驱逐华工等令人发指的消息,使之产生了强烈的爱国心。
他曾积极参加反帝爱国的罢课示威1907—1910年就读于上海闽皖铁路学院。
毕业后,在英资津浦铁路当实习生。




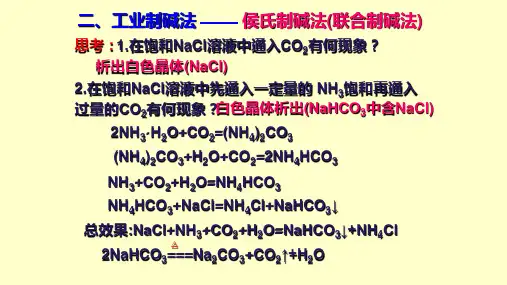
侯氏制碱法侯氏制碱法氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
基本介绍化学原理发展历史国外研究情况(1862年至一战前)侯氏制碱法的产生和发展侯氏制碱法的发明特点和原理发明特点发明原理基本介绍化学原理发展历史国外研究情况(1862年至一战前)侯氏制碱法的产生和发展侯氏制碱法的发明特点和原理发明特点发明原理展开编辑本段基本介绍化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
注:纯碱就是碳酸钠氨制法1.合成氨的工艺流程(1)原料气制备将煤和天然气等原料制成含氢和氮的粗原料气。
对于固体原料煤和焦炭,通常采用气化的方法制取合成气;渣油可采用非催化部分氧化的方法获得合成气;对气态烃类和石脑油,工业中利用二段蒸汽转化法制取合成气。
(2)净化对粗原料气进行净化处理,除去氢气和氮气以外的杂质,主要包括变换过程、脱硫脱碳过程以及气体精制过程。
①一氧化碳变换过程在合成氨生产中,各种方法制取的原料气都含有CO,其体积分数一般为12%~40%。

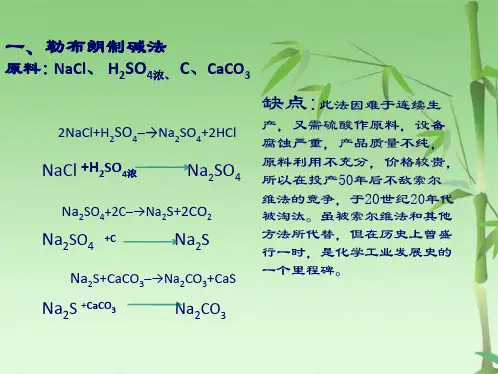
联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气。
其化学反应原理是:C+H2O=CO+H2 CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。
由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。
所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。
此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。
其工业生产的简单流程如图所示。
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱。
另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品——纯碱和氯化铵。
将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵。
从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
目录基本介绍化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓②2NaHCO3=加热=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。