2012《物理化学》考研复习题
- 格式:pdf
- 大小:504.72 KB
- 文档页数:57


(C) (101.325 /3) kPa (D) (2/3)×101.325 kPa1339. 在T,p时,理想气体反应C2H6(g) =H2 (g) + C2H4(g)的K c / K x为:(A) RT(B) 1/(RT) (C) RT/p(D) p/(RT)10. 设某分子的一个能级的能量和简并度分别为ε1 = 6.1×10-21 J,g1 = 3,另一个能级的能量和简并度分别为ε2= 8.4×10-21J,g2= 5,计算在300 K时,这两个能级上分布的粒子数之比(N1/N2):(A) 3 (B) 2 (C) 1.046 (D) 0.18411. 电池电动势与温度的关系为:E/V = 1.01845 - 4.05×10-5(t/℃- 20) - 9.5×10-7(t/℃- 20)2 298 K 时,电池可逆放电,则:(A) Q > 0 (B) Q < 0 (C) Q = 0 (D) 不能确定12. 已知Λ∞m(H2O, 291K)= 4.89×10-2 S⋅m2⋅mol-1,此时(291 K)纯水中的:m(H+) = m(OH-) = 7.8×10-8mol·kg-1,则该温度下纯水的电导率为:(A) 3.81×10-9 S·m-1(B)3.81×10-6 S·m-1(C)7.63×10-9 S·m-1(D)7.63×10-6 S·m-113. 已知下列两个电极反应的标准电极电位为:Cu2++ 2e-─→ Cu(s) φ1θ= 0.337 VCu++ e-─→ Cu(s) φ2θ= 0.521 V由此可算得Cu2++ e-─→Cu+的φθ值为:(A) 0.184 V(B) 0.352 V(C) -0.184 V (D) 0.153 V14.对应电池:Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:(A)2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B)2Hg+2Ag+ = 2Ag +Hg22+(C)2AgCl+2Hg = 2Ag +Hg2Cl2(D)2Ag+Hg2Cl2 = 2AgCl +2Hg15.如果规定标准氢电极的电极电势为1 V,可逆电极电极电势ϕ值和电池的电动势E值将有何变化(A) E ,ϕ各增加1 V(B) E ,ϕ各减少1 V(C) E 不变,ϕ增加1 V(D) E 不变,ϕ减少1 V16.一级反应,反应物反应掉1/n所需要的时间是:(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n(D) (2.303/k) lg(1/n)17.在反应A→k1B→k2C,A→k3D中,活化能E1>E2>E3, C是所需要的产物,从动力学角度考虑,为了提高C的产量,选择反应温度时,应选择:(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度18.受激物的磷光光谱是由于下述哪种原因所致:(A) 三重态向基态的跃迁(B) 单重态到三重态的跃迁(C) 振动模式不同(D) 核自旋跃迁19.当某一反应物的初始浓度为0.04 mol·dm-3时,消耗一半所需时间为360 s。


考研物理化学(化学平衡)历年真题试卷汇编2(总分48,考试时间90分钟)1. 填空题填空题请完成下列各题,在各题的空处填入恰当的答案。
1. 某反应的反应物和产物均为气体,该反应在298.15 K时的标准平衡常数KΘ=l,反应为吸热反应。
则(1)在298.15 K时,该反应的△rGmΘ______;(2)在同样的标准状态下,298.15K 时,该反应的△rSmΘ______;(3)在313.15 K时,该反应的△rGmΘ______。
(填>0,<0或=0)(2012年北京科技大学)2. 在T,p时,理想气体反应C2H6(g)=H2(g)+C2H4(g)的Kc/Kx为:______。
(2011年北京科技大学)3. 对于反应2C2H6(g)+7O2=4-CO2(g)+6H2O(g),在恒温恒压下向反应系统中通入氮气,其标准平衡常数KΘ将______,其化学平衡将______移动。
(2011年南京航空航天大学)4. 在催化剂作用下,将1 mol SO2(g)和0.5 mol O2(g)的混合气体加热到1 000 K,发生如下反应:SO2(g)+O2(g)=SO3(g) 在100 kPa下反应达平衡时,SO2(g)的平衡转化率为46%,则反应在该温度下的平衡常数KΘ=______。
(2016年北京化工大学)2. 单项选择题单项选择题下列各题的备选答案中,只有一个是符合题意的。
1. 下列关于化学反应和化学平衡的描述中,正确的是( )(2014年浙江大学)A. 某一反应的平衡常数是一个确定不变的常数B. 凡是反应体系便一定能建立化学平衡C. 化学平衡时各物质的化学势相等D. 化学平衡态就是化学反应的限度2. 在300 K下,一个抽空的容器中放入过量的A,发生下列反应:A(s)B(s)+3D(g),达到平衡时D(g)的压力为p=1.02 kPa,此反应的标准平衡常数KΘ(300 K)=( )(2014年湖南大学)A. 1.02B. 1.061×10-6C. 1.04×10-4D. 3.063. 如下反应:3C2H2=C6H6,反应物和产物在25℃时的△fGmΘ/(kJ.mol-1)分别为209和125。

2012年全国硕士研究生入学考试自命题科目试题册业务课代码:728业务课名称:物理化学满分:150分考试时间:3小时考生须知:1.答案必须写在另附的答题纸上,写在其它纸上无效。
允许使用无存储功能的计算器。
2.答题时必须使用蓝、黑色墨水笔或圆珠笔作答,用其他笔答题不给分。
不得使用涂改液。
一、填空题(填>,<,=号,每空1分,每题4分,共20分)1.理想气体等温等外压压缩过程A.ΔU_____0 B.ΔH_____0 C.ΔS_____0 D.ΔG_____02.在绝热条件下将100mL,300K的水和100mL,350K的水混合,该过程的A.ΔU_____0 B.ΔH_____0 C.ΔS_____0 D.ΔG_____03.某反应的平衡常数为1,当反应正向进行时应有A.Δr G mθ_____0 B.Δr G m_____0 C.活度商Q a_____1 D.亲和势A_____0 4.若某自发可逆电池的电动势不随温度变化,则该电池在等温等压下可逆放电过程A.ΔH_____0 B.ΔG_____0 C.ΔS_____0 D.Q_____05.温度一定的条件下,阈能E c、能垒E b和实验活化能E a之间的关系A.E a_____E b B.E a_____E c C.E c_____E b D.E b_____0二、单选题(每题2分,共20分)1.金刚石的生成热等于()A.0 B.石墨的燃烧热C.CO2的生成热D.石墨转化为金刚石的反应热2.对于一定量的理想气体,下列过程不可能发生的是()A.恒温下绝热膨胀B.恒压下绝热膨胀C.吸热,同时体积有缩小D.吸热而温度不变3.水中加入乙醇后,其沸点()A.升高B.降低C.不变D.不确定4.化学势不具有的基本性质是()A.化学势是偏摩尔量B.化学势是状态函数C.化学势是体系的强度性质D.其绝对值不能确定5.Na2SO4与H2O可形成多种水合盐,能够与冰共存的水合盐的种数最多为()A.0 B.1 C.2 D.36.某反应的半衰期与起始浓度无关,则反应完成3/4寿期是半衰期的()A.3/4倍B.1倍C.2倍D.3倍7.用同一电导池测定浓度为0.01和0.10mol·dm-3的同一电解质溶液的电阻,前者是后者的10倍,则两种浓度溶液的摩尔电导率之比为()A.1:1 B.2:1 C.5:1 D.10:18.25℃时,电池Pt|H2(100kPa)|H2SO4(b)|H2(10kPa)|Pt的电动势E为()A.0.0592V B.-0.0592V C.0.0296V D.-0.0296V9.一根毛细管插入水中,液面上升的高度为h,当在水中加入少量的NaCl,这时毛细管中液面的高度()10.下列各性质中不属于溶胶电动现象的是()A.电导B.电渗C.电泳D.沉降电势三、(20分)乙醇在正常沸点352K下的汽化热为40.1kJ·mol-1,今将352K,pθ压力下的1mol乙醇(l)向真空蒸发为同温同压下的乙醇蒸气(设为理想气体)。


三 峡 大 学2012年研究生入学考试试题(A 卷)科目代码: 863 科目名称: 物理化学(考生必须将答案写在答题纸上)一、单项选择题 (每小题2分,共50分)1. 如果系统在变化中与环境没有功的交换,则错误的说法是:A. 系统放出的热量一定等于环境吸收的热量B. 系统的温度降低值一定等于环境温度的升高值C. 达到平衡时,系统的温度一定等于环境的温度D. 如果系统1与系统2分别与环境达成热平衡,则二系统的温度相同2. 使公式p H Q ∆=成立的条件是:A .p (系统)=p (外)=常数、只做膨胀功的开放系统B .p (系统)=p (外)=常数、可做任何功的开放系统C .p (系统)=p (外)=常数、只做有用功的封闭系统D .p (系统)=p (外)=常数、只做膨胀功的封闭系统3. 在一个密闭绝热的房间里放置一台电冰箱并使之通电工作,打开冰箱门,一段时间后,室内的平均温度将如何变化?A .降低B .升高C .保持不变D .无法确定4. 在绝热密闭钢瓶中氢气和氧气反应生成水,热力学函数变化值为零的是:A. 热力学能B. 焓C. 熵D. 吉布斯自由能5. 自发过程与不可逆过程A. 自发过程一定是不可逆过程B. 自发过程不一定是不可逆过程C. 不可逆过程一定是自发过程D. 不可逆过程一定不是自发过程6. 一摩尔水在正常沸点下蒸发为气体,没有变化的物理量是:A. 热力学能B. 焓C. 熵D. 摩尔汽化热7. 液体混合物具有的特征是A . ΔV (mix) = 0, ΔH (mix) = 0, ΔS (mix) = 0, ΔG (mix) = 0B. ΔV (mix) = 0, ΔH (mix) = 0, ΔS (mix) > 0, ΔG (mix) < 0C .ΔV (mix) < 0, ΔH (mix) < 0, ΔS (mix) > 0, ΔG (mix) < 0D. ΔV (mix) > 0, ΔH (mix) > 0, ΔS (mix) > 0, ΔG (mix) < 08. 放热反应2NO(g)+O 2(g)=2NO 2(g)达到平衡时,下列哪组方法可使平衡向右移。

第二章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于(A) 单纯状态变化 (B) 相变化(C) 化学变化 (D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消答案:B3.关于焓的性质, 下列说法中正确的是(A) 焓是系统内含的热能, 所以常称它为热焓(B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功(D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
4.涉及焓的下列说法中正确的是(A) 单质的焓值均等于零(B) 在等温过程中焓变为零(C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
5.下列哪个封闭体系的内能和焓仅是温度的函数(A) 理想溶液 (B) 稀溶液 (C) 所有气体 (D) 理想气体答案:D6.与物质的生成热有关的下列表述中不正确的是(A) 标准状态下单质的生成热都规定为零(B) 化合物的生成热一定不为零(C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
7.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是(A) 等容过程(B)无化学反应和相变的等容过程(C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程答案:D8.下列过程中, 系统内能变化不为零的是(A) 不可逆循环过程 (B) 可逆循环过程(C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D 。

安 徽 大 学 2012年招收攻读硕士学位研究生入学考试试题(注:所有答案必须写在答题纸上)一、是非题(每题1分,共10分)1、在等温等压下,CO 2由饱和液体转变为饱和蒸气,因温度不变,CO 2的热力学能和焓也不变。
2、拉乌尔定律适用于理想稀溶液中的溶质。
3、热力学第三定律的普朗克说法是:纯物质完美晶体在0K 时的熵值为零。
4、电解质溶液的电导率就是两极板为单位面积相距单位距离是所具有的电导。
5、25℃时,摩尔甘汞电极Hg|Hg 2Cl 2(s)|KCl(1mol •dm -1)的电极电势为0.2800V ,此数值就是甘汞电极的标准电极电势。
6、理想混合气体中任意组分B 的逸度ƒB 就等于其分压力p B 。
7、如果一个化学反应的Θ∆m r H 不随温度变化,则其Θ∆m r S 也不随温度变化。
8、由ΘΘ-=∆K RT G ln m r ,因为ΘK 是平衡常数,所以Θ∆mr G 是化学反应达到平衡时的摩尔吉布斯函数变化值。
9、对非定域的独立子系统,热力学函数熵S 与分子配分函数q 的关系为:!ln N q k T U S N+=。
10、由于体系经循环过程后回到始态,0=∆S ,所以一定是一个可逆循环过程。
二、选择题。
(每题2分,共30分)1、已知在298K 时有下列热化学方程:(1) Zn(s)+21O 2(g)=ZnO(s),Θ∆m,1r H =-351.4kJ •mol -1; (2) Hg(l)+21O 2(g)=HgO(s),Θ∆m,2r H =-181.6kJ •mol -1; 则 Zn(s)+HgO(s)=ZnO(s)+Hg(l)反应的标准摩尔焓变Θ∆m r H 为:(A )260.8kJ •mol -1; (B )-169.8kJ •mol -1;(C )169.8kJ •mol -1; (D )-260.8kJ •mol -1。
2、已知298K 及100kPa 压力下,0.5molC 2H 4(g)完全燃烧时放出的热为705kJ ,C 2H 4(g)完全燃烧时的标准摩尔热力学能变化值为:(A )-707.5kJ •mol -1; (B )-1415.0kJ •mol -1;(C )-1405.0kJ •mol -1; (D )-702.5kJ •mol -1。

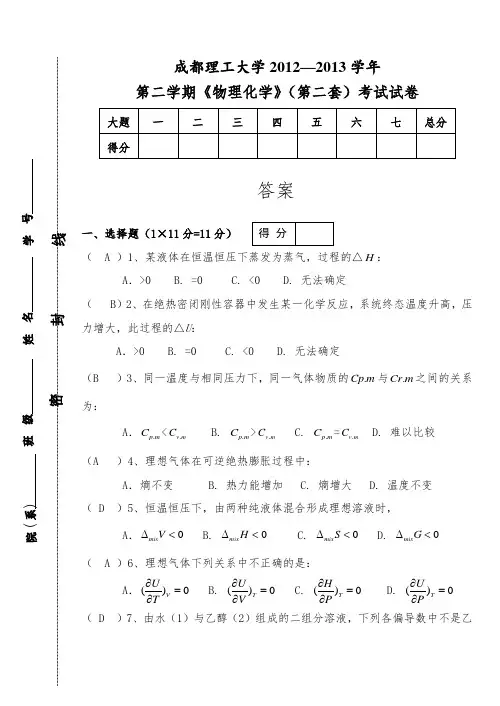
成都理工大学2012—2013学年 第二学期《物理化学》(第二套)考试试卷答案一、选择题(1×11分=11分)( A )1、某液体在恒温恒压下蒸发为蒸气,过程的△H :A .>0 B. =0 C. <0 D. 无法确定( B )2、在绝热密闭刚性容器中发生某一化学反应,系统终态温度升高,压力增大,此过程的△U :A .>0 B. =0 C. <0 D. 无法确定(B )3、同一温度与相同压力下,同一气体物质的.Cp m 与.Cr m 之间的关系为:A ..p m C <.v m C B. .p m C >.v m C C. .p m C =.v m C D. 难以比较(A )4、理想气体在可逆绝热膨胀过程中:A .熵不变B. 热力能增加C.熵增大 D. 温度不变(D )5、恒温恒压下,由两种纯液体混合形成理想溶液时,A.0mix V∆<B. 0mix H ∆<C. 0mix S ∆<D. 0mix G ∆<( A )6、理想气体下列关系中不正确的是:A .()0V U T ∂=∂ B. ()0T U V ∂=∂ C. ()0T H P ∂=∂ D. ()0T UP∂=∂ ( D )7、由水(1)与乙醇(2)组成的二组分溶液,下列各偏导数中不是乙得 分醇化学势的有:A .1,,2()S P n H n ∂∂ B. 1,,2()T P n G n ∂∂ C. 1,,2()T V n A n ∂∂ D. 1,,2()T P n U n ∂∂ ( A )8、在某一温度下,由纯A 与纯B 形成理想态混合物。
已知**AB P P <,当气液两相平衡时,气相组成B y 与该相组成B x 关系为:A .B y >B x B. B y <B x C. B y =B x D. 无法判断( C )9、将固体42()NH HCO s 放入真空容器中,恒温到400k ,43NH HCO 按下式分解并达平衡:43()NH HCO s 322()()NH H O g CO g +(g )+,体系的组分数C 和自由度F 为:A .C=2,F=1 B. C=2,F=2 C. C=1,F=0 D. C=3,F=2( C )10、某连串反应A →B →C ,实验测得B 非常活泼,当反应稳定后,则B 的生成速率与B 的消耗速率关系为:A .> B. < C. = D. 无法确定( D )11、对行反应A 11k k - B ;当温度一定时由A 开始,下列说法中是不对的:A .开始时A 的消耗速率最快 B. 反应的净速率是正逆二向反应速率之差 C. 11/k k -的值是恒定的D. 平衡时正逆二向速率常数相等二、填空题(20×0.5=10分)1、封闭系统由一始态出发,经历一循环过程,过程的U ∆ =0 ;H ∆得 分=0 ;Q 与W 的关系是 Q=-W ,但Q 与W 的具体数值 无法确定 ,因为 不知具体途径 。
考研物理化学(相平衡)历年真题试卷汇编2(总分46, 做题时间90分钟)1. 填空题填空题请完成下列各题,在各题的空处填入恰当的答案。
1.二元合金处于低共熔温度时,体系的自由度F=______。
(2012年北京科技大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:0解析:二元合金处于低共熔温度时,F=C—P+1,P=3,则F=0。
2.在三相点附近的温度范围内,TaBr3固体和液体的蒸气压方程分别为lgp/Pa=14.691—5 650/T和lgp/Pa=10.291—3 265/T,则TaBr3三相点的温度为______。
(2011年陕西师范大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:542.05 K解析:在三相点 p1 =ps即解得 T=542.05 K2. 单项选择题单项选择题下列各题的备选答案中,只有一个是符合题意的。
1.在二组分同液相图中(见图6一1),当系统从物系点P冷却到点L时,系统将出现( )(2015年西北大学)SSS_SINGLE_SELA A(s),E(l),C(s)三相共存B B(s),D(l),C(s)三相共存C C(l)D C(s)该题您未回答:х该问题分值: 2答案:D解析:基本相图中的竖直线段都表示一个纯物质,P点对应于稳定化合物c的组成,故冷却时产生C(S)。
2.水的三相点处自由度数为( )(2013年西北大学)SSS_SINGLE_SELA 1B 2C 3D 0该题您未回答:х该问题分值: 2答案:D解析:相律表达式为F=C—P+2。
水是单组分体系,故C=1,三相点处P=3,所以F=0。
3.某体系存在C(s)、H2 O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡: H2 O(g)+C(s)<=>H2(g)+CO(g) CO2(g)+H2(g)<=>H2O(g)+CO(g) CO2(g)+C(g)<=>2CO(g) 则该系统的独立组分数为( )(2011年北京科技大学)SSS_SINGLE_SELA 4B 3C 2D 1该题您未回答:х该问题分值: 2答案:B解析:系统的独立组分数可表示为C=S—R—R'。
北京科技大学2012年硕士学位研究生入学考试试题试题编号:627 试题名称:物理化学B ________ (共6页)适用专业:________________________ 化学__________________________________说明:1.所有答案必须写在答题纸上,做在试题或草稿纸上无效。
2. 符号$在右上角表示标准态,例如p$表示一个标准压力100kPa.丘$表示标准电动势等。
一、选择题(共16题38分)1. 2分用130C的水蒸气(蒸气压为 2.7p$)与1200E的焦炭反应生成水煤气:C+H2O CO+H2。
如果通入的水蒸气反应掉70%,问反应后混合气体中CO的分压为多少?设总压2.7p$不变。
()(A) 0.72p$; (B) 1.11p$; (C) 2.31p$; (D) 1.72p$。
2. 2分下列的过程可应用公式A H=Q进行计算的是:()(A) 不做非体积功,终态压力相同但中间压力有变化的过程;(B) 不做非体积功,一直保持体积不变的过程;(C) 273.15 K,p$下液态水结成冰的过程;(D) 恒容下加热实际气体。
3. 2分在101.325 kPa下,385 K的水变为同温下的水蒸气,对该变化过程,下列各式中哪个正确?()(A) S 体+A S 环>0; (B) S 体+ A S 环<0;(C) S体+A S环=0; (D) S体+A S环的值不能确定。
4. 2分某理想气体从同一始态(p i,V i,T i)出发,分别经恒温可逆压缩和绝热可逆压缩至同一压力P2,若环境所做功的绝对值分别为W和W A,问W和W A的关系如何?()(A) W T>W A;(B) W T <W A;(C) W T=W A;(D) W T和W A无确定关系5. 2分在温度T时,纯液体A的饱和蒸气压为p/*,化学势为泌,并且已知在卩$压力下的凝固点为T f*,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为P A,『,T f ,则()* * * * * *(A) P A V P A,pA< pA,T f < T f; (B) P A> p A,pA< pA,T f V T f;* * * * * *(C) P A V P A,p A V pA,T f > T f; (D) P A> P A,p > p,T f > T f o6. 2分若一气体的方程为pV m=RT+ p ( >0常数),则:() U U U U(A) (=)T=O;(B)(——)V=O;(C) e-)V =0 ;(D) e-)p=0oV p T T7. 2分(1) 溶液的化学势等于溶液中各组分的化学势之和;(2) 对于纯组分,则化学势等于其Gibbs自由能;(3) 理想溶液各组分在其全部浓度范围内服从Henry定律;(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律。
2012年清华大学硕士研究生入学考试考试科目:物理化学(837)只能说清华专业课考的越来越变态,永远让你摸不清楚人家的考试题型,也不要试图去猜想它今年会出什么题型,自己认真复习就行了2011年考30多道判断题,不过还算规矩,还有计算、简答;今年直接整了114分的填空,一看到卷子我都蒙了,不过总体来说不算太难,没考量子热力学,没有不定项选择、名词解释(考前背的这么多,全浪费了,不过也加深了对不少概念的理解)。
准备的时候还是要把清华的教材好好的多看几遍,课后题多做几遍,1991年到2001年的真题一定要做熟,如果实在不会做的,也要把答案背下来(几年有几个填空,我就不怎么理解,不过我把答案记下来了)一共四大项,判断(10X2)、填空(114)、相图(1X7)、计算(1X9)一、判断并写出原因(不写出原因及判断错误均不得分)1.实际发生的过程G肯定小于零2.100摄氏度的水变成101摄氏度的水,100摄氏度的水蒸气变成101摄氏度的水蒸气,两个过程中化学势均降低,且过程2降低的更大3.对于初末状态相同的所有的过程,可逆过程做功最大4.高能表面不容易润湿二、填空(在横线处填上<、>、=,公式,数值及必要的文字说明)1.电解质的聚沉值越大,气聚沉能力------2.弱电解质的摩尔电导率-----极限摩尔电导率,原因是------3.区分有效碰撞和无效碰撞的标准------,其物理意义是……..4.两部分的气体初始状态如右图所示,中间有一个活塞连接(以下两个过程均以H2、O2为系统)1)现在将中间的活塞打开,并用10x101325Pa的外压将氧气全部压到H2的容器中,此过程在等温过程中进行,计算过程的Q、2)首先将连接两个容器之间的活塞打开,等两者混合完全以后,在经过绝热可逆过程将氧气全部压入氢气的容器中,计算整个过程的W、、5.某一化学反应的K=0.2,反应半衰期为2min,则此反应的反应级数为-----,反应的初始浓度为--------6.有两个化学反应分别是一级和二级反应,初始浓度相同,现在均经过t=的时间,则7.H2O在298K时的饱和蒸汽压为6093Pa,以101325pa纯的该气体为标准状态,现在将1molA(不挥发)溶于3.56mol的水中,测的溶液上方的蒸汽压为597Pa,则溶液中水的活度为-----,活度系数------,渗透压------,若将1mol的水从溶液中分离出来,至少需要做功-----8.若用电动势法测定水的离子积,需要从手册中查-------,表达式Kw=----------一个实际的化学反应在反应器中进行放热Q1,在电池中等温等压下可逆进行放热Q2,则Q1----Q29.对峙反应A B的正逆反应均为一级反应,且半衰期均为10min,若,则经过10min后,=------10.某一反应器发生的主反应和副反应的活化能分别为148KJ,78KJ,某要提高反应速率,应-----温度11.1mol LiCl溶于10mol的水中放热100J,先将1mol的水溶于无限稀薄的溶液中,则此过程放热-----12.99年A填空题4 --Ar---将直接升华13.将NaHCO3放入真空密闭容器中,发生反应2NaHCO3(s)Na2CO3(s)+CO2(g)+H2O(g),则自由度f=-------14.2NaHCO3(s)Na2CO3(s)+CO2(g)+H2O(g)的=11.7,则,若,则反应向进行,此时各物质的化学势满足的关系为15.电泳是-----的定向移动,对于指定的分散相和介质,在一定温度下的电泳速度取决于-----16.99年A填空题1517.99年A填空题2418.电极反应,阴极和阳极反应的实际电极电势分别为a、b,平衡电极电势为a^,b^,阳极的超电势是----,电池电动势是------,若该电极反应发生在某电解槽中,则分解电压至少是-------19.NaCl溶液中NaCl的极限摩尔电导率为114X(单位),Na离子的极限摩尔电导率为84X(单位),则溶液中t(Cl离子)=------,u(Na离子)=-----20.甲醇和乙醇的密度分别为0.873g/cm3,0.942g/cm3,若将30g甲醇和30g乙醇混合成理想溶液,则此溶液的密度=------21.H=适应于理想气体的-----过程,实际气体--------过程22.1mol液态水在100摄氏度,在真空环境中蒸发成100摄氏度,一个标准大气压下的水蒸气,一直水在100摄氏度时的蒸发焓为110Kj,求过程的W、S、G23.求取反应的活化能时,用-----对-----作图,具体方法是-----------三、相图1.写出各相区及三相线包括的相态2.(图中的比例为质量分数)300Kg该二组分溶液在w(Ag)=0.4时从某一温度下降温降至400K,写出此时溶液中平衡共存的各组分,及各项的质量(Ag、Sn的相对原子质量分别为107.9、118.69)四、2001年A计算题第四大题(计算电池电动势、在计算中做了何种近似、计算溶液的、r)清华专业课的试题2001年以后的网上就没有了,能找到的也只有学长学姐们非常模糊的回忆版,正好今天早上很早就醒了(生物钟还没有调回来,而且还比以前提前醒了),就顺着以前试题的知识点把今年的专业课回忆一下,就当攒人品了2012/1/9/6:00—9:00。
本人报的是物理化学专业,专业课有机化学还有物理化学第一大题的条件是在298K下一个标准大气压,求1mol氮气的平动配分函数,平动熵,海姆赫兹函数,以及平动恒容热熔。
第二大题,求氨和氧气反应的一个反应方程式在1073K下的反应平衡常数,题目给了298K 时的相关物质的摩尔生成焓变及熵。
(比较初级,就是计算有些小技巧)第三大题,相图,很简单。
只是让表明各相区都是什么,还有每条曲线,两条三相线代表什么。
基本都是课后的习题变体第四大题,动力学,题目大致为:A,B两种物质,等摩尔参加反应。
反应进行1h后,A 物质有75%参加反应。
当反应进行2h后,求在下列不同情况下A物质在有多少未参加反应。
(1)反应对A是一级反应,对B是零级反应(2)反应对A和B均是一级反应(3)反应对A和B均是零级反应(4)在(3)的情况下A物质完全参加反应需要多长时间。
第五大题:溶液依数性(渗透压,沸点,蒸汽压的计算),题目大意是告诉了你凝固点的降低常数还有沸点升高常数,以及水在25℃的饱和蒸汽压,然后加了一定量(定值,具体我给忘了)的非挥发性溶质。
起凝固点降低了一定值(原题有给定值),试求(1)该溶液的正常沸点为多少?(2)求该溶液的饱和蒸汽压(3)求该溶液(假设为理想溶液)的渗透压第六大题,电化学,考到了公式的推导以及实验的相关原理题目大意:给出了Ag|Agcl|HCl(m)|H2(P)的电池。
(1)写出该电池的电极反应,电化学反应方程式(2)试推导该电池的电动势表达式(3)如何用用电动势法测量氯化银标准电极电势。
需要知道哪些数据第七大题:电化学和热力学综合题目大意:已知某化学反应方程式,在298K,100KP下进行1mol时。
放热40Kj。
在可逆电池中进行时则吸热4KJ.(1)求该反应的熵变(2)求该过程系统和环境的总熵变(3)求该过程可以做的最大功小题的分布比较泛泛。
一般的偏的都有涉及,需要比较牢固的理论知识地基。
特备的注重细节的知识点。