九年级化学上学期期末考点训练计算题含解析新人教版
- 格式:doc
- 大小:407.00 KB
- 文档页数:17
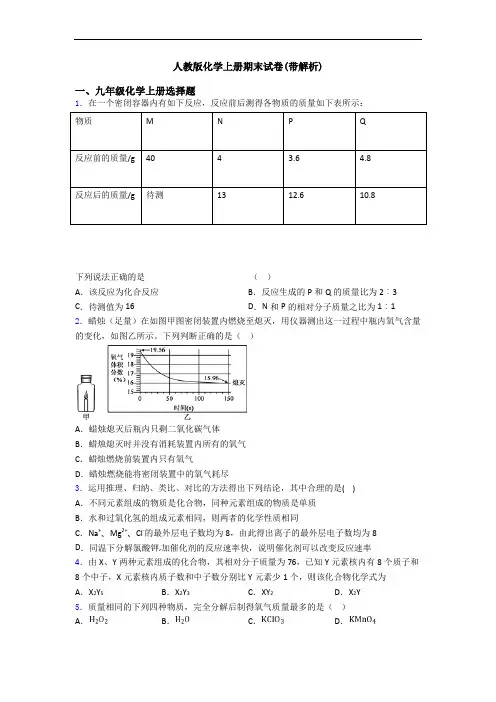
人教版化学上册期末试卷(带解析)一、九年级化学上册选择题1.在一个密闭容器内有如下反应,反应前后测得各物质的质量如下表所示:物质M N P Q反应前的质量/g404 3.6 4.8反应后的质量/g待测1312.610.8下列说法正确的是()A.该反应为化合反应B.反应生成的P和Q的质量比为2︰3 C.待测值为16 D.N和P的相对分子质量之比为1︰12.蜡烛(足量)在如图甲图密闭装置内燃烧至熄灭,用仪器测出这一过程中瓶内氧气含量的变化,如图乙所示。
下列判断正确的是()A.蜡烛熄灭后瓶内只剩二氧化碳气体B.蜡烛熄灭时并没有消耗装置内所有的氧气C.蜡烛燃烧前装置内只有氧气D.蜡烛燃烧能将密闭装置中的氧气耗尽3.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )A.不同元素组成的物质是化合物,同种元素组成的物质是单质B.水和过氧化氢的组成元素相同,则两者的化学性质相同C.Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8D.同温下分解氯酸钾,加催化剂的反应速率快,说明催化剂可以改变反应速率4.由X、Y两种元素组成的化合物,其相对分子质量为76,已知Y元素核内有8个质子和8个中子,X元素核内质子数和中子数分别比Y元素少1个,则该化合物化学式为A.X2Y5B.X2Y3C.XY2D.X2Y5.质量相同的下列四种物质,完全分解后制得氧气质量最多的是()A.B.C.D.6.将25克甲物质跟5克乙物质发生反应,所得混合物中有10克甲,11克丙,还有另一种新物质丁,若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,化学式分别为A 、B 、C 、D 。
则下列化学方程式正确的是 A .2A + B ═ C + 2D B .A + 2B ═ 2C + D C .A + 2B ═ C + 2DD .2A + B ═ 2C + D7.依据下图进行实验(夹持仪器略去)。
实验步骤如下:①通入N 2一段时间后,点燃酒精灯,a 、b 中均无明显现象;②改通O 2片刻,加热一段时间后,熄灭酒精灯,a 中红磷不燃烧,b 中红磷燃烧。


期末测试题(考试时间为90分钟,试卷满分为l00分)可能用到的相对原子质量:H—1 Li—7C—12N—l4O—16Na—23C1—35.5 Ca—40一、选择题(每小题只有1个选项符合题意,每小题1分,共17分)1.下列物质的用途与其性质的对应关系中,不正确的是( )。
A.氢气用于航天飞机是由于氢气具有可燃性B.CO用于炼铁是由于CO能和氧化铁反应C.汽车用压缩天然气作燃料是由于天然气具有可燃性D.用铝制作高压锅是由于铝能在氧气中燃烧2.下列化学用语中,书写正确的是( )。
H+) B.氧化铁(FeO)A.2个氢离子(2C.五氧化二磷(P2O5) D.硝酸铝(AlNO3)3.下列错误的实验操作中,可能引起较危险的安全事故的是( )。
A.称量药品B.点燃酒精灯C.取用固体D.过滤4.某元素的原子结构示意图为,下列关于该元素的说法中,不正确的是+13 2 8 3( )。
A.它的阳离子带3个单位正电荷B.它的阳离子有10个质子C.它是一种金属元素D.它的原子核外有l3个电子5.如下图所示,下列关于该图的说法中,正确的是( )。
A.装置内为纯净物B.该变化是物理变化C.该变化是化合反应D.本实验说明分子间没有间隔6.电影《赤壁》中有这样的一个场面:吴、蜀联军在船上装满枯枝浇足油,借着东南风向曹军驶去,接近曹军时点燃船上枯枝弃船而走。
火借风势,火船宛如火龙一样冲向连在一起的曹军木船。
一眨眼,曹军水寨已经烧成一片火海。
下列关于火海形成的叙述中,不正确的是( )。
A.东南风降低了木船的着火点B.枯枝和油为燃烧提供了充足的可燃物C.东南风为木船燃烧提供了充足的氧气D.相连的曹军木船没有及时隔离7.根据右图所示实验,不能得到的结论是( )。
A.CO2不能燃烧B.CO2不支持燃烧C.CO2的密度比空气的大D.蜡烛燃烧生成CO2和H2O8.在下列安全措施中,不正确的是( )。
A.燃放烟花爆竹时,远离人群和可燃物B.天然气泄漏,立即关闭阀门并开窗通风C.燃着的酒精灯不慎碰倒,立即用湿布盖灭D.正在使用的家用电器着火,立即用水浇灭9.2010年2月19日德国重粒子研究中心宣布原子序数为112号的元素,相对原子质量为277。


人教版九年级化学上册考点训练:计算题(基础)1.实验室加热氯酸钾和二氧化锰的混合物28g制取氧气,完全反应后剩余固体质量为18.4g,请计算:(1)生成氧气的质量_______;(2)原混合物中氯酸钾的质量_________。
【答案】(1)9.6g (2)24.5g【解析】(1)在加热和二氧化锰的催化作用下,氯酸钾分解生成氯化钾和氧气,生成的氧气会逸散到空气中,故固体减少的质量即为生成的氧气的质量。
生成氧气的质量 m(O2)=28.0g-18.4g=9.6g;(2)利用化学方程式,根据氯酸钾与氧气反应的质量比即可计算出氯酸钾的质量。
设氯酸钾的质量为x;2KClO3 2KCl+3O2↑245 96x 9.6gx=24.5g答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。
(基础)2.实验室新进一批块状大理石,某化学小组成员称取12.5 g该大理石样品,加入足量稀盐酸测定碳酸钙的含量,完全反应后,称得固体剩余物的质量为2.5 g,样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:(1)该样品中碳酸钙的质量为__________。
(2)计算12.5g该样品最多可以制得二氧化碳的质量,写出必要的计算过程__________。
【答案】(1)10 g (2)4.4g【解析】(1)大理石样品中的碳酸钙与足量的稀盐酸反应,剩余固体则是不能跟稀盐酸反应的杂质。
根据题意可知:该样品中碳酸钙的质量=样品质量-杂质质量=12.5g-2.5g=10g。
(2)已知碳酸钙的质量为10g,可根据反应方程式中碳酸钙与二氧化碳的质量关系计算二氧化碳的质量。
具体过程如下:解:设最多可生成二氧化碳的质量为x。
3222+2HCl =CaCl +CaC H O +CO 1004410gxO10010g=44x解得x=4.4g答:最多可制得二氧化碳的质量为4.4g 。
(基础)3.某同学称取了15g 石灰石样品(主要成分为碳酸钙),放入到质量为20g 的烧杯中,再加入50g 足量的稀盐酸,充分反应后,称得剩余总质量为80.6g 。



九年级上册化学期末专题:化学方程式计算专项训练(人教版,含解答)九年级上册化学期末专题--化学方程式计算专项训练化学方程式简单计算知识点总结如下:一、计算的依据:化学反应中各物质的质量比为定值,且等于化学方程式中的相对分子质量之比。
(注意:相对分子质量必须乘化学计量数)二、计算的步骤:1、设未知量。
注意:未知量不能带单位,且要指明未知量所代表的物理量。
2、写出化学方程式。
注意:只能是该题所涉及的化学方程式。
3、列出相关物质的相对分子质量和已知量、未知量。
注意:①找准已知量、未知量对应的化学式。
②已知量必须带单位未知量不能带单位;③相对分子质量写在上,质量写在下。
4、列比例式,求解。
注意:①列比例式既可以横比,也可以纵比。
②列式和求解过程中已知量都要带单位;③按要求保留小数位数,未指明时,一般保留至小数2位。
5、简明地写出答。
三、注意:1、反应物或生成物不纯时,必须乘以纯度。
2、若反应物中无气体,而生成物中有气体时,反应前后混合物的质量差就是气体质量,再用气体质量作为已知量来求未知量。
【专项训练】1. CaCO3 在高温条件下分解生成CaO 和CO2,计算高温分解200g CaCO3 生成CaO 的质量.2.用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量, 小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.求:(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)(2)所加入氯化钙溶液的溶质质量分数.3.氢气在氯气中燃烧生成氯化氢气体,燃烧100 克氢气需要氯气多少克?生成氯化氢气体多少克?4. t℃时,将15g 碳酸钙粉末与一定量的稀盐酸恰好完全反应.反应后是饱和溶液,溶质的质量分数为25%.(1)反应后所得溶液质量是多少(2)稀盐酸中溶质的质量分数5. 我国第一部《室内空气质量标准》于2003年3月1日起实施,其中规定室内空气中甲醛(HCHO)含量不得超过0.1mg/m3。

人教版九年级化学上册期末考试计算题专项练习-附带答案可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40 S:32 Mg:24 Mn:55一、计算题。
1.空气中氧气的体积分数约为21%,氮气的体积分数约为78%.小江老师让同学往集气瓶装入半瓶水,再用排水法收集集气瓶的氧气,发现瓶中的氧气也能使带火星的木条复燃。
请计算:(1)本实验中瓶内氧气约占瓶总体积的百分比是(结果保留整数)(2)另一同学需要 2.5g氮气(氮气密度为 1.25g/L),理论上她大致需要空气多少升?(结果保留一位小数)。
2.现有200升空气,问其中含有氧气多少升,氮气多少升?氧气与氮气的质量比为多少?(写成分数)(已知氧气的密度为1.429克/升,氮气的密度为1.250克/升)3.学生体育测试后,常会感到肌肉酸痛,这是因为运动后产生了乳酸的原因。
乳酸的化学式为C x H6O3,已知乳酸的相对分子质量为90。
请计算:(1)C x H6O3中x=。
(2)乳酸中碳、氢、氧三种元素的质量比为(填最简整数比)。
(3)乳酸中氧元素的质量分数为(结果精确到0.1%)(4)180g乳酸中含碳元素多少g?(写出计算过程)4.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。
现煅烧含有200kg碳酸钙的贝壳,最多可得到氧化钙多少千克?5.在通常情况下,氧气的密度是1.429克/升,空气的密度是1.293克/升。
①空气的成分按体积计算,氮气占,氧气占。
②则按质量分数计算,氧气占多少?③一个成年人每天需要氧气大约是8.4升,则相当于需要空气多少升呢?6.用如图所示的装置测定空气中氧气含量,集气瓶的容积为350mL,装置气密性良好,实验前止水夹关闭。
实验前预先在集气瓶中放入30mL水,烧杯中盛有足量水,用凸透镜引燃燃烧匙中的红磷,冷却后打开止水夹,测得烧杯中的水少了64mL。
(1)请出红磷燃烧的符号表达式;(2)计算空气中氧气的体积分数。

人教版九年级化学上册期末考试计算题专项练习-带答案可能用到的相对原子质量:C:12 H:1 O:16 N:14 Ca:40一、计算题。
1.某实验小组同学利用氯酸钾和二氧化锰加热制氧气,在100mL的集气瓶中装满的水,不小心造成集气瓶的水洒出一部分。
然后用排水集气法将集气瓶内的水全部排出,收集一瓶气体,将带火星的木条伸入集气瓶中,小木条复燃。
请回答:(1)通过上述实验可以看出,使用带火星的木条检验氧气集满的方法。
(填“可靠”或“不可靠”)(2)计算收集100mL氧气体积分数为60%气体时,集气瓶中的应注入水的体积是多少?(空气中氧气体积分数按20%计,写出计算过程)2.一般情况下,正常成年人每次吸入的空气体积约为0.6L,每分钟呼吸15次,则一个成年人每天吸入的氧气大约是多少升?3.乙醇俗称酒精,它是一种重要的化工原料,还常用作酒精灯和内燃机的燃料。
乙醇的化学式是C2H5OH,计算:(1)乙醇中C、H、O三种元素的质量比是多少?(2)乙醇中氢元素的质量分数是多少?(3)230kg乙醇中含有氢元素的质量是多少千克?4.葡萄酒中含有白藜芦醇(C x H12O3),现代科技证明,白藜芦醇具有美容美颜之功效,其相对分子质量为228。
试计算:(1)x=。
(2)22.8g白藜芦醇中氧元素的质量g。
5.2020新春以来全球各国先后出现了罕见的新型冠状病毒肺炎疫情,过氧乙酸(CH3COOOH)是杀灭病毒的主要消毒剂之一,请计算:(1)过氧乙酸的相对分子质量为;(2)过氧乙酸中碳、氧的元素质量比为;(3)列式计算152g的过氧乙酸中碳元素的质量为多少?6.在一次作业批改中,王老师发现4位同学在同一题中出现了不同的错误,为帮大家理清思路,老师将错误的解题过程写在黑板上,请同学们仔细观察,发现问题,纠正错误。
某工厂需要96kg氧气作原料,若用电解水的方法制取氧气,消耗水的质量是多少?7.(1)已知某粒子符号为R m+,其核外电子数为n,则其质子数为;(2)一个OH﹣中所含质子数为,电子数为,原子核个数为;(3)已知一个氧原子的质量为akg,一个碳﹣12原子的质量为bkg,求氧原子的相对原子质量。

期末总复习考点必杀200题专练06(计算题)(基础)1.实验室加热氯酸钾和二氧化锰的混合物28g制取氧气,完全反应后剩余固体质量为18.4g,请计算:(1)生成氧气的质量_______;(2)原混合物中氯酸钾的质量_________。
【答案】(1)9.6g (2)24.5g【解析】(1)在加热和二氧化锰的催化作用下,氯酸钾分解生成氯化钾和氧气,生成的氧气会逸散到空气中,故固体减少的质量即为生成的氧气的质量。
生成氧气的质量m(O2)=28.0g-18.4g=9.6g;(2)利用化学方程式,根据氯酸钾与氧气反应的质量比即可计算出氯酸钾的质量。
设氯酸钾的质量为x;2KClO3 2KCl+3O2↑245 96x 9.6gx=24.5g答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。
(基础)2.实验室新进一批块状大理石,某化学小组成员称取12.5 g该大理石样品,加入足量稀盐酸测定碳酸钙的含量,完全反应后,称得固体剩余物的质量为2.5 g,样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:(1)该样品中碳酸钙的质量为__________。
(2)计算12.5g该样品最多可以制得二氧化碳的质量,写出必要的计算过程__________。
【答案】(1)10 g (2)4.4g【解析】(1)大理石样品中的碳酸钙与足量的稀盐酸反应,剩余固体则是不能跟稀盐酸反应的杂质。
根据题意可知:该样品中碳酸钙的质量=样品质量-杂质质量=12.5g-2.5g=10g。
(2)已知碳酸钙的质量为10g,可根据反应方程式中碳酸钙与二氧化碳的质量关系计算二氧化碳的质量。
具体过程如下:解:设最多可生成二氧化碳的质量为x。
3222+2HCl =CaCl +CaC H O +CO 1004410gxO10010g=44x解得x=4.4g答:最多可制得二氧化碳的质量为4.4g 。
(基础)3.某同学称取了15g 石灰石样品(主要成分为碳酸钙),放入到质量为20g 的烧杯中,再加入50g 足量的稀盐酸,充分反应后,称得剩余总质量为80.6g 。
人教版九年级上册化学期末考试计算题专项训练一、计算题。
1.某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。
)有关实验数据如表:反应前反应后实验数据烧杯和稀盐酸的质量石灰石样品的质量烧杯和其中混合物的质量150g12.5g158.1g①求反应中生成二氧化碳的质量。
②石灰石中碳酸钙的质量是多少?③求该石灰石中碳酸钙的质量分数。
【分析】(1)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;(2)根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量;(3)根据(2)的计算进而计算出石灰石中碳酸钙的质量分数。
【解答】解:(1)根据质量守恒定律,二氧化碳的质量为:150g+12.5g﹣158.1g=4.4g;答:反应中生成二氧化碳的质量4.4g;(2)设反应的碳酸钙的质量为x,则:CaCO3+2HCl═CaCl2+H2O+CO2↑100 44x 4.4gx=10g答:反应的碳酸钙的质量10g;(3)此石灰石中碳酸钙的质量分数为:×100%=80%;答:该石灰石中碳酸钙的质量分数为80%。
2.10g黄铜(铜锌合金)加入100g稀硫酸中恰好完全反应,生成气体和时间的关系如图所示,求:(1)黄铜中铜的质量分数;(2)反应后所得溶液的质量。
【分析】(1)铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据氢气质量可以计算锌的质量,进一步可以计算该黄铜样品中的铜质量分数;(2)根据质量守恒定律计算反应后所得溶液的质量。
【解答】解:(1)由图可知:合金中金属锌与硫酸反应产生的氢气质量为0.2g;设锌的质量为x,Zn+H2SO4═ZnSO4+H2↑,65 2x 0.2gx=6.5g,该黄铜样品中的铜质量分数为:×100%=35%,答:该黄铜样品中的铜质量分数是35%.(2)根据质量守恒定律可知反应后所得溶液的质量:100g+6.5g﹣0.2g=106.3g答:反应后所得溶液的质量是106.3g.3.一个碳原子的质量约1.99×10﹣26kg,1个氧原子的质量约是2.65×10﹣26Kkg.请计算:一个一氧化碳分子的质量约为多少千克?一个二氧化碳分子的质量约为多少千克?【分析】根据1个分子的质量等于构成原子的质量总和进行分析解答。
新人教版九年级化学上册期末试卷附答案(时间: 60分钟分数: 100分)班级: 姓名: 分数:一、选择题(每小题只有1个选项符合题意。
共20小题, 每题2分, 共40分)1.关于碳循环和氧循环, 下列说法不正确的是()A. 碳循环和氧循环分别是指二氧化碳和氧气的循环B. 碳循环和氧循环过程中均发生了化学变化C.绿色植物的生长过程, 既涉及碳循环, 又涉及氧循环D. 碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定2.下列加热高锰酸钾制取氧气的部分操作示意图中, 正确的是()A. 检查装置气密性B. 加热立即收集C. 收满后移出集气瓶D. 结束时停止加热3、我国古代典籍中有”银针验毒”的记载, “银针验毒”的反应原理之一是4Ag+2H2S +O2=2X+2H2O。
下列有关该反应的说法不正确的是()A. 反应属于氧化反应B. X的化学式是Ag2SC. 反应前后元素的种类不变D. 反应前后所有元素的化合价都发生了变化4.水是生命之源, 下列关于水的说法正确的是()A. 工业废水需要处理达标后才能排放B. 明矾可以使硬水转化为软水C. 蒸馏海水和电解水的过程中水发生的都是物理变化D. 蒸馏水、自来水都是纯净物5、如图是a、b、c三种固体物质的溶解度曲线, 下列说法正确的是()A. t℃时, 将50g a物质加入到50g水中充分搅拌, 可得到100g a的溶液B. c物质微溶于水C. a中含有少量b, 可用恒温蒸发溶剂的方法提纯aD.将20℃的三种物质的饱和溶液升温到t℃, 所得溶液中溶质的质量分数的大小关系是:b>a>c6.下列物质常用于改良酸性土壤的是()A. 熟石灰B. 烧碱C. 食盐D. 大理石7、用如图装置测定空气中氧气的含量, 下列说法正确的是()A. 点燃白磷后缓慢将燃烧匙插入瓶中, 塞紧瓶塞B. 用细铁丝代替白磷进行实验, 不会影响实验结果C. 不打开瓶塞, 聚焦太阳光引燃足量白磷, 实验效果更好D.若实验过程中, 没有将弹簧夹夹紧, 不会影响实验结果8、化学小组为探究铝、铜、银三种金属的活动性顺序, 设计了如图所示实验方案。
新人教版九年级化学(上册)期末总复习及答案(时间: 60分钟分数: 100分)班级: 姓名: 分数:一、选择题(每小题只有1个选项符合题意。
共20小题, 每题2分, 共40分)1.某同学在量取10mL水时, 视线仰视, 则他量取的水的实际体积()A. 等10mLB. 小于10mLC. 大于10mLD. 无法判断2、如图是木炭还原氧化铜反应的实验装置图, 下列说法正确的是()A. 给酒精灯加网罩, 目的是使火焰集中并提高温度B. 实验过程中, 可观察到红棕色粉末逐渐变黑C. 木炭是使氧化铜还原为铜的物质, 它具有氧化性D.实验结束后, 应先停止加热, 再将导气管从澄清石灰水中撤出3.对下列词语的有关化学原理解释不合理的是()A. 火上浇油——隔绝空气B. 风助火威——为燃料燃烧提供充足的氧气C. 釜底抽薪——燃烧需要可燃物D. 钻木取火——使温度达到可燃物的着火点4.将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液, 测得溶液中氢元素的质量分数为a, 则溶液中碳元素的质量分数为()A. 1﹣9aB. 1﹣8aC. 12aD. 8a5.某温度下, 在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体, 恰好得到饱和溶液乙。
下列说法正确的是()A.该温度下, KNO3的溶解度为30gB. 乙溶液的质量分数为30%C. 降低温度, 可以使甲溶液变成饱和溶液D.升高温度, 甲、乙两溶液的质量分数都增大6.下列实验现象描述正确的是()A. 硫在氧气中燃烧发出淡蓝色火焰B. 磷在空气中燃烧产生大量白烟C. 木炭在空气中燃烧发出白光D. 铁丝在氧气中燃烧, 火星四射, 生成四氧化三铁7、下列各组物质的溶液, 需要另加其他试剂才能区别的是()A. BaCl2.CuSO4.NaOH、NaClB. Na2SO4.BaCl2.K2CO3.NaNO3C. FeC13、NaOH、H2SO4、Ba(NO3)2D. MgCl2.NaOH、HCl、Na2SO48、如图表示两种气体发生的化学反应, 其中相同的球代表同种原子。
计算题(基础)1.实验室加热氯酸钾和二氧化锰的混合物28g制取氧气,完全反应后剩余固体质量为18.4g,请计算:(1)生成氧气的质量_______;(2)原混合物中氯酸钾的质量_________。
【答案】(1)9.6g (2)24.5g【解析】(1)在加热和二氧化锰的催化作用下,氯酸钾分解生成氯化钾和氧气,生成的氧气会逸散到空气中,故固体减少的质量即为生成的氧气的质量。
生成氧气的质量 m(O2)=28.0g-18.4g=9.6g;(2)利用化学方程式,根据氯酸钾与氧气反应的质量比即可计算出氯酸钾的质量。
设氯酸钾的质量为x;2KClO3 2KCl+3O2↑245 96x 9.6gx=24.5g答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。
(基础)2.实验室新进一批块状大理石,某化学小组成员称取12.5 g该大理石样品,加入足量稀盐酸测定碳酸钙的含量,完全反应后,称得固体剩余物的质量为2.5 g,样品中杂质不溶于水且不与稀盐酸反应,请回答下列问题:(1)该样品中碳酸钙的质量为__________。
(2)计算12.5g该样品最多可以制得二氧化碳的质量,写出必要的计算过程__________。
【答案】(1)10 g (2)4.4g【解析】(1)大理石样品中的碳酸钙与足量的稀盐酸反应,剩余固体则是不能跟稀盐酸反应的杂质。
根据题意可知:该样品中碳酸钙的质量=样品质量-杂质质量=12.5g-2.5g=10g。
(2)已知碳酸钙的质量为10g,可根据反应方程式中碳酸钙与二氧化碳的质量关系计算二氧化碳的质量。
具体过程如下:解:设最多可生成二氧化碳的质量为x。
3222+2HCl =CaCl +CaC H O +CO 1004410gxO10010g=44x解得x=4.4g答:最多可制得二氧化碳的质量为4.4g 。
(基础)3.某同学称取了15g 石灰石样品(主要成分为碳酸钙),放入到质量为20g 的烧杯中,再加入50g 足量的稀盐酸,充分反应后,称得剩余总质量为80.6g 。
求:(1)生成二氧化碳的质量为多少? (2)该石灰石样品中碳酸钙的质量为多少? 【答案】(1)4.4g ; (2)10g【解析】(1)根据烧杯内物质的质量的减少求出二氧化碳的质量:50g+20g+15g-80.6g=4.4g ; (2)设石灰石样品中碳酸钙的质量为x , CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ 100 44x 4.4gx=10g, 答:(1)生成二氧化碳的质量为4.4g ; (2)该石灰石样品中碳酸钙的质量为10g 。
(基础)4.将0.5g 二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g 。
求:(1)生成氧气多少克? (2)原氯酸钾的质量是多少克? 【答案】(1)9.6克 (2)24.5克 【解析】解:设反应生成O 2的质量为x 2KClO 32KCl +3O 2↑149 96 14.9g x(2)149:96=14.9g:x,得x =9.6g(3)原先氯酸钾的质量=14.9g+ 9.6g= 24.5g(基础)5.取6.8g含杂质的锌粒于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸100g,实验结束后,称得烧杯中物质的总质量为106.6g。
(杂质不溶于水也不与稀硫酸反应)请计算: (1)产生氢气的质量为_____g。
(2)所用稀硫酸中溶质的质量分数_________。
(写出计算过程)【答案】(1) 0.2g;(2) 9.8%。
【解析】解:根据质量守恒定律可得,生成的氢气的质量为100g+6.8g−106.6g=0.2g设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑98 2100g×x 0.2gx=9.8%答:(1)产生氢气的质量为 0.2g(2)所用稀硫酸中溶质的质量分数为9.8%。
(基础)6.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0g石灰石样品(样品中的杂质不与稀盐酸反应),经粉碎后全部放入烧杯中,并加入足量的稀盐酸,烧杯及所盛物质的总质量为80.0g。
反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:反应时间/分0 2 4 6 8 10烧杯及所盛物质质量/克80.0 79.0 78.3 77.9 77.8 77.8试计算:(1)反应结束后,共放出多少克的二氧化碳?(2)该石灰石样品中碳酸钙的质量分数是多少?【答案】(1)2.2g.(2)50%【解析】(1)由表可知,反应后剩余固体的质量为77.8g,故生成二氧化碳的质量为80g-77.8g=2.2g;(2)设生成2.2g的二氧化碳需要碳酸钙的质量为xCaCO3+2HCl == CaCl2+H2O+CO2↑100 44x 2.2g=,解得x=5g,样品中碳酸钙的质量分数为×100%=50%。
答;共生成二氧化碳的质量为2.2g,样品中碳酸钙的质量分数为50%。
(重点)7.某兴趣小组对石灰石样品进行如下实验分析:取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。
请计算:次数 1 2 3 4加入稀盐酸的质量/g 25 25 25 25剩余固体的质量/g 8 4 2 2求:(1)样品中碳酸钙的质量为_____g:(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。
(写出计算过程,最终结果保留0.1%)。
【答案】(1)10 (2)10.5%【解析】根据加入相同质量、相同质量分数的稀盐酸后,前两次都是固体减少4g,而第三次只减少2g,说明此时已经完全无反应,说明剩余的固体为杂质,碳酸钙的质量为12g﹣2g=10g。
设生成的氯化钙的质量为x,生成的二氧化碳的质量为yCaCO3+2HCl=CaCl2+H2O+CO2↑100 111 4410g x y==x=11.1g y=4.4g第4次加入稀盐酸后所得溶液中CaCl2的质量分数为×100%≈10.5%答:(1)样品中碳酸钙的质量为 10g:(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数10.5%。
(重点)8.某课外兴趣小组为了测定当地石灰石中CaCO3的质量分数,取25g石灰石样品,粉碎后,将100g一定质量分数的稀盐酸分5次加入到该样品中,所测数据如下表所示(杂质不与稀盐酸反应,也不溶于水):次数一二三四五加入稀盐酸的质量/g20 20 20 20 20产生气体的质量/g 2.2 4.4 6.6 8.8 8.8(1)生成CO2的质量为_________g;(2)第__________次恰好完全反应;(3)求石灰石样品中CaCO3的质量分数。
_________【答案】(1)8.8 (2)四(3)80%【解析】(1)分析图表数据可知,生成CO2的质量为8.8g;(2)由表格中第五次加入盐酸后,生成气体的质量不再增加,并且前几次都是随着酸的成倍增加,生成气体的质量也成倍增加可知,第四次恰好完全反应;(3)解:设石灰石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑100 44x 8.8gx=20g,石灰石样品中CaCO3的质量分数是2010080% 25gg⨯=答:石灰石样品中碳酸钙的质量分数为80%。
(重点)9.(5分)某同学为了测定石灰石样品中碳酸钙的质量分数,取四份样品分别和稀盐酸反应,其实验数据记录如下表。
(杂质既不溶于水也不跟酸反应)通过对数据的分析和比较,回答下列有关问题:(1)在第1份样品的实验中, ▲ (填物质)完全反应了。
(2)m为▲(3)石灰石样品中碳酸钙的质量分数是多少?(请写出计算过程)(4)请在图中画出在6.0g样品中加稀盐酸的质量与产生气体质量变化关系的示意图。
【答案】⑴稀盐酸⑵2.2g ⑶ 83.3%⑷【解析】(1)第1份和第2份比较可以发现,当稀盐酸的质量增加时,气体的质量也在增加,说明第1份中碳酸钙没有完全反应,稀盐酸完全反应;(2)第1份放出二氧化碳的质量0.88g,说明每加入10g稀盐酸与碳酸钙完全反应,产生二氧化碳的质量为0.88g;第2份加入20g盐酸,是第一份稀盐酸质量的2倍,产生二氧化碳的质量为1.76g,也是第一份产生气体质量的2倍;而第三份加入30g盐酸,是第一份稀盐酸质量的3倍,产生二氧化碳的质量为2.2g,小于第一份产生气体的质量的3倍(0.88g×3=2.56g),说明碳酸钙此时完全反应,稀盐酸有剩余,则第四份的盐酸不反应。
故m的值为2.2;(3)设参加反应的碳酸钙的质量为xCaCO3+2HCl=CaCl2+H2O+CO2↑100 44x 2.2g, x=5.0g 石灰石中碳酸钙的质量分数为: ×100%=83.3%答:石灰石中碳酸钙的质量分数为83.3%。
(4)(重点)10.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。
课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再将100 g稀盐酸分4次加入烧杯中,每次均充分反应。
实验数据记录如下:次数第一次第二次第三次第四次加入稀盐酸的质量/g 25 25 25 25反应后烧杯中物质的总质量/g 35.2 58.4 82.6 107.6 (1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该石灰石样品中碳酸钙的质量。
【答案】(1)1.8;(2)83.3%【解析】(1)由于在第2次、第3次、第4次加入25g稀盐酸时烧杯内物质的质量的变化:23.2g、24.2g、25g,从而可以知道第2、3、4次加入稀盐酸时生成的二氧化碳的质量分别为:1.8g、0.8g、0g,因此第一次加入稀盐酸时生成的二氧化碳的质量也应该是1.8g;(2)由于第一次生成的二氧化碳的质量为1.8g,则生成二氧化碳的总质量为:1.8g+1.8g+0.8g=4.4g,然后由二氧化碳的质量根据化学方程式计算即可求出参与反应的碳酸钙的质量,设石灰石样品中碳酸钙的质量为x,二氧化碳的总质量=1.8g+1.8g+0.8g=4.4gCaCO3+2HCl=CaCl2+H2O+CO2↑100 444.4g,=10g石灰石样品中碳酸钙的质量分数。
答:石灰石样品中碳酸钙的质量分数为83.3%。
(重点)11.石灰石是我省的主要矿产之一。
学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g。
平均生成4份,进行实验,结果如下:实验 1 2 3 4加入样品的质量/g5 10 15 20生成的2CO的质量/g1.76 3.52 4.4 m(1)哪几次反应中矿石有剩余?______。