2017年人教版九年级化学计算题大全
- 格式:pptx
- 大小:480.75 KB
- 文档页数:65

专题13 综合计算1.【2017年某某省眉山市】(6分)某化学兴趣小组为测定某有机物(含C、H、O三种元素)中各元素的质量比,用下图实验装置(部分夹持装置略去)进行探究。
提示:装置C中发生的反应为2Na2O2+2CO2=2Na2CO3+O2实验数据:读数反应前质量/g 反应后质量/g电子天平a电子天平b请计算该有机物中各元素的质量比(写出计算过程)。
【答案】6:1:8有机物中碳、氢、氧三种元素质量比为3.6g:0.6g:4.8g=6:1:8第34题图2.【2017年某某省某某市】有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。
工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。
小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:反应前总质量m1反应后总质量m2回答下列问题:(1)配平化学方程式:2Al+2NaOH+2H2O_______NaAlO2+3H2↑(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有__________。
A.向锥形瓶中倒入样品时,撒出了部分粉末 B.在反应过程中有水蒸气逸出C.没有等装置中氢气全部排尽就称量【答案】(1)2 (2) 27%。
(3)BC54/x=6/ 解得x=Al%=m铝/m样品×100%=/20g×100%=27%答:该样品中铝的质量分数为27%。
(3)A.向锥形瓶中倒入样品时,撒出了部分粉末,不影响测定结果; B.在反应过程中有水蒸气逸出,导致氢气的质量偏多,计算的铝的质量偏大;样品中铝的含量偏高;C.没有等装置中氢气全部排尽就称量,导致氢气的质量偏少,计算得出铝的质量比实际偏低,样品中铝的含量偏低。

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。

(完整)2017九年级化学上册计算题专项复习题(完整)2017九年级化学上册计算题专项复习题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)2017九年级化学上册计算题专项复习题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)2017九年级化学上册计算题专项复习题的全部内容。
1九年级化学1--8单元计算题专项复习一:常见题型1、有关化学式的计算:1)关于相对分子质量的计算2)根据化学式计算物质中各元素质量比3)计算物质中某一元素的质量分数4)计算物质中某一元素的质量5)求样品中某物质的纯度或质量分数2、根据化学方程式的计算:(计算步骤:一设二写三标四列五解六答)1)直接根据化学方程式的简单计算2)有关实验室制取氧气或二氧化碳的计算3)有关工业上炼铁的计算二:经典例题及巩固练习有关化学式的计算例1:计算CaCO3、 2H2O 、 CO(NH2)2、CuSO4﹒5H2O的相对分子质量例2:常规题:H2O中各元素的质量比NH4NO3中各元素的质量比Ca(OH)2中各元素的质量比变形题:1)某铁的氧化物常用来作录音磁带和电讯器材的原材料。
实验测得该氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的化学式为()A. FeO B。
Fe2O3C。
Fe3O4 D. Fe(OH)32)[南通市]已知:维生素C的相对分子质量为176,维生素C中C、H、O三种元素的质量比为9∶1∶12。
则维生素C的化学式为。
3)(09重庆)根据化学方程式A+NaOH== B十H20推断,B,A的相对分子质量相差()A. 12 B。
18 C.22 D。

人教版九年级化学计算专题练习一、计算题(本大题共40小题,共200.0分)1.已知氧原子质量是2.657×10−26kg,碳−12的质量是1.993×10−26kg,求氧原子的相对原子质量.2.已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32.若硫原子的质量为m,则氧原子的质量为多少?3.已知作为相对原子质量基准的1个碳原子的1质量为1.66×10−27kg,一个铝原子的质量为4.482×10−26kg,12镁的相对原子质量为24.计算:(结果保留三位小数)(1)铝的相对原子质量.(2)一个镁原子的质量.4.某物质MO3中,含氧元素为60%,则MO3中的相对分子质量为多少?M的相对原子质量是多少?5.已知A原子的原子质量是3.986×10−26kg,A原子的质子数与中子数相等.碳12原子的质量为1.993×10−26kg.求(1)A原子的相对原子质量是多少?(2)A原子的中子数是多少?(3)A原子的电子数是多少?6.俄罗斯科学家最近合成了核电荷数为139元素的原子,经测定该原子质量为4.89946×10−25kg(已知碳原子质量为1.993×10−26kg)计算:(1)则该原子的相对原子质量是多少?(2)该原子中子数为多少?(3)中子数与电子数之差是多少?7.计算下列化学式的相对分子质量(或相对分子质量总和)CaCO3______ Cu(OH)2______ 3(NH4)2SO4______ CuSO4⋅5H2O______ .8.(1)计算KMnO4的各原子个数比.(2)计算KMnO4的相对分子质量.9.尿素[CO(NH2)2]是一种氮肥,请计算:(1)尿素的相对分子质量为______ .(2)尿素中氮元素的质量分数为______ .10.我们知道化学式中各原子的相对原子质量的总和,就是相对分子质量.下列是某些元素原子的相对原子质量H−1O−16C−12Cl−35.5Na−23K−39Ca−40根据化学式求出下列各物质的相对分子质量O2______ ,H2O______ ,CO2______ ,Ca(OH)2______ ,KClO3______ .11.学会审美.学习插花.同学们发现鲜花保鲜营养液中含有硼酸(H3BO3)、阿司匹林(C9H8O4)等物质.硼酸中硼元素(B)的化合价是______ ;阿司匹林的相对分子质量为180,其相对分子质量的计算式是______ .12.根据硝酸铵(NH4NO3)的化学式计算:(1)相对分子质量______ ;(2)N、H、O三种元素的质量比______ ;(3)N元素的质量分数______ .13.根据乙醇(酒精)C2H5OH的化学式进行以下计算:(相对原子质量:H−1C−12O−16)(1)计算乙醇分子的相对分子质量.(2)计算乙醇中各元素的质量比.(3)计算乙醇中碳元素的质量分数.14.已知一物质的化学式为C6H6,计算:(1)一个该物质的分子中含有______ 个原子(2)该物质的相对分子质量______(3)该物质中C:H(质量比)______(4)该物质中碳元素的质量分数为______ (保留到0.01%)15.科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON).请你根据丙烯酰胺(C3H5ON)的化学式计算:(1)丙烯酰胺(C3H5ON)的相对分子质量为______ .(2)丙烯酰胺中碳元素和氧元素的质量比是______ .(3)丙烯酰胺中氢元素的质量分数为______ .(4)200g丙烯酰胺中含氮元素多少______ g?(写出计算过程)16.兴趣小组的同学为了研究(Cu−Zn合金)样品中铜的含量,取该样品20g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如图所示.请计算:(1)反应的硫酸质量为______g;(2)求样品中铜的含量.17.7克铁和铜的混合物与100克稀盐酸恰好完全反应,生成0.2克气体,求:(1)铜的质量分数是多少?(2)原稀盐酸的溶质质量分数是多少?(3)最后所得溶液中加入21.6的水,其溶质质量分数是多少?18.将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可求,(1)生成氧气的质量为多少克?(2)固体残余物中含有什么物质?(3)质量各为多少?19.过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小.某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验.测得相关数据如图所示:(1)剩余的混合物中二氧化锰的质量为______ g(2)反应生成氧气的质量为______ g(3)计算该过氧化氢溶液中溶质的质量分数.(写出计算过程)20.某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:(1)实验中生成氢氧化铜的质量为______ g;(2)300g该废水中硫酸铜的质量;(3)该废水中硫酸的溶质质量分数.(计算结果精确到0.1%)21.某学习小组取氯酸钾与二氧化锰的混合物共3.3g,加热该混合物t时间后,冷却,称量剩余固体质量,重复以上操作,依次称得4个加热时间后剩余固体的质量,记录数据如下:反应时间t1t 2t 3t 4t 5剩余固体质量/g 2.48 2.41 2.34a 2.34请仔细分析实验数据,回答下列问题:(1)表中a值为______ ,完全反应后产生氧气的质量为______ g.(2)该混合物中氯酸钾的质量是多少?二氧化锰的质量是多少?22.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求:(1)样品中金属铜的质量是______g.(2)所用稀硫酸的溶质质量分数(写出计算过程).23.向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤后得到溶质质量分数为14.2%的无色溶液10g.请计算:(1)所得溶液中溶质的质量;(2)实验前试管中氢氧化钠溶液的溶质质量分数.(计算结果精确到0.1%)24.某同学加热33g氯酸钾和二氧化锰混合物制氧气,至混合物质量不再减少时得到23.4g固体.求:(1)生成氧气的质量?(2)反应前混合物中二氧化锰的质量分数?(计算结果保留至1%)25.有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:(1)赤铁矿中氧化铁的质量分数是______ ;(2)计算所使用的稀盐酸的溶质质量分数.26.为测定某敞口放置的氢氧化钠溶液的变质情况,某同学实验并记录如图:(1)配制实验步骤1所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是______;(2)B烧杯中发生反应的化学方程式为______;(3)根据已知条件求样品溶液中碳酸钠质量是多少?(4)根据计算得知D烧杯溶液中溶质的化学式为______.27.某尿素CO(NH2)2样品(杂质不含氮元素),经化验含氮量为44.8%,则样品中尿素的质量分数(纯度)?28.现有100克10%的食盐溶液,要使其质量分数变为20%,可采用:(1)加入食盐固体的质量是多少?(2)蒸发掉多少克水?29.32.5g锌可以跟150g 硫酸溶液恰好完全反应.计算:①这种硫酸溶液中溶质的质量分数是多少?②100g这种硫酸稀释成20%的硫酸,需加水多少克?30.在30℃时,将50g硝酸钾固体加入100g水中,充分搅拌后,仍有4.2g硝酸钾固体未溶解。

计算题1.某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液于烧杯中,逐滴滴入溶质质量分数为%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到%)求:(1)当废液中盐酸完全反应时,生成的二氧化碳的质量.(2)实验过程中实际参加反应的碳酸钠溶液的质量为多少(3)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.2.将一些氧化铜粉末加入到100克质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液中加入W克铁粉,充分反应后,过滤,烘干,得到干燥的固体物质仍是Wg,求:(1)原先氧化铜的质量是多少(2)最后得到的溶液中溶质的质量分数为多少(3)当W为何值时才能满足加入的铁粉和得到的固体质量相等\3.市场上某补钙制剂的说明书如图所示:请计算(不要求写计算过程):(1)葡萄糖酸钙的相对分子质量为;(2)葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为;(3)此钙片中含葡萄糖酸钙的质量分数为.4.20℃时硫酸的密度和溶质质量分数对照表:密度(克/厘米3)<溶质质量分数(%)102040608098>为测定铜锌合金的组成,取试样5克,加入质量分数为10%的稀硫酸至恰好不再产生气体为止,收集到0.04克氢气.试计算:(1)铜锌合金中锌的质量分数是多少(2)测定时用去10%的稀硫酸多少毫升(3)要配制上述质量分数的稀硫酸500毫升,需98%的浓硫酸多少毫升5.尿素是常用的一种化肥,其化学式为CO(NH2)2,根据其化学式进行计算(1)尿素的相对分子质量;(2)尿素中氮元素的质量分数是多少(3)60克尿素中含有氮元素多少克(4)多少克碳酸氢铵(NH4HCO3)中所含的氮元素与60克尿素中所含的氮元素质量相等6.某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)有关实验数据如下表::反应前反应后实验数据烧杯和稀盐酸的质量石灰石样品'的质量烧杯和其中混合物的质量150g12g157.6g(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为g.(2)求该石灰石中碳酸钙的质量分数.7.将氯酸钾与二氧化锰的混合粉末28.5克加热到不再放出氧气为止,得到固体残留物18.9克,试计算:*(1)生成氧气多少克(2)残留固体中都含有什么各多少克8.如图为某试剂公司出品的过氧化氢溶液(俗称双氧水)的标签.小达欲配制100g6%的过氧化氢溶液,需用该过氧化氢溶液多少克9.学校课外活动小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中称取生铁样品5.8g 放入烧杯中(烧杯的质量为30g).然后再加入50g稀硫酸,使之充分反应后,称量,烧杯及烧杯中物质的总质量为85.6g(已知该反应中稀硫酸恰好反应完,杂质不参与反应).请计算:(1)产生氢气的质量是多少(2)该生铁样品中铁的质量分数(精确到%)(3)反应后的溶液中溶质的质量分数(精确到%)10.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:第二次加入5g第三次加入5g第四次加入5g稀盐酸的用量'第一次加入5g剩余固体的质量3g2g1g1g(1)该石灰石样品中碳酸钙的质量分数是;。

初三化学化学计算题题20套(带答案)及解析一、中考化学计算题1.某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。
请你分析数据并进行有关计算。
(1)上表中x的数值为_____。
第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少?_____。
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少?_____。
【答案】5 4 92.5% 10.5%【解析】【详解】第一次和第三次以及第四次都是增加了2.5g,所以第二次也是增加2.5g,可知x为5,且第四次为恰好完全反应设样品中氯化钙的质量为x,生成氯化钠的质量为y。
2323Na CO+CaCl=CaCO+2NaCl111100117x10g y111117100==x y10g↓x=11.1gy=11.7 g样品中氯化钙的质量分数为11.1g100%12.5% 12g⨯≈所得不饱和溶液的溶质质量分数为11.7g+(12g-11.1g)100%=10.5% 50g+80g-10g⨯答:(1)上表中x的数值为5.第4次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是92.5%。
(3)所得不饱和溶液的溶质质量分数是10.5%。
2.化学实验小组的同学为了研究某公共场所铁制护栏锈蚀程度,取12.8g已生锈的铁护栏(假设其成分只有Fe和Fe2O3,不含其它杂质),加入到120g一定浓度的稀盐酸中,充分反应,测得产生气体质量与稀盐酸质量关系如图所示。
请回答问题:(1)发生复分解反应的化学方程式为_____。
(2)根据已知信息列出求解参加反应的铁的质量(X )的比例式_____。
(3)铁护栏中氧化铁的质量分数为_____。
(4)若用质量分数36.5%的浓盐酸配制120g 上述稀盐酸,需要浓盐酸与水的质量比为_____。

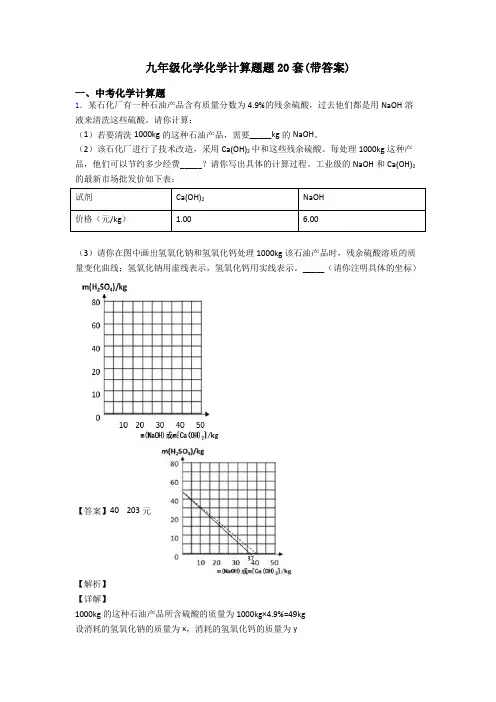
九年级化学化学计算题题20套(带答案)一、中考化学计算题1.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。
请你计算:(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
工业级的NaOH和Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元/kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】40 203元【解析】【详解】1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据2NaOH+H2SO4=Na2SO4+2H2O和Ca(OH)2+H2SO4=CaSO4+2H2O可得关系式为242 2NaOH H SO Ca(OH)809874x49kg y809874==x49kg yx=40kgy=37kg每处理1000kg这种产品,他们可以节约经费为6.00元/kg×40kg-1.00元/kg×37kg=203元图中画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,答:(1)若要清洗1000kg的这种石油产品,需要 40kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约203元经费。
(3)残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,2.BaCl2是一种重金属盐,其水溶液具有很强的毒性。

九年级化学专题训练—化学计算一、有关化学式的计算1.CO和x组成的混合气体中,氧元素质量分数为55%,则x是下列()物质A、CO2B、NO2C、SO2D、SO32.由MgO和另一种金属氧化物组成的混合物4g,已知含氧元素1.8g,则另一种金属氧化物是() A、CaO B、Fe2O3 C、Al2O3D、CuO3.化合物X2Y和YZ2中,Y元素质量分数分别为40%和50%,则化合物X2YZ3中Y元素质量分数为() A、45% B、25% C、20% D、16.7%4.FeSO4和Fe2(SO4)3的混合物中,硫元素质量分数为a%,则铁元素的质量分数为()A、 1—a% B、1—3a% C、2a% D、3a%5.KCl和MgCl2的混合物中,钾元素与镁元素原子个数比为2:1,则混合物中,MgCl2的质量分数为() A、56% B、38.9% C、30% D、78%6.有一包Mg和MgO组成的混合物,实验测知氧元素质量分数为32%,则其中镁单质占()A、20% B、40% C、48% D、80%7.在O2和SO2的混合气体中,氧元素的质量分数为60%,则该混合气体中O2与SO2的质量比为()A、1∶1 B、2∶1 C、1∶4 D、1∶28.元素x、Y组成两种化合物A和B,A中x元素占1417,B中x元素占78则x、Y组成的A、B化合物的化学式分别为() A、xY、xY2 B、x2Y、x2Y3C、xY2、x2Y D、xY3、x2Y4 9.减弱“温室效应”有效措施之一是大量植树造林,绿色植物在叶绿素存在下的光合作用是完成二氧化碳循环的重要一环。
已知叶绿素的相对分子质量小于900,其分子含C73.8%(以下均指质量分数)、H8.3%、N6.3%、Mg2.7%,其余为O.试确定叶绿素的化学式。
二、有关溶液的计算1.5g某物质完全溶解在95g水中,所得溶液中溶质的质量分数为()A、等于5%B、小于5%C、大于5%D、无法确定2.某硫酸钠溶液中,Na+与H2O分子个数比为1:50时,此溶液中硫酸钠质量分数为()A、32.4%B、1.96%C、7.3%D、88.75%3.用60%酒精溶液甲与25%酒精溶液乙混合,配制成45%酒精,所用甲、乙溶液的质量比为()A、1∶2B、2∶3C、4∶3D、3∶14.要使50g某物质溶液含水量由98%增加到99%,应加水()A、1gB、5gC、50gD、100g5.海水中Na+的质量分数为1.42%,如全部以NaCl计算,则海水中NaCl的质量分数为()A、3.61%B、39.3%C、14.2%D、55.81%6.25℃恒温条件下,将固体物质A的溶液200g蒸发20g水后,析出10gA;再蒸发20g水,又析出20gA,则蒸发前的溶液中溶质的质量分数是多少?7.t℃时,将210gKNO3溶液蒸发20g水后析出4g晶体;若将210g溶液蒸发掉24g水后,析出6g晶体,则原KNO3溶液中溶质的质量是多少?8.t℃时,将某固体物质溶液Mg分成两等份。

化学计算题中考真题专项练习一、计算题(1.实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有50g过氧化氢溶液的锥形瓶中,完全反应后,放出气体的质量与反应时间的关系如图所示.试求(1)完全反应后生成的氧气的质量为______g.(2)反应结束后,过滤、洗涤并烘干滤渣,称得滤渣的质量为______g.(3)计算原过氧化氢溶液中过氧化氢的质量.2.徐州地区石灰石资源丰富.某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:请计算:(1)4.0g石灰石样品中碳酸钙的质量是______ g.(2)10g稀盐酸能与______ g碳酸钙正好完全反应.(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1% ).3.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是______g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
4.测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示。
(已知CaCO3+2HCl=CaCl2+H2O+CO2↑杂质不参与反应,也不溶于水)(1)石灰石样品中碳酸钙的质量是______ g;(2)石灰石样品中碳酸钙的质量分数是______ ;(3)计算稀盐酸溶质的质量分数。
5.某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液的浓度进行了相关的实验,实验测得相关数据如图所示:计算:(1)反应生成氧气的质量;(2)该溶液中过氧化氢的质量.6.某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:(1)实验中生成氢氧化铜的质量为______g;(2)300g该废水中硫酸铜的质量;(3)该废水中硫酸的溶质质量分数。

(完整word版)2017中考化学计算题专题复习亲爱的读者:本文内容由我和我的同事精心收集整理后编辑发布到文库,发布之前我们对文中内容进行详细的校对,但难免会有错误的地方,如果有错误的地方请您评论区留言,我们予以纠正,如果本文档对您有帮助,请您下载收藏以便随时调用。
下面是本文详细内容。
最后最您生活愉快 ~O(∩_∩)O ~2017中考计算题专题复习可能用到的相对原子质量:Mn—55;Mg—24;Fe—56;Zn—65;Al—27;Ca—40;Cl—35.5;K—39;Cu—64;H—1;O—16;C—12;Na—23;S—32;N—14;Si—28;Ba—137一、平均值型计算选择题:例:两种金属粉末的混合物30克,与足量的稀硫酸反应,只生成氢气1克,则这种混合物中的两种金属可能是()A.Mg Al B.Zn Fe C.Mg Fe D.Al Fe【同题链接】1、一种不纯的铁,已知它含有铜、钙、镁的一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4反应时,生成H20.2g,则该铁样品中一定含有的金属杂质是()A.铜 B.镁 C.铝 D.钙2、把含有某一种氯化物杂质的氯化镁粉末95g溶于水后加入足量的AgNO3溶液,完全反应后生成白色沉淀300g,则氯化镁中的杂质可能是()A.NaCl B.AlCl3 C.KCl D.CaCl23、在某铁的样品中可能含有Zn、Mg、Al、Cu等杂质金属中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20gH2,则此铁的样品中不可能含有的杂质金属组是()A. Cu和Mg B. Zn和Al C. Mg和Al D. Zn和Cu4、某不纯的氯化铵样品中,测得其中氮元素的质量分数为28%,则混入的一种杂质可能是①NH4HCO3②(NH4)2SO4③NH4NO3④CO(NH2)2()A.(1)或(2) B.①或③ C.②或(4) D.(3)或(4)二、估算型选择题例:20g20%的NaOH溶液与20g20%的H2SO4溶液充分反应后,滴入紫色石蕊试液是()A.蓝色 B.紫色 C.红 D.无色【同题链接】1、相同质量的下列的物质中,铁的质量分数最高的是()A.FeS B.FeCO3 C.Fe2O3 D.Fe3O42、由二氧化硫和三氧化硫组成的混合气体中,硫元素与氧元素的质量比可能是()A. 1∶1B. 1∶1.25C. 1∶1.5D. 1∶2三、特殊规律型选择题例:某甲醛(HCHO)溶液中氢元素的质量分数为10%,则碳元素的质量分数正确的是()A.12% B.10% C.8% D.6%【同题链接】1、已知NaHS、MgSO4、和NaHSO3由组成的混合物中硫元素的质量分数为20%,则氧元素的质量分数为()A.35%B.25%C.65%D.无法计算四、溶质的质量分数计算1、已知20℃硝酸钾的溶解度为31.6g。
2017年中考化学试题汇编计算题23(2017·天水中考)将含有NaCl杂质的某烧碱样品10g完全溶于90g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸.在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示.(1)求l0g该样品中氢氧化钠的质量.(2)求a点时,溶液中溶质的质量分数(计箅结果精确到0.1%)【解答】解:当恰好完全反应时消耗的盐酸溶液的质量为100g,对应的HCl的质量为100g×7.3%=7.3g设氢氧化钠的质量为x,生成的氯化钠的质量为yNaOH+HCl═NaCl+HO240 36.5 58.5x 7.3g y==x=8gy=11.7ga点时,溶液中溶质的质量分数为×100%≈6.9%答:(1)l0g该样品中氢氧化钠的质量为8g.(2)a点时,溶液中溶质的质量分数约为6.9%36(2017·兰州中考)为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量.某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:(1)计算“石头纸”中碳酸钙的质量分数.(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)【解答】解:(1)设碳酸钙质量为x,生成氯化钙质量为y,CaCO3+2HCl═CaCl2+H2O+CO2↑,100 111 44x y 8.8g==,x=20g,y=22.2g,“石头纸”中碳酸钙的质量分数为:×100%=80%,答:“石头纸”中碳酸钙的质量分数为80%.(2)完全反应后烧杯内溶液的溶质的质量分数是:×100%=14.1%,答:完全反应后烧杯内溶液的溶质的质量分数是14.1%.18(2017·庆阳中考)(7分)某化学兴趣小组同学为回收一块质量为40 g的铜锌合金中的铜,将该合金放人烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100 g,烧杯内剩余固体27 g。
人教版中考化学计算题试卷及答案-百度文库doc(1)一、初中化学计算题1.计算下列问题:(1)食醋中含有醋酸(化学式为CH3COOH),醋酸中C、H、O元素质量之比为;在某醋酸水溶液中,碳元素质量分数为46%,则氧元素质量分数为。
(2)有一包纯净的铜粉在空气中灼烧一段时间后质量变为84g,向其中加入200gAgNO3溶液,恰好完全反应后过滤,得到141g固体,则原来这包纯净的铜粉质量为 g。
2.为测定某化工厂废水中硫酸的溶质质量分数。
同学们做了如下实验(废水中的其他成分不与铁发生反应)。
(1)反应共生成氢气____________g。
(2)废水中硫酸的溶质质量分数是多少?______3.现有一瓶敞口放置在空气中的氢氧化钠样品,为了探究样品变质的情况,某兴趣小组进行了如图1所示实验,加入稀盐酸的质量与产生气体质量的关系如图2所示。
请结合图1、2中的实验数据,完成以下计算:(1)完全反应时产生气体的质量是______g。
(2)图2中b的数值是______。
(3)恰好完全反应时所得溶液的溶质质量分数______(写出计算过程,计算结果精确到0.01%)。
4.某化工厂排放的废水中含有 H2SO4和 CuSO4两种污染物。
为测定废水中两种污染物的含量,给该化工厂提供污水处理的参考,某化学小组进行了以下实验:取该废水 100 g,向其中加入溶质质量分数为 10%的 KOH 溶液,测得生成沉淀的质量与加入 KOH 溶液的质量关系如图所示:回答下列问题:(1)产生氢氧化铜沉淀_____g。
(2)一开始加入氢氧化钾溶液没有产生沉淀的原因(化学方程式表示):_____。
(3)废水中硫酸铜质量分数为多少?(写出计算过程)(4)反应后溶液的质量分数为_____(结果保留到 0.1%)。
5.小明想测定Cu-Fe合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶稀硫酸和相关仪器。
(1)根据现有的条件,你认为只能测出________合金中铜的质量分数。
人教版中考化学计算题试卷及答案-百度文库doc一、初中化学计算题1.某工厂中排放的废液中含有H2SO4和CuSO4。
为了测定废液中CuSO4的含量,活动小组取100g废液,逐滴加入NaOH溶液至过量,测得生成Cu(OH)2沉淀的质量与所加NaOH溶液的质量关系如图,请回答:(1)充分反应后生成Cu(OH)2沉淀的质量______g。
(2)写出滴加NaOH溶液过程中O~A段所发生的化学反应方程式______。
(3)计算100g废液中CuSO4的质量。
2.乙炔(C2H2)是生产聚氯乙烯的重要原料。
用电石(主要成分为CaC2)与水反应可制取乙炔,最终还可得到电石渣。
某电石渣中含氢氧化钙92.5%,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
(1)100kg上述电石渣中氢氧化钙的质量为 kg。
(2)用上述电石渣处理含硫酸196kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
(3)把一定质量的乙炔、氧气、二氧化碳三种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:物质C2H2O2CO2H2O x反应前的质量/g8.914.4 4.400反应后的质量/g 3.7017.6n 2.8n= ;该反应的化学方程式为。
3.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH,反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。
其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g. (忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。
)(1)m 点的数值是_____。
(2)参加反应的碳酸钠溶液的溶质的质量分数是_____。
(3)请计算图二中C 点时溶液中溶质的质量分数_____(写出计算过程,最后结果精确到0. 1%)。
焦岱初中1、某工厂排出的废液中含有AgNO 332 3 2、 Zn〔 NO〕、Cu〔 NO 〕三种物质.为了分别并回收金属银和铜,设计了如下实验方案:〔1〕反响①中与铜粉反响的物质是.〔 2〕反响②中发生反响的化学方程式是.〔 3〕从固体 Y 中获取金属铜的方法有:物理方法:.化学方法:.2、向必然量 NaOH 溶液中,滴加稀HCl ,所加盐酸的量与溶液 pH的变化以以下图:⑴当参加稀HCl 的体积为 __________ml 时,稀HCl与NaOH溶液恰好完满反响;⑵向上述加了12ml 稀盐酸后的NaOH溶液滴加紫色石蕊试液, 溶液显 _________ 色;⑶当参加8mL 稀盐酸后 , 溶液中的溶质有________________________ 。
3、把 12.5g 的大理石放入盛有34.4g 稀盐酸的烧杯中,恰好完满反响后,烧杯中物质的总质量比反响前减少了4.4g .求大理石中碳酸钙的质量分数是多少?4、为了研究石灰石与稀盐酸反响制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20 克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6 %的碳酸钠溶液直至过分,有关的变化如右图所示:依照题中有关信息和图像解析答复以下问题:〔 1〕原废液中的溶质成分有〔用化学式答复〕。
〔 2〕A 点处溶液中溶质的质量?〔经过计算答复〕5、 50g 某稀硫酸中滴加某氯化钡溶液73.3g 恰好完满反响,经过滤、冲洗、烘干获取白色积淀.试答复:〔 1〕在过滤操作中需要的玻璃仪器有;〔 2〕反响后所得溶液中溶质的质量分数.6、现有氯酸钾和二氧化锰的混杂物共26.5g ,待反响不再有气体生成后,将试管冷却、称量,获取节余固体16.9g 。
求:⑴制取氧气的质量;⑵节余固体中含有的物质各为多少g?7、将必然质量的金属锌投入到100g 稀硫酸中恰好完满反响,放出气体的质量与反响时间的关系以以下图.试求:〔 1〕完满反响后生成H2的质量为g;〔 2〕所用硫酸溶液中溶质的质量分数.8、 10g 氯酸钾与二氧化锰的混杂物加热,完满反响后,质量减少 3.2g ,那么原混杂物中二氧化锰的质量是多少?9、实验用 2.45g 的氯酸钾和0.2g 的二氧化锰最多可制取多少克的氧气?10、实验室用含杂质的锌与稀盐酸反响制取氢气,取8 g含杂质的锌粒于烧杯中( 所含杂质不溶于水,也不与酸反响) ,向其中参加74.2 g稀硫酸,恰好完满反响后烧杯内节余物质的质量为82 g 。