微专题3 高考化学曲线的分析与应用
- 格式:pptx
- 大小:1.25 MB
- 文档页数:18

化学坐标曲线图分析考纲要求1.能够通过对实际事物、实验现象、实物、模型、图形、图表的观察,以及对自然界、社会、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储的能力。
2.能够将分析解决问题的过程和成果,用正确的化学术语及文字、图表、模型、图形等表达并做出解释的能力。
专家解读该题型以坐标曲线图为试题的信息来源,以化学中的基本概念、基本理论、元素化合物和化学实验等知识为载体,精心设计问题的一种信息处理和分析题。
主要考查学生实验设计能力,数据读取、分析与处理能力,图象的识别与分析能力,运用数学工具能力,以及灵活运用一些重要化学概念、规律与原理解决简单问题的能力。
通过分析近几年的高考试题可知,化学坐标曲线图主要分为:化学反应速率与平衡曲线、能量曲线、离子浓度曲线、物质性质(质量或物质的量)变化曲线等,突出考查学生对图象中的数据进行分析的能力,是对学生综合素质的考查。
预测2021年高考化学试题仍会保留一定量的曲线图试题,在题型稳定的基础上追求创新,图象会变得复杂,信息量更大,也可能根据题目情景考查学生绘图的能力。
坐标图是用来显示某一变量(应变量)是如何随着另一变量(自变量)而变化的。
其优点是不但显示了所测量的点,还可以用来预测一些实验中没有测量的数值。
解答时要求学生首先弄清楚自变量和因变量各代表什么样的化学量,然后根据化学知识分析概念——图象——数量三者之间的关系。
具体步骤可以概括为“一明标”,“二析点(起点、拐点、平衡点、极值点、突变点)”,“三识线”。
1.【2020•新课标Ⅰ卷】以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数随滴加NaOH溶液体积V NaOH 的变化关系如图所示。
[比如A2−的分布系数:]下列叙述正确的是( )A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1.0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)1.【参考答案】C【试题解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)==0.1000mol/L。

2021年高考化学二轮复习下篇专题三微题型八能量变化图像分析及盖斯定律多维应用1.反应A(g)+2B(g)===C(g)的反应过程中能量变化如右图所示。
曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时的能量变化.下列相关说法正确的是( )A.该反应是吸热反应B.催化剂改变了该反应的焓变C.催化剂降低了该反应的活化能D.该反应的焓变ΔH=-510 kJ·mol-1解析本题通过能量图像考查反应的热效应及催化剂与焓变的关系.由图像知生成物的能量比反应物的能量小,因此反应是放热反应,A项错;焓变与催化剂使用与否无关,B项错;催化剂可降低反应的活化能,C项正确;反应的ΔH=-(510-419) kJ·mol -1=-91 kJ·mol-1,D项错.答案C2.已知:2H2(g)+O2(g)===2H2O(g) ΔH1①CH2===CH2(g)+3O2(g)===2H2O(g)+2CO2(g) ΔH2②2CH3CH3(g)+7O2(g)===6H2O(g)+4CO2(g) ΔH3③CuO(s)+H2(g)===Cu(s)+H2O(g) ΔH4④2Cu(s)+O2(g)===2CuO(s) ΔH5⑤CH2===CH2(g)+H2(g)===CH3CH3(g) ΔH6⑥下列关于上述反应焓变(ΔH)的判断正确的是( )A.ΔH1<0,ΔH3>0 B.ΔH2>0,ΔH4<0C.ΔH1=ΔH4+ΔH5D.2ΔH6=ΔH1+2ΔH2-ΔH3解析氢气、有机物燃烧的反应均是放热反应,ΔH1<0、ΔH2<0,ΔH3<0,反应④为吸热反应,ΔH4>0,A项和B项错误;根据盖斯定律有④×2+⑤=①,故ΔH1=2ΔH4+ΔH5,C项错误;由盖斯定律可知D项正确。
答案D3.已知:NaHCO3在水溶液中水解的热化学方程式为:NaHCO3(aq)+H2O(l)===H2CO3(aq)+NaOH(aq) ΔH=a kJ·mol-1;稀盐酸和稀NaOH的中和热为b kJ·mol-1。

高中化学曲线型图像题类型与解析概论摘要曲线型图像题可分4类:溶解度曲线类多为利用物质溶解度的差异而分离或提纯某种物质;化学反应速率与化学平衡类多为探求因变量(化学反应速率变化或体现平衡移动的量)与自变量(外界条件)间的关系;反应体系中某种物质或某种离子的量的变化类多表达了化学反应从量变到质变的过程;推定化学反应类多为在定量条件下通过计算确定特定的化学反应。
关键词曲线型图像题类型能力化学曲线型图像题,指基于某种化学量随时间或条件的改变而产生连续性变化的曲线图像并依此而设计问题的试题。
纵观近20年的化学高考试题,曲线型图像试题所基于的化学基础知识主要有以下几类,溶解度曲线类、化学反应速率与化学平衡类、反应体系中某种物质或某种离子的量的变化类、定量推定化学反应等4类。
近年来此类试题的命制,其问题背景的设置更趋于现实化,有基于工业生产的、有基于环境污染或保护的、有基于研究性学习的等等,而从曲线形状来看主要有以下2种变化,一为从单线型向多线集合型变化,二为从理想的线性变化向实际的描点图形或计算机图谱方向转变。
解决此类基于曲线图形的化学问题必须通过对图形、图表的观察,去芜存精以获取有用的信息,这能充分考查学生的观察能力;而基于曲线图的问题必须进行辨析或将化学信息进行归纳而统摄成一定的规律,并运用此规律,进行推理或抽象成数学规律而解决问题,因此也充分体现了学生的思维能力[1];在解决曲线型试题时常需将试题所给的新信息,与课内已学过的有关知识结合起来,从而形成解决问题所需的新的知识或方法,这也能充分体现出学生的自学能力与创新能力;而曲线图也是化学实验中处理实验数据的一种典型方式,这在一定程度上也考查了学生的实验能力。
因此,此类试题必定是高考与竞赛中的热点,同时此类试题也是化学教学中培养学生学习能力的一种重要载体。
1 化学曲线型图像题类型与例析1.1 溶解度曲线类高中化学溶解度曲线类试题中的图像多为多线集合型,问题指向多为利用不同物质的溶解度曲线差异而分离或提纯某种物质。
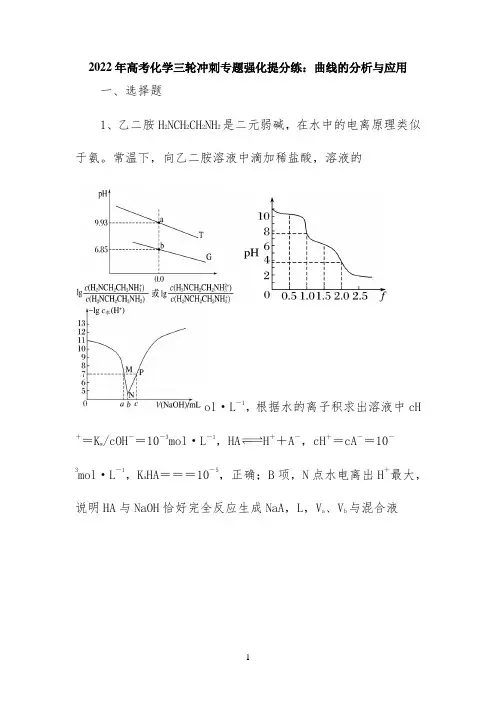
2022年高考化学三轮冲刺专题强化提分练:曲线的分析与应用一、选择题1、乙二胺H2NCH2CH2NH2是二元弱碱,在水中的电离原理类似于氨。
常温下,向乙二胺溶液中滴加稀盐酸,溶液的ol·L-1,根据水的离子积求出溶液中cH -=10-3mol·L-1,HA H++A-,cH+=cA-=10-+=Kw/cOH3mol·L-1,K-5,正确;B项,N点水电离出H+最大,a HA===10说明HA与NaOH恰好完全反应生成NaA,L,V a、V b与混合液ol·L-1、AgI的饱和溶液中加入氢碘酸溶液,可使溶液由A点变到B点D向·L-1AgNO3溶液中加几滴·L-1NaCl溶液,静置片刻,再向溶液中加几滴·L-1KI溶液,有黄色沉淀生成,说明K s ol·L -1=8×10-12mol·L-1,错误;C项,向AgCl、AgI的饱和溶液中加入氢碘酸溶液,AgCl转化为AgI,氯离子浓度降低,不可能使溶液由A点变到B点,错误;D项,向·L-1AgNO3溶液中加几滴·L -1NaCl溶液,静置片刻,再向溶液中加几滴·L-1KI溶液,过量的银离子与碘离子反应,有黄色沉淀生成,而不一定是氯化银转化为碘化银,不能说明K s ol·L-1,此时混合溶液中cAg+==×10-2mol·L-1,故K sol·L-1]时,a曲线对应的纵坐标为11,b曲线对应的纵坐标为6,即R2-的浓度分别为1×10--13,b 11mol·L-1和1×10-6mol·L-1,所以a曲线的Ksp=1×10曲线的K sp=1×10-8,由于K sp PbCO3<K sp PbSO4,所以a曲线表示PbCO3,A项不符合题意;PbSO4与Na2CO3反应转化为更难溶的PbCO3,PbCO3受热分解为PbO,被焦炭还原可制得Pb,B项不符合题意;PbSO4与PbCO3共存时,cPb2+相等,则===1×105,C 项不符合题意;向X点对应的溶液中加入PbNO32,cPb2+增大,PbSO4的沉淀溶解平衡逆向移动,cSO减小,所以不能转化为Y点对应的溶液,D项符合题意。

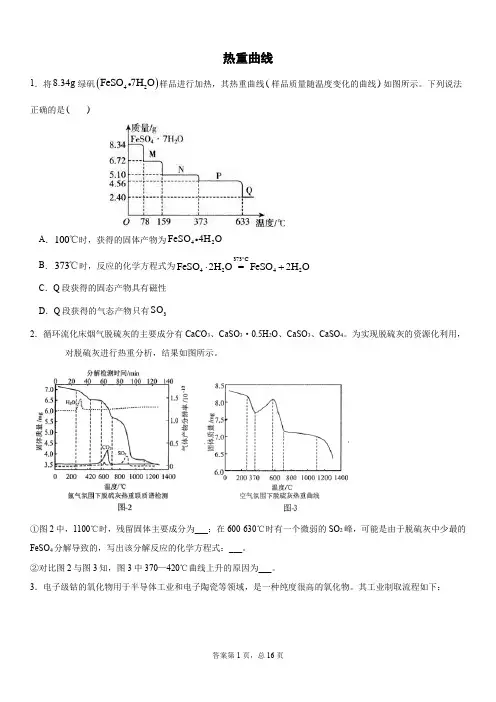
热重曲线1.将8.34g 绿矾()42FeSO 7H O 样品进行加热,其热重曲线(样品质量随温度变化的曲线)如图所示。
下列说法正确的是( )A .100℃时,获得的固体产物为42FeSO 4H OB .373℃时,反应的化学方程式为373C4242FeSO 2H O =FeSO 2H O ︒⋅+C .Q 段获得的固态产物具有磁性D .Q 段获得的气态产物只有3SO2.循环流化床烟气脱硫灰的主要成分有CaCO 3、CaSO 3·0.5H 2O 、CaSO 3、CaSO 4。
为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如图所示。
①图2中,1100℃时,残留固体主要成分为___;在600-630℃时有一个微弱的SO 2峰,可能是由于脱硫灰中少最的FeSO 4分解导致的,写出该分解反应的化学方程式:___。
②对比图2与图3知,图3中370—420℃曲线上升的原因为___。
3.电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。
其工业制取流程如下:(1)滤渣A的成分除过量的Co3(PO4)2和Fe(OH)3外还有_____________ (填化学式)。
(2)加入Co3(PO4)2的目的是__________________。
(3)Co与稀硝酸反应生成Co2+的离子方程式为______________________________。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出B点物质的化学式:__________,C点物质的化学式:________________。
4.NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如图所示:①T3温度后,草酸镍全部转化为三氧化二镍,则a为_____(保留一位小数)。
②T2温度发生反应的化学方程式为___________。
5.食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。



2019年高考化学三轮冲刺专题强化提分练:曲线的分析与应用一、选择题1、乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。
常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。
下列叙述不正确的是( )A.常温下,pK b2=-lgK b2=7.15B.溶液中水的电离程度:a点大于b点C.H3NCH2CH2NH3Cl2溶液中c(H+)>c(OH-)D.曲线G代表pH与lg的变化关系答案:B解析二元弱碱的第一步电离大于第二步电离,氢氧根离子浓度第一步电离的大,故曲线G代表pH与lg的变化关系,选项D正确;参照pH的计算,常温下,b点时lg c H3NCH2CH2NH2+3c H2NCH2CH2NH+3=0, pK b2=-lgK b2=14-pH=7.15,选项A正确;a点pH大于b点,氢氧根离子浓度较大,对水的电离抑制程度大,故溶液中水的电离程度:a点小于b点,选项B不正确;H3NCH2CH2NH3Cl2为强酸弱碱盐,水解溶液中c(H+)>c(OH-),选项C正确。
2、向0.10mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=n HCln Na2CO3]与混合液pH的关系如图所示。
下列说法正确的是()A.f =0时,溶液中:c(Na +)=2c(CO 2-3)B.f =0.5时,溶液中:c(HCO -3)>c(CO 2-3)C.f =1时,溶液中:c(Na +)+c(H +)=2c(CO 2-3)+c(HCO -3)+c(OH -) D.f =2时,溶液中:12c(Na +)=c(CO 2-3)+c( HCO -3)+c(H 2CO 3)答案 B解析 A 项,f =0时,溶液中的溶质为Na 2CO 3,因CO 2-3水解,则溶液中c(Na +)>2c(CO 2-3),错误;B 项,f =0.5时,溶液中NaHCO 3和Na 2CO 3等物质的量,因CO 2-3的水解程度大于HCO -3,则溶液中c(HCO -3)>c(CO 2-3),正确;C 项,f =1时,溶液中的溶质为NaHCO 3和NaCl ,根据电荷守恒定律可知:c(Na +)+c(H +)=2c(CO 2-3)+c(HCO -3)+c(OH -)+c(Cl -),错误;D 项,f =2时,Na 2CO 3恰好和HCl 反应,有少量CO 2逸出,溶液中:12c(Na +)>c(CO 2-3)+c( HCO -3)+c(H 2CO 3),错误。

2020届高考化学人教第二轮复习专题强化练曲线的分析与应用一、选择题1、已知pOH=-lg c(OH-)。
向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )A.稀H2SO4的物质的量浓度为0.05mol·L-1B.当溶液中pH=pOH时,水的电离程度最大C.a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH+4)+2c(H+) D.a、b、c三点对应NH+4的水解平衡常数:K h(b)>K h(a)>K h(c)答案 B解析向20mL0.1mol·L-1的氨水中滴加未知浓度的稀H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应,放热最多,溶液的温度最高,所以硫酸的体积为20mL时,恰好完全反应。
20mL0.1mol·L-1的氨水中含有一水合氨的物质的量为0.1mol·L-1×0.02L=0.002mol,硫酸的体积为20mL时,恰好完全反应,则消耗硫酸的物质的量为0.001mol,该硫酸的物质的量浓度为0.001mol/0.02L=0.05mol·L-1,故A正确;当溶液中的pH=pOH时,溶液为中性,此时溶质为硫酸铵和氨水,铵根离子的水解程度与氨水的电离程度相等,水的电离几乎没有影响,当氨水与硫酸恰好反应生成硫酸铵时,即b点时,铵根离子水解,促进了水的电离,此时水的电离程度最大,故B错误;a点加入10mL0.05mol·L-1稀H2SO4,反应后溶质为一水合氨和硫酸铵,且一水合氨为硫酸铵浓度的2倍,根据电荷守恒可得:c(NH+4)+c(H+)=2c(SO2-4)+c(OH-),根据物料守恒可得:c(NH3·H2O)+c(NH+4)=4c(SO2-4),二者结合可得:c(NH3·H2O)+2c(OH-)=c(NH+4)+2c(H+),故C正确;升高温度促进NH+4的水解,水解平衡常数增大,由图可知,温度:b>a>c,则a、b、c三点NH+4的水解平衡常数K h(b)>K h(a)>K h(c),故D正确。

2024年高三化学考前复习溶液中分布系数曲线的分析与应用 指数梳理1.认识分布系数图(1)分布系数:溶液中某酸碱组分的平衡浓度占其总浓度的分数,用δ表示。
(2)分布系数δ与溶液pH 的关系曲线称为分布曲线。
2.分布系数图的特点及点、线的含义以草酸(H 2C 2O 4)为例,在不同pH 溶液中存在的三种微粒形式(H 2C 2O 4、HC 2O -4、C 2O 2-4)的分布系数图如下:(1)曲线Ⅰ、Ⅱ、Ⅲ分别代表哪种微粒的变化情况?曲线Ⅰ:__________,曲线Ⅱ:__________,曲线Ⅲ:__________。
答案 H 2C 2O 4 HC 2O -4 C 2O 2-4(2)交点A 、C 的含义及应用①交点A 粒子浓度的等量关系:c (HC 2O -4)=c (H 2C 2O 4);交点C 粒子浓度的等量关系:c (C 2O 2-4)=c (HC 2O -4)。
②利用交点A 、C 粒子浓度的等量关系,可以很方便的计算草酸(H 2C 2O 4)的K a1和K a2。
K a1=________________________________________________________________________, K a2=________________________________________________________________________。
答案 c (HC 2O -4)·c (H +)c (H 2C 2O 4)=10-1.2 c (C 2O 2-4)·c (H +)c (HC 2O -4)=10-4.2 (3)B 、D 点的含义及应用①最高点D 对应的三种粒子浓度的关系:________________________,分析与B 点的关系:__________________。
答案 HC 2O -4浓度最大,c (H 2C 2O 4)=c (C 2O 2-4) B 点c (H 2C 2O 4) =c (C 2O 2-4),B 、D 点对应的氢离子浓度相同②根据B 、D 点,c (H 2C 2O 4) 、c (C 2O 2-4)关系,你能推出c (H +)与K a1、K a2的关系式吗?答案 K a1·K a2=c (HC 2O -4)·c (H +)c (H 2C 2O 4)·c (C 2O 2-4)·c (H +)c (HC 2O -4)=c 2(H +)·c (C 2O 2-4)c (H 2C 2O 4),由于B 、D 点c (H 2C 2O 4) =c (C 2O 2-4),则c 2(H +)=K a1·K a2③最高点D 代表的是NaHC 2O 4溶液吗?答案 不是,由图可知,NaHC 2O 4溶液的pH 介于1.2~4.2之间,呈酸性,HC 2O -4的电离程度大于水解程度,则c (C 2O 2-4)>c (H 2C 2O 4),而δ(HC 2O -4)的最高点D 点存在δ(C 2O 2-4)=δ(H 2C 2O 4)。
高考化学生坐标曲线图例析作者:***来源:《中学生数理化·高考数学》2020年第06期高考有一种题型是以坐标曲线图为试题的信息来源,以化学中的基本概念、基本理论、元素化合物和化学实验等知识为载体,精心设计问题,主要考查考生实验设计能力,数据读取、分析与处理能力,图像的识别与分析能力,运用数学工具能力,以及灵活运用一些重要化学概念、规律与原理解决简单问题的能力。
通过分析近几年的高考试题可知,化学坐标曲线图主要分为:化学反应速率与平衡曲线、能量曲线、离子浓度曲线、物质性质(质量或物质的量)变化曲线等,突出考查考生对图像中的数据进行分析的能力,是对考生综合素质的考查。
预测2020年高考化学试题仍会保留一定量的曲线图试题,在题型稳定的基础上追求创新,图像会变得复杂,信息量更大,也可能根据题目情景考查考生绘图的能力。
坐标图是用来显示某一变量(应变量)是如何随着另一变量(自变量)而变化的。
其优点是不但显示了所测量的点,还可以用来预测一些实验中没有测量的数值。
解答时要求考生首先弄清楚自变量和因变量各代表什么样的化学量,然后根据化学知识分析概念、图像、数量三者之间的关系。
具体步骤可以概括为“一明标”“二析点(起点、拐点、平衡点、极值点、突变点)”“三识线”。
例1 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图1所示。
下列说法错误的是()。
例2 某温度下,HNO。
和CH。
COOH的电离常数分别为5.0×10-4和1.7×10-5。
将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图2所示。
下列叙述正确的是()。
例3 在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图3中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是()。
2021届高三化学一轮复习——曲线的分析与应用1.(2020·杭州高级中学模拟)常温下用0.1 mol·L -1NaOH 溶液滴定10.00 mL 二元弱酸H 2A 溶液,滴定曲线如图所示,d 点恰好中和。
假设混合时溶液体积变化忽略不计,下列说法不正确的是( )A .a 点pH>1B .c 点时c (Na +)=c (H 2A)+2c (A 2-)+c (HA -)C .b 点时:c (Na +)>c (HA -)>c (H +)>c (A 2-)>c (OH -)D .滴定过程中c (Na +)+c (A 2-)+c (HA -)+c (H 2A)=0.1 mol·L -1答案 B解析 由图像可知,当氢氧化钠加入20.00 mL 时,反应达到终点,此时酸碱恰好完全反应,由此可得:c (NaOH)×V (NaOH)=2c (H 2A)×V (H 2A),c (H 2A)=0.1 mol·L -1×0.02 L 0.01 L ×2=0.1 mol·L -1,H 2A 是弱酸,则a 点溶液中的氢离子浓度小于0.10 mol·L -1,pH 大于1,故A 正确;c 点时溶液呈中性,根据电荷守恒:c (Na +)+c (H +)=2c (A 2-)+c (HA -)+c (OH -),c (H +)=c (OH -),则c (Na +)=2c (A 2-)+c (HA -),c (Na +)<c (H 2A)+2c (A 2-)+c (HA -),故B 错误;b 点酸碱1∶1反应,溶质为NaHA ,HA -会发生水解和电离,故c (Na +)>c (HA -),此时溶液显酸性,说明HA -的电离程度大于其水解程度,则c (H +)>c (A 2-)>c (OH -),故C 正确;因NaOH 溶液的浓度为0.1 mol·L -1,c (H 2A)=0.1 mol·L -1,结合物料守恒可得滴定过程中c (Na +)+c (A 2-)+c (HA -)+c (H 2A)=0.1 mol·L -1,故D 正确。