镁铝及其化合物的化学反应方程式
- 格式:doc
- 大小:32.00 KB
- 文档页数:1

镁铝及其化合物知识归纳及巩固之二——镁铝化合物二、镁和铝的氧化物1.结构:氧化镁和氧化铝均为离子化合物2.物理性质:氧化镁和氧化铝均为白色不溶于水的固体,熔、沸点高(氧化镁为2852℃,不用于制备镁的原因;氧化铝为2050℃,故电解熔融的氧化铝制备单质铝,由于氧化铝的熔点很高,在氧化铝中添加冰晶石(Na3AlF6)降低其熔点。
)。
刚玉的主要成分是Al2O3,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。
硬度大。
3.化学性质:(1)氧化镁(MgO)属于碱性氧化物。
(2)氧化铝(Al2O3)是两性氧化物。
①与酸反应:Al2O3+6HCl=AlCl3+3H2O②与碱反应:Al2O3+2NaOH=2NaAlO2+H2O既能与酸反应又能与碱反应生成盐和水的氧化物叫两性氧化物。
4.用途:(1)氧化铝是冶炼金属铝的主要原料。
(2)常作耐火材料,制造耐火坩埚、耐火管和耐高温的实验仪器等。
(3)氧化镁可用于染料、油漆、玻璃、化学试剂、医药、食品添加剂等方面。
5.制法:(1)氧化镁:实验室:Mg(OH)2MgO+H2O工业上:MgCO3MgO+CO2↑(2)氧化铝:从铝土矿中分离提纯。
【例】工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:(1)将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中;(2)通入过量二氧化碳使(1)所得溶液中析出氢氧化铝固体;(3)使氢氧化铝脱水生成氧化铝;(4)电解熔融氧化铝生成铝。
请写出上述各有关反应的化学方程式:(1);(2);(3);(4)。
在上述转化过程中消耗能量最多的步骤序号为;原因:。
解析:(1)Al2O3+2NaOH=2NaAlO2+H2O;(2)CO2+2H2O+NaAlO2=Al(OH)3↓+NaHCO3;(3)2Al(OH)3Al2O3+3H2O;(4)2Al2O3(熔融)4Al+3O2↑;(4);氧化铝的熔点高。
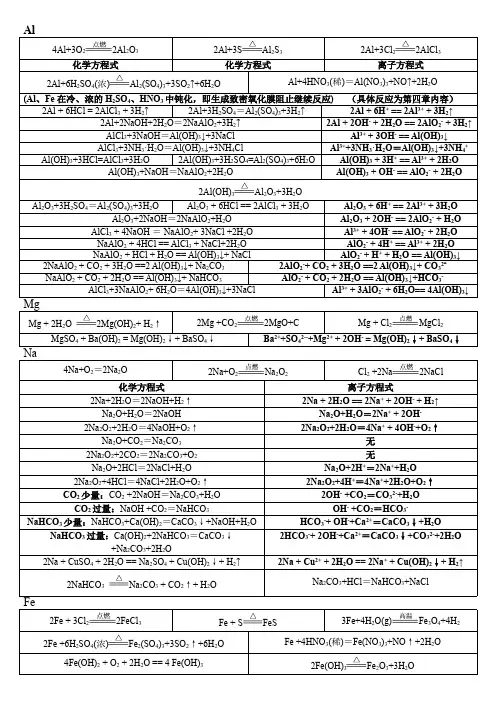

Na、Mg、Al、Fe及其化合物的化学方程式和离子方程式一、Na及其化合物的化学方程式和离子方程式(1)Na的反应1、钠和水反应:方程式: 2Na+2H2O=2NaOH+H2↑ 离子方程式: 2Na+2H2O=2Na+2OH-+H2↑2.钠分别和氧气、硫、氯气:2Na+O2点燃Na2O2 (或加热) 4Na+O2=2Na2O2Na+S=Na2S 2Na+Cl2点燃2NaCl3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式: 2Na+H2SO4=Na2SO4+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式:2Na+2CH3COOH=2CH3COONa+H2↑离子方程式: 2Na+2CH3COOH=2CH3COO-+2Na++H2↑4.钠分别和硫酸铜溶液、氯化铁溶液方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑方程式: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑离子方程式:6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑(2)Na的氧化物反应1.氧化钠分别与水、盐酸方程式: Na2O+H2O=2NaOH 离子方程式: Na2O+H2O=2Na++2OH-方程式: Na2O+2HCl=2NaCl+H2O 离子方程式: Na 2O+2H+=2Na++H2O2.过氧化钠分别与盐酸、水方程式: 2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式: 2Na2O2+4H+ =4Na++2H2O+O2↑方程式: 2Na2O2+2H2O=4NaOH+O2↑离子方程式: 2Na2O2+2H2O=4Na++4OH-+O2↑3.过氧化钠分别与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3、NaHCO3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na2CO3、NaHCO3的方法)碳酸钠受热不分解2NaHCO3△Na2CO3+H2O+CO2↑2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na2CO3+HCl=NaHCO3 +NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O过量的盐酸时:Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32-+2H+=CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或CO2+Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合(类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑2NaCl+2H2O电解Cl2↑+H2↑+2NaOH2Cl-+2H2O电解Cl2↑+H2↑+2OH-9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么?(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3 + OH-溶液呈碱性二、Mg 、Al 及其化合物的化学方程式和离子方程式 (1)Mg 的反应1.镁在空气中燃烧2Mg + O 2 2MgO 3Mg +N 2 Mg 3N 2 2Mg + CO 2 2MgO + C 2.镁能溶解在氯化铵溶液中Mg + 2NH 4Cl = MgCl 2 + H 2↑+ NH 3↑ Mg + 2NH 4+ = Mg 2+ + H 2↑+ NH 3↑ (2) Al 的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O 2=2Al 2O 3 在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。

在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。


专题十四 镁、铝及其化合物考纲展示 命题探究考点一 镁、铝单质性质及应用1 镁(1)物理性质具有银白色金属光泽固体,密度、硬度均较小,熔点较低,有良好导电、传热与延展性。
(2)构造――→-2e -(3)化学性质①与非金属单质反响(O 2、N 2、Cl 2)2Mg +O 2=====点燃2MgO (产生耀眼白光)3Mg +N 2=====点燃Mg 3N 2Mg +Cl 2=====点燃MgCl 2②与水(反响)Mg +2H 2O=====△Mg(OH)2+H 2↑③与酸反响Mg +2H +===Mg 2++H 2↑④与盐反响Mg +Cu 2+===Mg 2++Cu⑤与CO 2反响2Mg +CO 2=====点燃2MgO +C(4)用途生产合金,冶金工业上用作复原剂与脱氧剂。
(5)冶炼工业炼镁:MgCl 2=====通电熔融Mg +Cl 2↑ 2 铝(1)铝物理性质及用途(2)铝构造与存在铝位于元素周期表第3周期ⅢA 族,原子构造示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中铝全部以化合态存在。
(3)化学性质①与非金属单质反响(O 2、Cl 2、S)2Al +3Cl 2=====△2AlCl 32Al +3S=====△Al 2S 3(水溶液不存在)②与酸反响③与碱反响2Al +2OH -+2H 2O===2AlO -2+3H 2↑④与盐反响Al +3Ag +===Al 3++3Ag⑤与氧化物反响(铝热反响)2Al +Fe 2O 3=====高温2Fe +Al 2O 34Al +3MnO 2=====高温3Mn +2Al 2O 3Cr 2O 3+2Al=====高温2Cr +Al 2O 3(4)冶炼工业炼铝:2Al 2O 3=====通电熔融4Al +3O 2↑ 学霸巧学卡 对镁、铝性质深层理解(1)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器与泡沫灭火器灭火。
同时镁与氮气反响生成Mg 3N 2。

钠镁铝及其化合物重要方程式小结1.4Na+O2=2Na2O 2Na2O+O2△2Na2O2 2Na+O2点燃Na2O2注:Na2O2为淡黄色固体粉末2.2Na+2H2O=2NaOH+H2↑(钠与水反应的现象:浮、熔、游、嘶、红)Na与水反应的实质,若与稀硫酸、盐酸反应呢?Na与硫酸铜溶液反应呢?3.Mg+Cl2点燃MgCl2 Mg+Br2=MgBr2Mg+S △2Mg+O2点燃2MgO4.2Al+3Cl2点燃2AlCl34Al+3O2点燃2Al2O3(钝化)5.2Al+6HCl=2AlCl3+3H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑6.2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化)7.Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O8.3Fe+4H2O(g)高温Fe3O4+4H29.2NaOH(过量)+CO2=Na2CO3+H2O NaOH+CO2(过量)=NaHCO32NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(足量)=NaHSO310.Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑注:此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑11.Na2O+2HCl=2NaCl+H2O(金属氧化物与盐酸、稀硫酸反应通常生成盐和水)2Na2O2+4HCl==4NaCl+2H2O+O2↑12.Na2O+CO2==Na2CO3 2Na2O2+2CO2=2Na2CO3+O2(无气体符号)注意:对比氧化钠、过氧化钠分别与水、二氧化碳及盐酸反应的特征。
13.MgO+H2SO4=MgSO4+H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O注:Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O14.2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+2NaOH=2NaAlO2+H2OAl(OH)3+NaOH=NaAlO2+2H2O注:⑴产物均有NaAlO2,⑵当金属铝无论是与盐酸、稀硫酸等非氧化性酸,还是与氢氧化钠等强碱溶液反应时,均为2mol铝生成3mol H2。

有关镁铝的化学方程式镁和铝是两种常见的金属元素,它们在化学反应中可以生成各种化合物。
以下是一些常见的镁铝化学方程式:1.镁与稀硫酸反应:Mg + H2SO4 → MgSO4 + H2↑这个反应是金属与酸反应的典型例子。
镁与稀硫酸反应生成硫酸镁和氢气。
这是一个放热反应,可以观察到反应物迅速产生气泡并放出热量。
2.铝与稀盐酸反应:2Al + 6HCl → 2AlCl3 + 3H2↑铝与稀盐酸反应生成氯化铝和氢气。
这个反应也是一个放热反应,可以观察到反应物迅速产生气泡并放出热量。
3.镁与氧气反应:2Mg + O2 → 2MgO镁与氧气在点燃条件下反应生成氧化镁。
这是一个重要的金属氧化反应,可以观察到镁在氧气中燃烧发出耀眼的白光。
4.铝与氧气反应:4Al + 3O2 → 2Al2O3铝与氧气在点燃条件下反应生成氧化铝。
这个反应也是金属氧化反应之一,可以观察到铝在氧气中燃烧发出明亮的白光。
5.镁与水反应:Mg + 2H2O → Mg(OH)2 + H2↑镁与水在加热条件下反应生成氢氧化镁和氢气。
这个反应可以用于制备氢氧化镁和氢气。
6.铝与氢氧化钠反应:2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑铝与氢氧化钠反应生成偏铝酸钠和氢气。
这个反应可以用于制备氢气和偏铝酸钠。
以上这些化学方程式涵盖了镁和铝的一些重要化学反应。
这些反应不仅存在于化学实验室中,也在工业生产和日常生活中有广泛应用。
例如,镁铝的合金被广泛应用于航空航天、汽车和建筑等领域,因为它们具有高强度、轻质和防腐蚀等优点。
此外,镁和铝的化合物也被广泛应用于医药、陶瓷和玻璃等领域。
在实际操作中,需要注意的是化学反应的条件和注意事项,以确保实验安全和得到正确的产物。
例如,在进行金属与酸的反应时,需要使用适当的酸、控制反应温度和时间,并注意防止金属与酸产生大量热量导致温度升高和可能的安全问题。
同时,在操作过程中要注意个人安全防护措施,如戴手套、防护眼镜等,以防止可能的化学伤害。

化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。

课时11 镁、铝及其重要化合物知识点一 镁、铝的性质及应用【考必备·清单】 1.镁、铝的结构和存在名称 镁 铝 周期表中位置 第三周期ⅡA 族第三周期ⅡA 族原子结构示意图自然界存在形态 化合态化合态2.镁、铝的物理性质都是银白色、有金属光泽的固体,密度较小,硬度较低,均具有良好的延展性、导电性和导热性等。
3.铝的化学性质写出图中有关反应的化学方程式:②2Al +3Cl 2=====点燃2AlCl 3④2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al +Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应)[名师点拨]①常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
②能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
5.与铝对比记忆镁的化学性质铝镁与非金属反应能被Cl2、O2、N2氧化2Mg+O2=====点燃2MgO(与O2反应)3Mg+N2=====点燃Mg3N2(与N2反应)与水反应反应很困难能与沸水反应:Mg+2H2O=====△Mg(OH)2+H2↑与碱反应能溶于强碱溶液不反应与某些氧化物反应能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应能在CO2中燃烧:2Mg+CO2=====点燃2MgO+C[名师点拨]①Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
②镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气。
6.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应[名师点拨]①由MgCl2·6H2O到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
②因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
镁铝及其化合物1.(2020·吴江汾湖高级中学高三月考)白钠镁矾(mNa2SO4⋅nMgSO4⋅xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3⋅Mg(OH)2⋅4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3⋅3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶须。
(1)热解反应的方程式为___。
(2)碱式碳酸镁可用作化学冷却剂,原因是___。
(3)为测定白钠镁矾的组成,进行下列实验:①取白钠镁矾3.340g溶于水配成100.00mL溶液A;②取25.00mL溶液A,加入足量的氯化钡溶液,得BaSO41.165g;为进一步确认沉淀是否已完全,可采取的操作是___。
③另取25.00mL溶液A,调节pH=10,用浓度为0.1000mol⋅L-1的EDTA标准溶液=MgY2-+2H+),滴定至终点,消耗标准溶液25.00mL。
滴定Mg2+(离子方程式为Mg2++H2Y2通过计算确定白钠镁矾的化学式。
___(写出计算过程)。
【答案】(1)5MgCO3⋅3H2O+2H2O4MgCO3⋅Mg(OH)2⋅4H2O+CO2↑(2)碱式碳酸镁分解吸热(3)向上层清液中继续滴加BaCl2溶液,若无白色沉淀再产生,则已经沉淀完1/ 22全 Na2SO4⋅MgSO4⋅4H2O【解析】(1)升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体,说明反应在溶液中进行,生成物为4MgCO3⋅Mg(OH)2⋅4H2O,方程式为5MgCO3⋅3H2O+2H2O4MgCO3⋅Mg(OH)2⋅4H2O+CO2↑,故答案为:5MgCO3⋅3H2O+2H2O4MgCO3⋅Mg(OH)2⋅4H2O+CO2↑;(2)①碱式碳酸镁可用作化学冷却剂,原因是碱式碳酸镁分解时吸收热量,故答案为:碱式碳酸镁分解吸热;(3)②为进一步确认沉淀是否已完全,就是检验溶液中是否含有24SO-,向上层清液中继续滴加BaCl2溶液,若无白色沉淀再产生,则已经沉淀完全,故答案为:向上层清液中继续滴加BaCl2溶液,若无白色沉淀再产生,则已经沉淀完全;③n(BaSO4)=n(24SO-)=1.165g233g/mol×100mL25mL=0.0200mol,n(Mg2+)=n(EDTA)×100mL25mL=0.1000mol⋅L−1×25.00×10−3L×100mL25mL=0.01mol,n(Na2SO4)=0.0200mol−0.01mol=0.01mol,n(H2O)= 3.340g-0.01mol142g/mol-0.01mol120g/mol18g/mol⨯⨯=0.04mol,n(Na2SO4):n(MgSO4):n(H2O)=0.01mol:0.01mol:0.04mol=1:1:4,化学式为Na2SO4⋅MgSO4⋅4H2O,故答案为:Na2SO4⋅MgSO4⋅4H2O。
十二高三化学一轮考点精讲镁铝铜及其化合物一镁及其化合物1、镁的性质(1)物理性质:镁是银白色金属,质较软,密度1.74g/cm3,是轻金属,硬度小。
(2)化学性质:镁是较活泼金属①与非金属反应:2Mg + O2 == 2MgO,Mg + Cl2点燃MgCl2,3Mg + N2点燃Mg3N2等。
②与沸水反应:Mg + 2H2O(沸水)== Mg(OH)2 + H2↑.③与酸反应:与非强氧化性酸反应:是酸中的H+与Mg反应,有H2放出。
与强氧化性酸反应:如浓H2SO4、HNO3,反应比较复杂,但是没有H2放出。
④与某些盐溶液反应:如CuSO4溶液、FeCl2溶液、FeCl3溶液等。
Mg + 2FeCl3 == 2FeCl2 + MgCl2, Mg + FeCl2 == Fe + MgCl2.2、镁的提取:海水中含有大量的MgCl2,因此,工业上主要是从分离了NaCl的海水中来提取MgCl2.流程:海水中加入CaO或Ca(OH)2Mg(OH)2沉淀、过滤、洗涤沉淀,用稀HCl溶解MgCl2溶液,蒸发结晶MgCl2·6H2O晶体,在HCl气体环境中加热MgCl2固体,电解熔融的MgCl2Mg + Cl2↑。
主要反应:MgCl2 + Ca(OH)2 == Mg(OH)2↓+ CaCl2, Mg(OH)2 + 2HCl == MgCl2 + 2H2O, MgCl2·6H2O△MgCl2 + 6H2O , MgCl2(熔融) 电解Mg + Cl2↑。
3、镁的用途:镁主要是广泛用于制造合金。
制造的合金硬度和强度都较大。
因此镁合金被大量用火箭、导弹、飞机等制造业中。
4、氧化镁(MgO):白色固体,熔点高(2800℃),是优质的耐高温材料(耐火材料)。
是碱性氧化物。
MgO + H2O == Mg(OH)2, MgO + 2HCl == MgCl2 + H2O 。
注意以下几种情况的离子方程式的书写:(1)n(Mg(HCO3)2):n(NaOH)=1:4:Mg2+ + 2HCO3- + 4OH- == Mg(OH)2↓+ 2CO32- + 2H2O;(2)n(Mg(HCO3)2):n(NaOH)=1:2:Mg2+ + 2HCO3- + 2OH- == MgCO3↓+ CO32- + 2H2O;(3)n(Mg(HCO3)2):N(NaOH)=1:1:Mg2+ + HCO3- + OH- == MgCO3↓+H2O 。
第二讲 铝、镁及其重要化合物[2020备考·最新考纲]1.掌握铝的主要性质及其应用。
2.掌握铝的重要化合物的主要性质及其应用。
镁的性质Mg 是较活泼的金属,常温下能被空气中的O 2氧化,表面生成一层致密的氧化膜。
镁在纯氧中剧烈燃烧,发出耀眼的白光。
镁不易和冷水反应,但能与沸水迅速反应。
铝的物理性质注意:铝是地壳中元素含量最高的金属元素。
掌握铝的化学性质与用途(1)铝的化学性质图中标号反应的化学方程式或离子方程式:②2Al +3Cl 2=====△2AlCl 3④2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑤2Al +Fe 2O 3=====高温2Fe +Al 2O 3(铝热反应)(2)铝的制备及用途氧化铝氢氧化铝(1)物理性质白色胶状固体,不溶于水,有较强的吸附性。
(2)化学性质①Al(OH)3的电离②两性氢氧化物注意:Al(OH)3不溶于弱酸(如H 2CO 3),也不溶于弱碱(如氨水)。
③受热分解:2Al(OH)3=====△Al 2O 3+3H 2O 。
(3)制备Al(OH)3的三种方法方法一:可溶性铝盐溶液与过量氨水反应离子方程式:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
方法二:向可溶性偏铝酸盐溶液中通入过量CO 2离子方程式:AlO -2+2H 2O +CO 2===Al(OH)3↓+HCO -3。
方法三:相互促进水解法常见的铝盐(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)明矾的化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH <7(填“<”“>”或“=”)。
明矾可以净水,其净水的原理是:Al 3++3H 2OAl(OH)3(胶体)+3H +,Al(OH)3胶体吸附水中杂质形成沉淀而净水。
(3)明矾溶液与Ba(OH)2溶液反应的离子方程式①Al3+恰好完全沉淀:2Al3++3SO2-4+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。
镁和铝的化合物【知识归纳】一、镁的提取1.镁的存在:自然界中的镁主要以 化合态 的形式存在于地壳和海水中。
海水中镁的总储量约为×1015吨。
2.镁的提取从海水中提取镁,步骤如下:(1)煅烧海边贝壳(石灰石),制成石灰乳。
化学方程式:CaCO 3===CaO +CO 2↑,CaO +H 2O ===Ca(OH)2↓。
(2)将石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀。
化学方程式:MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2,该反应实质上是Mg 2+与OH -结合生成Mg(OH)2沉淀的反应,离子方程式:Mg 2++Ca(OH)2===Ca 2++Mg(OH)2↓。
(3)将氢氧化镁与盐酸反应,化学方程式:Mg(OH)2+2HCl===MgCl 2+2H 2O ,该反应实质上是Mg(OH)2与H+反应生成Mg 2+与H 2O ,离子方程式:Mg(OH)2+2H +===Mg 2++2H 2O 。
所得溶液蒸发结晶可获得六水合氯化镁晶体(MgCl 2·6H 2O),然后在氯化氢气流中加热,转化成氯化镁。
化学方程式: (4)电解熔融氯化镁制得金属镁。
化学方程式:二、镁的性质1.镁的物理性质镁是银白色的金属,密度较小 g ·cm -3),有较强的韧性、延展性、是电和热良导体。
硬度、熔点、沸点介于钠、铝之间。
2.镁的原子结构镁的原子结构示意图为 。
由其结构可知,镁原子容易失去最外层的2个电子,形成镁离子。
因此,镁是活泼的金属,在自然界中主要以化合态存在。
3.镁的化学性质镁的化学性质活泼,可与活泼非金属、酸等发生反应。
(1)镁与非金属单质反应 ①镁与氧气的反应:2Mg +O 2 2MgO 。
②镁与氯气、氮气的反应,化学方程式分别为:Mg +Cl2 MgCl2 3Mg +N2 Mg3N2。
(2)镁与酸的反应把一小段擦去氧化膜的镁条放入一定量的稀硫酸中,镁条上有气泡产生,这是因为镁与酸所电离的H +发生氧化还原反应,把H +还原成氢气。
镁、铝及其化合物的反应方程式
要求:写出化学反应方程式,是氧化还原反应的指出氧化剂、还原剂;氧化产物、还原产物;并标出电子转移的方向和数目。
是离子反应的只写出离子反应方程式。
1. 铝箔在氧气中剧烈燃烧
2. 镁条在空气中燃烧
3. 镁条、铝片分别与稀硫酸反应
4. 铝与氢氧化钠溶液反应
5. 镁条与氯化铵溶液反应
6. 铝与氯化铜溶液反应
7. 铝与三氧化二铁高温下反应(铝热反应)
8. 铝与二氧化锰高温下反应(铝热反应)
9. 镁在二氧化碳中燃烧
10. 氧化铝溶于氢氧化钠溶液
11. 氧化铝、氧化镁分别溶于盐酸溶液
12. 把氢氧化铝分别加到盐酸或氢氧化钠溶液
13. 氢氧化铝制备铝
14. 电解熔融氯化镁制取镁
15. 硫酸铝或硫酸镁溶液中分别滴加过量氨水
16. 向偏铝酸钠溶液中通入二氧化碳
17. 将硫酸铝溶液与偏铝酸钠溶液混合
18. 氯化铝溶液与氢氧化钠溶液互滴
19. 偏铝酸钠溶液与盐酸互滴。