探索性实验—不同浓度葡萄糖对小鼠缺氧耐受性的影响
- 格式:ppt
- 大小:489.50 KB
- 文档页数:86

第1篇一、实验背景缺氧是指生物体在氧气供应不足的情况下,无法满足正常生理活动所需的氧气量。
缺氧会导致细胞代谢紊乱,严重时甚至会引起细胞死亡。
为了研究缺氧对小鼠生理和生化指标的影响,我们进行了小鼠缺氧实验。
二、实验目的1. 观察缺氧对小鼠生理和行为的影响。
2. 分析缺氧对小鼠生化指标的影响。
3. 探讨缺氧的潜在机制。
三、实验方法1. 实验动物:选取健康成年雄性小鼠20只,体重约20g,随机分为两组,每组10只。
2. 缺氧模型建立:将一组小鼠放入密闭容器中,容器内氧气浓度控制在5%以下,另一组作为对照组,正常饲养。
3. 实验观察指标:(1)生理指标:观察小鼠活动能力、呼吸频率、心率等生理指标。
(2)生化指标:检测小鼠血液中的乳酸、丙酮酸、血糖、尿素氮等生化指标。
(3)组织学观察:取小鼠脑、心脏、肝脏等组织,进行组织学观察。
四、实验结果1. 生理指标:(1)缺氧组小鼠活动能力明显下降,表现为行动迟缓、反应迟钝。
(2)缺氧组小鼠呼吸频率加快,心率增加。
(3)缺氧组小鼠出现明显缺氧症状,如口唇发绀、呼吸急促等。
2. 生化指标:(1)缺氧组小鼠血液乳酸、丙酮酸含量显著升高,血糖含量降低。
(2)缺氧组小鼠血液尿素氮含量升高,表明肾脏负担加重。
3. 组织学观察:(1)缺氧组小鼠脑组织出现神经元损伤,表现为神经元肿胀、核固缩等。
(2)缺氧组小鼠心脏、肝脏组织出现细胞水肿、坏死等病理改变。
五、讨论1. 缺氧对小鼠生理和行为的影响:缺氧导致小鼠活动能力下降、呼吸频率加快、心率增加,表现为明显的缺氧症状。
这与缺氧导致细胞代谢紊乱、能量供应不足有关。
2. 缺氧对小鼠生化指标的影响:缺氧导致小鼠血液乳酸、丙酮酸含量升高,血糖含量降低,表明细胞能量代谢受到抑制。
同时,缺氧导致小鼠血液尿素氮含量升高,说明肾脏负担加重。
3. 缺氧的潜在机制:缺氧导致细胞内线粒体功能障碍,线粒体氧化磷酸化受阻,能量供应不足。
此外,缺氧还可能导致细胞内钙超载、活性氧(ROS)产生增加,进一步加重细胞损伤。
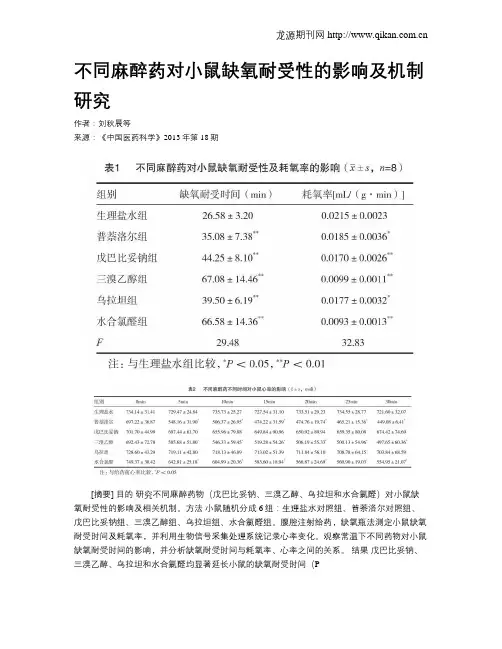
不同麻醉药对小鼠缺氧耐受性的影响及机制研究作者:刘秋晨等来源:《中国医药科学》2013年第18期[摘要] 目的研究不同麻醉药物(戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛)对小鼠缺氧耐受性的影响及相关机制。
方法小鼠随机分成6组:生理盐水对照组、普萘洛尔对照组、戊巴比妥钠组、三溴乙醇组、乌拉坦组、水合氯醛组。
腹腔注射给药,缺氧瓶法测定小鼠缺氧耐受时间及耗氧率,并利用生物信号采集处理系统记录心率变化。
观察常温下不同药物对小鼠缺氧耐受时间的影响,并分析缺氧耐受时间与耗氧率、心率之间的关系。
结果戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛均显著延长小鼠的缺氧耐受时间(P[关键词] 麻醉药;缺氧耐受性;小鼠[中图分类号] R364.4 [文献标识码] A [文章编号] 2095-0616(2013)18-29-03缺氧是常见的病理生理过程,缺氧耐受性差的器官如心、脑等,更容易发生缺血-再灌注损伤(ischemia reperfusion injury),心脑血管疾病手术特别是冠脉搭桥术和心脏移植手术等的广泛开展,均涉及缺血-再灌注过程。
近年来研究显示,麻醉药除了其麻醉效能外,还能明显减轻缺血再灌注损伤,但其机制复杂,尚不完全清楚[1-3]。
目前研究主要集中在离体细胞和单个器官上,关于麻醉药预处理对全身缺血缺氧损伤的保护作用研究很少[4]。
因此,研究麻醉药物对机体缺氧耐受性的影响具有重要临床意义,本实验拟通过不同麻醉药物对小鼠缺氧耐受性的影响及相关机制研究,以期为临床相关缺血-再灌注疾病的治疗提供理论依据,对于改善患者预后具有重要价值。
1 材料与方法1.1 动物和试剂健康成年ICR(institute of cancer research)小鼠,体重(20±2)g,购自苏州大学实验动物中心。
普萘洛尔、三溴乙醇购自美国Sigma公司;水合氯醛购自上海金山制药有限公司;戊巴比妥钠、乌拉坦购自国药集团化学试剂有限公司;钠石灰购自上海化学试剂有限公司。

\篇二:缺氧缺氧动物模型复制及中枢神经系统功能抑制和低温对缺氧的影响【摘要】目的:本实验学习复制乏氧性缺氧和血液性缺氧的动物模型方法,观察缺氧过程中呼吸的反应及血液色泽和全身一般情况的变化,并了解温度和中枢神经系统机能状态对缺氧耐受的影响以及对照实验和控制实验条件重要性。
方法:通过复制缺氧动物模型,观察不同类型缺氧过程中呼吸、黏膜和血液色泽的变化。
通过测定耗氧量和小鼠的存活时间来观察中枢神经系统机能抑制和低温对缺氧的影响。
结果:中枢神经系统功能抑制和低温对动物耐受缺氧的影响与对照组相比,存活时间和总耗氧率有显著性差异;复制不同原因造成的不同缺氧类型小鼠都表现出了不同的呼吸频率和存活时间的变化。
结论:给小鼠注射氯丙嗪、冰浴降温可显著降低总耗氧率,延长其存活时间(p<0.01)。
co中毒、亚硝酸盐可显著缩短小鼠存活时间,降低呼吸频率。
美兰可以缓解亚硝酸盐对小鼠的作用,已定程度延长小鼠存活时间,延缓呼吸频率的下降。
【关键词】缺氧氯丙嗪总耗氧率 co 亚硝酸盐美兰存活时间当供应组织的氧不足,或组织利用氧障碍时,机体的机能和代谢可发生异常变化,这种病理过程称为缺氧。
根据缺氧的原因不同可将缺氧分为低张性缺氧、血液性缺氧、循环性缺氧和组织中毒性缺氧四种类型,不同类型的缺氧,机体的代偿适应性反应和症状表现有所不同。
1.材料和方法1.1实验动物:小白鼠(雌性)。
1.2 药品:氯丙嗪(chlorpromazine) 、钠石灰(soda lime),亚硝酸钠( sodium nitrite ) 、亚甲基蓝(美蓝)(methylene blue,mb)、 0.9%nacl (physiological saline solution) 、co(carbon monoxide)。
1.3 器材:100、500ml广口瓶和测耗氧装置。
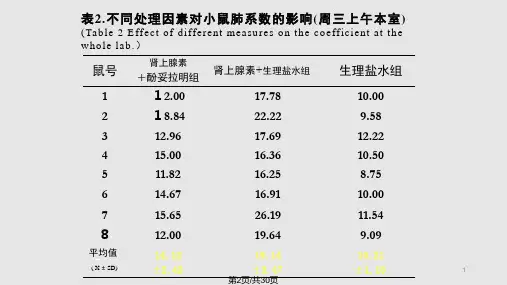
1.4 方法1.4.1 中枢神经系统功能抑制和低温对缺氧的影响取2只性别相同体重相近的小鼠,准确称取体重,并随机分为生理盐水组和氯丙嗪组。


昆明医科大学机能学实验报告实验日期:2014年10月11日带教教师:金会艳专业班级:2012级麻醉班缺氧实验一、实验目的1、复制不同病因导致小鼠缺氧的模型,了解乏氧性,血液性,组织中毒性缺氧的分类。
2、观察缺氧对呼吸系统,中枢神系统的影响,以及血液颜色变化。
3、了解影响缺氧耐受性的因素。
二、实验原理分别复制三型缺氧模型,观察缺氧对机体的影响。
三、实验仪器设备小鼠缺氧瓶(100ml-125ml带塞广口瓶),一氧化碳发生装置广口瓶,恒温水浴箱,5ml或2ml刻度吸管,1ml注射器,酒精灯,剪刀,镊子,钠石灰,甲酸,浓硫酸,5%硝酸钠,0.1%氰化钾,生理盐水。
四、实验方法与步骤1、乏氧性缺氧1取小鼠四只,标记编号(甲,乙,丙,丁)每2min记录死亡(记录时间及耗氧量,甲鼠尸体待留)计算小鼠耗氧率(r)一般情况* 2、一氧化碳中毒性缺氧(小鼠一只)观察记录如上死亡(记录时间)计算小鼠耗氧率(r)* 3、亚硝酸中毒缺氧(小鼠一只)观察记录一般状况*观察记录如上小鼠腹腔注射*5%亚硝酸钠死亡(记录时间,)2计算小鼠耗氧率(r)* 4、取出甲鼠及2,3实验小鼠尸体部分肝叶进行对比,记录颜色。
备注:(1)一般状况*,呼吸频率,精神状态,皮肤黏膜颜色。
(2)缺氧瓶*,一定要密封,可用凡士林涂在瓶塞外面,且可以加入钠石灰吸收水汽。
(3)腹腔注射,正确拿握小鼠,左下腹,45°进针,回抽。
(4)耗氧率计算:r[ml/(g·min)]=a(ml)÷w(g)÷t(min) a,耗氧量;w,体重;t,死亡时间。
五、实验结果表1.各型缺氧对机体的影响3表2.影响机体缺氧耐受性的因素(乏氧性缺氧) 4注:从左至右依次为,亚硝酸钠中毒,乏氧性缺氧,一氧化碳中毒。
5篇三:小鼠缺氧模型及其分析课程名称:机能实验学教研室:病理生理学教研室任课教师:张彩华授课章节:缺氧与普鲁卡因对神经干的作用授课专业和年级:2005级医疗授课学时:8学时授课时间:2007年3-7月实验题目:缺氧实验目的:1.观察原因和条件在疾病发生发展中的作用2.复制几种类型缺氧的模型,观察血液颜色的特点,分析其机制根据大纲要求:掌握概念:缺氧、低张性缺氧、血液性缺氧、循环性缺氧和组织性缺氧,紫绀、肠源性紫绀。

影响小白鼠缺氧耐受性的因素三、影响缺氧耐受性的因素:年龄、机体的机能状态、营养、锻炼、环境温度等许多因素都可影响机体对缺氧的耐受性,这些因素可以归纳为两点,即代谢耗氧率与机能的代偿能力。
(一)、代谢耗氧率:基础代谢高、增加机体耗氧率,对缺氧耐受性低。
如:发热、机体过热、或甲状腺机能亢进、环境温度等。
基础代谢低、降低机体耗氧率,对缺氧耐受性高。
如:体温降低、CNS抑制,低温麻醉等可用于心脏外科手术,以延长手术所必需阻断血流的时间。
(二)、机体的代偿能力:1、机体轻度缺氧、慢性缺氧通过呼吸、循环和血液系统的代偿性反应能增加组织的供氧。
通过组织细胞的代偿性反应能提高利用氧的能力。
2、心、肺疾病及血液病者对缺氧耐受性低,老年人因为肺和心脏的功能储备降低、骨髓的造血干细胞减少、外周血液红细胞数减少,以及细胞某些呼吸酶活性降低等原因,均可导致对缺氧的适应能力下降。
3、代偿能力是可以通过锻炼提高的。
轻度的缺氧刺激可调动机体的代偿能力。
如登高山者采取缓慢的队梯性的上升要比快速上升者能更好地适应。
慢性贫血的病人血红蛋白即使很低仍能维持正常活动,而急性失血使血红蛋白减少到同等程度就可能引起严重的代谢机能障碍。
选定影响缺氧耐受性的因素一到两个,根据我们刚才讲的科研设计的基本原则,首先自己设计实验,包括实验的具体操作步骤、实验结果表格设计等等。
经老师检查后,再动手完成实验。
四、实验讲解(一)、实验目的:复制低张性缺氧的动物模型,观察低张性缺氧的表现。
设计实验,探讨缺氧耐受性的影响因素。
通过实验掌握基本科研设计原则。
(二)、实验动物:周龄鼠、成年鼠、老年鼠(三)、实验器材与药品小白鼠缺氧瓶、测耗氧量装置、测缺氧瓶内空气容积装置测耗氧量装置原理:小白鼠在密闭的缺氧瓶内不断的消耗氧气,而产生CO2。

第1篇一、实验背景缺氧是人体在氧气供应不足的情况下产生的一系列生理和病理变化。
了解缺氧的类型、机制及其对人体的影响,对于预防和治疗相关疾病具有重要意义。
本实验旨在创新性地研究缺氧对小鼠的影响,并通过模拟不同缺氧环境,探究缺氧对小鼠生理指标的影响。
二、实验目的1. 模拟不同缺氧环境,观察缺氧对小鼠生理指标的影响。
2. 分析缺氧对不同类型缺氧的耐受性。
3. 探究缺氧对小鼠组织器官的影响。
三、实验材料1. 实验动物:昆明种小白鼠,体重20克左右,共40只。
2. 实验设备:缺氧箱、呼吸频率监测仪、心电图仪、血氧饱和度仪、显微镜等。
3. 实验试剂:NaOH、NaCl、Na2CO3、CO2、H2O2等。
四、实验方法1. 将40只小白鼠随机分为四组,每组10只,分别为对照组、低氧组、CO中毒组、H2O2中毒组。
2. 对照组:正常饲养,作为正常生理指标参考。
3. 低氧组:将小白鼠置于缺氧箱中,模拟海拔3000米的高原环境,观察并记录生理指标变化。
4. CO中毒组:将小白鼠置于CO浓度浓度为1000ppm的环境中,观察并记录生理指标变化。
5. H2O2中毒组:将小白鼠置于H2O2浓度浓度为1000ppm的环境中,观察并记录生理指标变化。
6. 在实验过程中,定期监测并记录各组小鼠的呼吸频率、心率、血氧饱和度、心电图等生理指标。
7. 实验结束后,取小鼠组织器官,进行显微镜观察,分析缺氧对组织器官的影响。
五、实验结果1. 低氧组小鼠的呼吸频率、心率、血氧饱和度等生理指标明显低于对照组,且随缺氧时间延长,生理指标下降趋势更加明显。
2. CO中毒组小鼠的呼吸频率、心率、血氧饱和度等生理指标明显低于对照组,且出现呼吸困难、皮肤发绀等症状。
3. H2O2中毒组小鼠的呼吸频率、心率、血氧饱和度等生理指标明显低于对照组,且出现咳嗽、呼吸困难等症状。
4. 显微镜观察结果显示,缺氧对小鼠的心脏、肝脏、肾脏等组织器官造成不同程度损伤。
六、讨论与分析1. 本实验通过模拟不同缺氧环境,观察缺氧对小鼠生理指标的影响,发现缺氧对小鼠的呼吸系统、循环系统、神经系统等造成严重影响。

第1篇一、实验目的1. 研究缺氧对小鼠的影响,了解缺氧的表现和生理机制。
2. 掌握缺氧解救的方法和技巧,提高动物实验操作技能。
3. 分析影响缺氧耐受性的因素,为临床应用提供理论依据。
二、实验原理缺氧是指动物体内氧气供应不足,导致组织细胞无法进行正常的有氧代谢,产生一系列生理和生化反应。
本实验通过复制不同类型的缺氧模型,观察缺氧对小鼠的影响,探讨缺氧解救的方法。
三、实验材料1. 实验动物:昆明小白鼠20只,体重20-25克。
2. 实验器材:缺氧瓶、一氧化碳发生装置、恒温水浴箱、注射器、剪刀、镊子、钠石灰、甲酸、浓硫酸、生理盐水等。
四、实验方法1. 乏氧性缺氧实验(1)将小鼠随机分为5组,每组4只。
(2)将甲、乙、丙、丁组小鼠分别放入装有5g钠石灰的缺氧瓶中,密封瓶口。
(3)观察并记录小鼠的呼吸频率、活动状态、死亡时间等指标。
2. 一氧化碳中毒性缺氧实验(1)将小鼠随机分为5组,每组4只。
(2)将甲、乙、丙、丁组小鼠分别放入装有10%一氧化碳气体的缺氧瓶中,密封瓶口。
(3)观察并记录小鼠的呼吸频率、活动状态、死亡时间等指标。
3. 缺氧解救实验(1)将小鼠随机分为5组,每组4只。
(2)将甲、乙、丙、丁组小鼠分别放入装有5g钠石灰的缺氧瓶中,密封瓶口。
(3)观察并记录小鼠的呼吸频率、活动状态、死亡时间等指标。
(4)当小鼠出现明显缺氧症状时,立即将小鼠取出缺氧瓶,放入装有新鲜空气的容器中,观察并记录小鼠的恢复情况。
五、实验结果与分析1. 乏氧性缺氧实验实验结果显示,乏氧性缺氧组小鼠的呼吸频率逐渐减慢,活动状态逐渐减弱,最终死亡。
死亡时间与缺氧瓶的密闭性、小鼠个体差异、钠石灰等因素有关。
2. 一氧化碳中毒性缺氧实验实验结果显示,一氧化碳中毒性缺氧组小鼠的呼吸频率逐渐减慢,活动状态逐渐减弱,最终死亡。
死亡时间与一氧化碳浓度、小鼠个体差异、缺氧瓶的密闭性等因素有关。
3. 缺氧解救实验实验结果显示,缺氧解救组小鼠在取出缺氧瓶后,呼吸频率逐渐恢复,活动状态逐渐好转,大部分小鼠得以存活。

ISSN1007—3949ChinJArterioscler,Vol16,No2,2008r/min、20℃离心5rain,重悬细胞。
将收集到的所有细胞悬液用200目不锈钢滤网过滤,再离心,以含10%胎牛血清的DMEM/F12培养基重悬细胞,采用差速贴壁法以l×109/L接种于培养皿中,37℃、5%Co:培养2h,去除先贴壁的非心肌细胞,把含有心肌细胞的细胞悬液重新调整细胞浓度至5X10S/L,“.移入新的培养瓶及盛有多聚赖氨酸包被盖玻片的培养皿中,培养3d,待鉴定及进一步实验使用。
采用抗a—aclin抗体免疫组化染色鉴定心肌细胞。
1.3高葡萄糖及缺氧培养培养3天的心肌细胞换含10%胎牛血清的低糖型DMEM(含5.5mmol/L葡萄糖)培养12h达到起始条件等同。
换葡萄糖浓度5.5n缸nol/L、33rrmol/L的DMEM,分别在正常氧(21%02,5%C02,37℃)及氯化钴模拟缺氧(氯化钴浓度200pxnmol/L)条件下培养24h。
1.4台盼兰染色检测细胞存活力参照文献[4],细胞在含0.4%台盼兰的培养基中孵育3min,用95%乙醇固定8min,光镜下观察,据死细胞胞质兰染,活细胞不着色,随机选择5—6个视野,计数200个细胞,计算细胞存活率。
1.5细胞凋亡检测末端脱氧核苷酸转移酶介导的dUTP切口末端标记技术(terminaldeoxynucleotidyltransferasebiotin-dUTPnickendlabe】ing,TUNEL)检测细胞凋亡:细胞爬片以4%多聚甲醛室温固定lh,PBS洗3次,3%H202.甲醇室温10min,灭活内源性过氧化物酶,PBS洗3次。
0.1%TritonX—100冰上2min细胞打孔,PBS洗3次,加50止反应混合物,盖盖玻片,湿盒37℃避光孵育60rain,阳性对照加反应混合物孵育前用1000ku/L的DNaseI处理。
阴性对照片只加反应混合物中的LabelSolution进行孵育。

比较不同机体代谢状况对缺氧耐受性影响的实验研究目的:比较不同机体代谢状况对缺氧耐受性影响的实验研究方法:通过构建小鼠低张缺氧模型,分别观察咖啡因和氯丙嗪注射的小鼠的死亡时间实验原理:机体对缺氧的耐受性,除受缺氧程度、缺氧发生速度、缺氧持续时间以及缺氧类型的影响外,还与诸如年龄、性别、种属、机体的代谢状况、组织代谢特点、组织代谢耗氧率及适应性锻炼等因索有关。
本研究通过复制不同代谢状态的动物模型,观察机体对缺氧耐受性的影响及其影响因素。
咖啡因为中枢兴奋剂,注射后可使中枢神经系统兴奋,兴奋大脑皮层的作用尤为突出。
表现机体反应性增强,思维活跃,呼吸加深加快,心率加快,心肌收缩力加强,心输出量增多,致使机体处于高代谢状态。
氯丙嗪为中枢多巴胺受体的阻断剂,具有抗精神病、镇吐、能增强催眠、麻醉、镇静作用、阻断外周α-肾上腺素受体,抑制体温调节中枢,使体温调节失灵,体温可随外环境变化而变化。
用较大剂量氯丙嗪时,置患者于冷环境中(如冰袋或用冰水浴),可出现镇静、嗜睡、体温降低至正常以下(如34℃或更低)、基础代谢降低、器官功能活动减少、耗氧量减低而呈“人工冬眠”。
注射后可诱导睡眠,抑制机体产热,增加散热,降低机体体温,抑制心脏和血管运动中枢,使器官活动减弱,机体对刺激的反应性降低,从而降低基础代谢率,使机体处于低代谢状态。
1 实验材料器材:200ml中间能隔开动物的长玻璃筒、1ml注射器、剪刀、镊子。
药品:生理盐水,0.25%氯丙嗪,1%咖啡因动物:小白鼠2 实验过程1)取体重年龄相近同性别的小白鼠6只,称重,标记2)实验小鼠分组情况:○1实验组I:1和2号小鼠分别腹腔注射10 ml·K g-1的咖啡因和氯丙嗪,然后分别放到两个长玻璃筒中;○2实验组II:3和4号小鼠分别腹腔注射10 ml·K g-1的咖啡因和等量生理盐水,然后分别放到两个长玻璃筒中;○3实验组III:5和6号小鼠分别腹腔注射10 ml·K g-1的氯丙嗪和等量生理盐水,然后分别放到两个长玻璃筒中;3)待玻璃筒中两只实验小鼠出现兴奋或抑制状态时,正常小鼠恢复安静状态,将玻璃筒封闭4)每隔两分钟观察小鼠的呼吸次数和呼吸频率,观察小鼠死亡时间3 实验结果3.实验结果1 2 3 4 5组别编号重量(g ) 注射量(ml ) 注射时间封闭时间初始状态濒死状态 死亡时间存活时间(分) 死亡状态兴奋状态 呼吸频率兴奋状态 呼吸频率 I1 15.4 0.15 15:02 15:07 兴奋 加深加快剧烈抽搐 变浅加快 15:26 19僵直215.0 0.15 15:02 15:07半睡眠正常轻微抽搐 腹式呼吸 变深变慢 15:45 38 正常II3 15.3 0.15 15:47 15:55 兴奋加深加快剧烈抽搐 变浅加快 16:17 22 僵直 414.80.1515:47 15:55 正常 正常抽搐变浅加快 16:2631正常III5 15.8 0.15 16:28 16:35半睡眠正常变浅加快腹式呼吸 变深变慢 17:17 42 正常6 15.3 0.15 16:28 16:35 正常 正常 抽搐 变浅加快17:08 33 正常6讨论氧是生命活动所必须的重要物质之一,当组织得不到充分的氧或组织利用氧发生障碍时,组织器官的机能、代谢,甚至形态结构将发生异常变化,严重时可导致机体死亡。
不同浓度葡萄糖对MG63细胞株TRAIL表达的影响【关键词】葡萄糖Effects of different concentrations of glucose on expression of TRAIL in MG63 cells【Abstract】 AIM: To observe the regulative effects of different concentrations of glucose on the expressions of tumor necrosis factorrelated apoptosisinducing ligand(TRAIL),osteoprotegerin(OPG),and the ligand of osteoprotegerin(OPGL) in osteosarcoma MG63 cells,and to study the role of nonphysiological concentration of glucose in pathogenesis of diabetic osteoporosis. METHODS: MG63 cells were incubated with glucose at the concentration of 5.5, 16.7, 33.3 mmol/L for 24 h respectively.The expressions of TRAIL, OPG and OPGL mRNA were examined by reverse transcriptase(RT)PCR.Expression and distribution of TRAIL in MG63 cells were investigated by immunohistochemical method. RESULTS: The mRNA expressions of TRAIL and OPGL in MG63 cells increased in the order of control group, 5.5, 16.7, 33.3 mmol/L glucose groups (P<0.05),and the expression of OPG mRNA decreased in the same order (P<0.05).TRAIL mRNA level in 33.3 mmol/L group was significantly higher than that in control group[(1.004±0.070) vs (0.740±0.023),P<0.05], and the intensity of immunostaining for TRAIL was stronger than that in control group. CONCLUSION: High concentration of glucose could lead to the increasing expression of some boneresorbing cytokines such as TRAIL and OPGL in osteoblasts but the decreasing expression of OPG, which may be one of the key pathogenetic factors of diabetic osteoporosis.【Keywords】 glucose; MG63 cell; tumor necrosis factorrelated apoptosisinducing ligand【摘要】目的:观察不同浓度葡萄糖环境下人成骨肉瘤MG63细胞株肿瘤坏死因子相关凋亡诱导配体(TRAIL)及其护骨素(OPG)、护骨素配体(OPGL)的表达,探讨糖尿病骨质疏松症的发病机制. 方法:用不同浓度葡萄糖(5.5,16.7, 33.3 mmol/L)分别刺激培养的MG63细胞24 h, RTPCR法检测TRAIL,OPG, OPGL mRNA的表达,免疫组织化学法检测MG63细胞中TRAIL的表达及分布. 结果:葡萄糖对MG63细胞中TRAIL, OPGL mRNA的表达,均按照对照组、5.5 mmol/L组、16.7 mmol/L组、33.3 mmol/L组顺序递增(P<0.05),OPG mRNA的表达按照此顺序递减(P<0.05). 33.3 mmol/L组TRAIL mRNA的水平明显高于对照组[(1.004±0.070) vs (0.740±0.023), P<0.05], TRAIL免疫反应阳性物质密度也明显高于对照组. 结论:高糖环境可能导致成骨细胞中TRAIL和OPGL 表达增多,OPG的表达减少,这可能是糖尿病骨质疏松症的重要发病机制之一.【关键词】葡萄糖;MG63细胞;肿瘤坏死因子相关凋亡诱导配体0引言糖尿病易并发骨质疏松症已被公认,糖尿病对骨代谢的影响主要表现为骨吸收增加,骨形成减少与缓慢,使骨矿物质含量减少和骨质疏松[1]. 确切的细胞机制尚未阐明. 肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factorrelated apoptosisinducing ligand, TRAIL)是新发现的肿瘤坏死因子超家族的成员,可表达于人体的许多组织,对许多肿瘤来源的细胞具有很强的杀伤作用[2-3],可介导病毒引起的凋亡[4-5],并在一些自身免疫疾病中起作用[6]. 但在糖尿病骨质疏松发病中是否起作用,目前少见报道. 我们观察不同浓度葡萄糖环境下具有人成骨细胞表型特征的MG63细胞株中TRAIL及其护骨素(osteoprotegerin, OPG)、护骨素配体(osteoprotegerin ligand, OPGL)的表达情况,进一步探讨糖尿病骨质疏松症的发病机制.1材料和方法1.1材料第106代MG63细胞株由中南大学湘雅二医院代谢内分泌研究所惠赠;MEM培养液(Sigma公司);胎牛血清(杭州四季青生物工程材料研究所);牛血清白蛋白、Trizol试剂盒(Gibco公司);逆转录反应试剂盒(Promega公司);PCR扩增试剂盒和DNA梯度Marker(TaKaRa公司);引物由北京三博远志公司合成. 鼠抗人TRAIL mAb(本校免疫学教研室);生物素标记的羊抗鼠IgG抗体(宝泰克公司);ABC复合物(华美生物工程公司);DAB(Sigma公司).1.2方法1.2.1细胞培养将第106代MG63细胞株以5×108/L密度接种于培养瓶或制成单细胞悬液接种于预先放置4张7 mm×22 mm盖玻片的培养皿中,用含100 mL/L胎牛血清、50 mg/L维生素C的无酚红MEM培养液,于37 ℃, 50 mL/L CO2条件下培养,2 d 换液1次.1.2.2干预试验接种于50 mL细胞培养瓶的MG63细胞达60%~70% 汇片,行细胞爬片的MG63细胞贴壁后即分别换含1 g/L牛血清白蛋白的无血清MEM培养液培养3 h,再分别用含不同浓度葡萄糖的MEM培养液干预,分为4组:培养基对照组;5.5 mmol/L组;16.7 mmol/L组;33.3 mmol/L组. 干预24 h后,抽提细胞总RNA行RTPCR操作及免疫组化检测. 以上各组实验均独立重复5次.1.2.3RTPCRTrizol抽提MG63细胞总RNA. 取2 μg总RNA,用逆转录试剂盒合成cDNA,再取1 μL cDNA行PCR扩增OPG, OPGL, TRAIL基因,以βactin 基因为内对照. OPG上游引物:5′AGTGGGAGCAGAAGACATTG3′,下游引物:5′ATTGGACCTGGTTACCTATC3′,扩增长度为268 bp;OPGL上游引物:5′GCGTCGCCCTGTTCTTCTAT3′,下游引物:5′TTGGTGCTTCCTCCTTTCAT3′,扩增长度为598 bp;TRAIL上游引物:5′GGCATTCATTCCTGAGCAACTT3′,下游引物:5′GATCTCGTGATCTACCCACCTT3′,扩增长度为908 bp. 反应体系为25 μL,双蒸水18 μL,10×Buffer 2.5 μL, Taq酶0.5 μL,上游引物各2 μL,下游引物各2 μL,模板1 μL. OPG反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火15 s,72 ℃延伸30 s,共30个循环,最后延伸10 min. OPGL反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火15 s,72 ℃延伸40 s,共30个循环,最后延伸10 min. TRAIL反应条件:94 ℃预变性3 min,94 ℃变性30 s,57 ℃退火15 s,72 ℃延伸60 s,共30个循环,最后延伸10 min. 分别取10 μL PCR扩增产物于含0.5 mmol/L溴化乙锭的20 g/L琼脂糖凝胶电泳并拍照,并用凝胶成像分析系统行条带光密度定量检测,测值与βactin光密度值比较,比值表示各指标的mRNA表达量.1.2.4免疫组化细胞爬片利用ABC技术进行免疫组化染色,按免疫组化ABC试剂盒说明书所示步骤染色. 采用OLYMPUS BH2光学显微镜观察并摄片,以正常羊血清及PBS代替一抗染色,作为阴性和空白对照.统计学处理:用SPSS13.0软件包统计分析. 方差齐性时数据用x±s表示,组间比较用单因素方差分析,组间两两比较用LSDt检验,方差不齐时数据用中位数(四分位数间距)[M(QR)]表示,采用秩和检验,组间两两比较用Nemenyi 法检验.2结果2.1葡萄糖对MG63细胞TRAIL和OPG mRNA表达的影响RTPCR半定量结果显示,葡萄糖能上调 MG63细胞中TRAIL mRNA的表达. 16.7 mmol/L的葡萄糖即可出现上调作用,并在33.3 mmol/L时上调作用更明显. 高葡萄糖能下调MG63细胞中OPG mRNA的表达,与对照组和5.5 mmol/L葡萄糖组相比,16.7 mmol/L的葡萄糖即可降低OPG mRNA表达,并在33.3 mmol/L时下调作用更明显(表1,图1). 另一方面,相同浓度的葡萄糖能上调MG63细胞中OPGL mRNA的表达,按照对照组、5.5 mmol/L组, 16.7 mmol/L组, 33.3 mmol/L组的顺序,OPGL mRNA的A 值的M(QR)分别为0.107 (0.008), 0.114(0.015), 0.206 (0.040), 0.234 (0.037),经检验,33.3 mmol/L组的OPGL mRNA表达明显高于对照组(P<0.05,图1).表1不同浓度葡萄糖对MG63细胞TRAIL,OPG及OPGL mRNA表达的影响(略)aP<0.05 vs对照; cP<0.05 vs 5.5 mmol/L; eP<0.05 vs 16.7 mmol/L.2.2葡萄糖对MG63细胞TRAIL免疫组织化学染色的影响TRAIL免疫反应阳性细胞多数呈梭形,少数呈不规则形. 阳性物质呈棕黄色颗粒,位于胞质内,胞核阴性. 在培养基对照组及5.5 mmol/L组中,TRAIL免疫反应产物呈阴性或弱阳性. 在高浓度葡萄糖组中,TRAIL免疫反应阳性物质密度明显增高(图2).1:对照组;2: 5.5 mmol/L组;3:16.7 mmol/L组;4:33.3 mmol/L 组.图1不同浓度葡萄糖对MG63细胞TRAIL,OPG及OPGLmRNA表达的影响(略)A:对照组;B: 5.5 mmol/L组;C: 16.7 mmol/L组;D: 33.3 mmol/L组.图2不同浓度葡萄糖对MG63细胞TRAIL免疫反应产物的影响SABC ×200(略)3讨论糖尿病易并发骨质疏松症已被公认,且动物实验表明在糖尿病大鼠病程早期即表现为成骨细胞数下降、破骨细胞数上升,说明骨形成减少,骨吸收相对大于骨形成[7]. 但其确切的细胞机制尚未阐明.TRAIL是新发现的肿瘤坏死因子超家族的凋亡分子,可能与多种受体结合,发挥诱导或抗凋亡作用. TRAIL有5个受体:死亡受体(DR4, DR5)、诱骗受体(DcR1, DcR2)和分泌型受体OPG. TRAIL与DR4,DR5相互作用,诱导许多组织来源的肿瘤细胞株迅速凋亡,但不能诱导正常细胞凋亡. TRAIL的两个诱骗受体DcR1缺乏死亡功能区,DcR2只含有死亡功能区的1/3,因而不能介导凋亡,但是可以抑制DR4,DR5介导的凋亡[8]. OPG是一个分泌型的TNF受体,是骨代谢的一个重要的负调控因子,能抑制破骨细胞生成、活化,减少骨吸收[9-11],增加骨密度的作用. 它主要通过中和性结合OPGL发挥骨保护作用,后者是诱导破骨细胞生成的关键性细胞因子,通过作用于破骨细胞上的受体RANK,刺激破骨细胞形成、分化及活化,增强骨吸收. OPG竞争性结合OPGL,阻断OPGL与其靶信号受体RANK的结合,抑制OPGL/RANK对破骨细胞信号转导的活化,减少破骨细胞生成,发挥抗骨质疏松作用. OPG还能通过与TRAIL的竞争性结合,抑制TRAIL和死亡受体结合,来抑制TRAIL诱导细胞凋亡的作用. 反之,TRAIL可结合OPG,并相互中和对方的功能[9],即可间接解除OPG对OPGL的结合,抑制它的抑制破骨细胞的发生和增加骨密度的作用. 可见OPG和TRAIL是相互抑制的.我们从基因水平观察了不同浓度葡萄糖对MG63细胞株中OPG,OPGL表达的影响,发现高糖能使OPGLmRNA表达增加,呈剂量依赖性. 高糖同时能抑制MG63细胞中OPG mRNA的表达,使细胞内OPG/OPGL比率降低. 提示高糖对成骨细胞中OPG/OPGL水平的调节,可能是糖尿病导致骨质疏松症的机制之一. 我们从基因及免疫组化的角度,还观察到了不同浓度葡萄糖对MG63细胞株TRAIL表达的影响,发现随着葡萄糖浓度的升高,TRAIL mRNA表达增多. TRAIL分布于胞质内,高糖环境可导致TRAIL免疫反应阳性物质明显增多. TRAIL是与细胞凋亡有关的细胞因子,这提示了高浓度的葡萄糖可能是通过TRAIL以自分泌或旁分泌的形式介导成骨细胞的凋亡,从而调节成骨细胞的数量,导致骨形成减少、骨质疏松的发生. 另一方面,高糖环境下TRAIL表达的增多,可竞争性结合OPG,阻断后者对OPGL的结合,促进了破骨细胞数目的增多及分化成熟.参考文献[1]廖二元,超楚生,伍汉文. 内分泌学[M]. 北京:人民卫生出版社,2001:1818-1819.[2] Morrison B, Tang Z, Jacobs B, et al. Apo2L/TRAIL induction and nuclear translocation of inositol hexakisphosphate kinase 2 during IFNβinduced apoptosis in o varian carcinoma[J]. Biochem J,2005,385(Pt 2):595-603.[3]成诗银,张惠中,陈剑秋,等.肿瘤细胞内特异表达TRAIL载体的构建及其在喉癌细胞株Hepa2中的表达[J]. 第四军医大学学报,2005,26(12):1108-1111.[4] Matsuda T, Almasan A, Tomita M, et al. Resistance to Apo2 Ligand (Apo2L)/Tumor Necrosis FactorRelated ApoptosisInducing Ligand (TRAIL)Mediated Apoptosis and Constitutive Expression ofApo2L/TRAIL in Human TCell Leukemia Virus Type 1Infected TCell Lines [J]. J Virol, 2005,79(3):1367-1378.[5] Ishikawa E, Nakazawa M, Yoshinari M, et al. Role of Tumor Necrosis FactorRelated ApoptosisInducing Ligand in Immune Response to Influenza Virus Infection in Mice[J]. J Virol, 2005,79(12):7658-7663.[6]付建芳,姬秋和,黄威权,等. 桥本甲状腺炎中TRAIL及其死亡受体DR4,DR5的表达[J].第四军医大学学报,2002,23(10):920-923.[7] Naoshi O, Daichi C, Naoto K, et al. Insulin receptor substrate1 in osteoblast is indispensable for maintaining bone turnover [J]. J Clin Invest, 2000,105(7): 935-943.[8] Sanlioglu AD, Dirice E, Aydin C, et al. Surface TRAIL decoy receptor4 expression is correlated with TRAIL resistance in MCF7 breast cancer cells [J]. BMC Cancer, 2005,5:54.[9] Pritzker LB, Scatena M, Giachelli CM.The Role of Osteoprotegerin and Tumor Necrosis Factorrelated Apoptosisinducing Ligand in Human Microvascular Endothelial Cell Survival [J]. Mol Biol cell, 2004,15(6):2834-2841.[10] Bell NH. RANK ligand and the regulation of skeletal remodeling [J]. J Clin Invest, 2003,111(8):1120-1122.[11] Hofbauer LC, Khosla S, Dunstan CR, et al. The roles of osteoprotegerin and osteoprotegerin ligand in the paracrine regulation of bone resorption [J]. J Bone Miner Res, 2000,15:2-12.。
比较不同机体代谢状况对缺氧耐受性影响的实验研究目的:比较不同机体代谢状况对缺氧耐受性影响的实验研究方法:通过构建小鼠低张缺氧模型,分别观察咖啡因和氯丙嗪注射的小鼠的死亡时间实验原理:机体对缺氧的耐受性,除受缺氧程度、缺氧发生速度、缺氧持续时间以及缺氧类型的影响外,还与诸如年龄、性别、种属、机体的代谢状况、组织代谢特点、组织代谢耗氧率及适应性锻炼等因索有关。
本研究通过复制不同代谢状态的动物模型,观察机体对缺氧耐受性的影响及其影响因素。
咖啡因为中枢兴奋剂,注射后可使中枢神经系统兴奋,兴奋大脑皮层的作用尤为突出。
表现机体反应性增强,思维活跃,呼吸加深加快,心率加快,心肌收缩力加强,心输出量增多,致使机体处于高代谢状态。
氯丙嗪为中枢多巴胺受体的阻断剂,具有抗精神病、镇吐、能增强催眠、麻醉、镇静作用、阻断外周α-肾上腺素受体,抑制体温调节中枢,使体温调节失灵,体温可随外环境变化而变化。
用较大剂量氯丙嗪时,置患者于冷环境中(如冰袋或用冰水浴),可出现镇静、嗜睡、体温降低至正常以下(如34℃或更低)、基础代谢降低、器官功能活动减少、耗氧量减低而呈“人工冬眠”。
注射后可诱导睡眠,抑制机体产热,增加散热,降低机体体温,抑制心脏和血管运动中枢,使器官活动减弱,机体对刺激的反应性降低,从而降低基础代谢率,使机体处于低代谢状态。
1 实验材料器材:200ml中间能隔开动物的长玻璃筒、1ml注射器、剪刀、镊子。
药品:生理盐水,0.25%氯丙嗪,1%咖啡因动物:小白鼠2 实验过程1)取体重年龄相近同性别的小白鼠6只,称重,标记2)实验小鼠分组情况:○1实验组I:1和2号小鼠分别腹腔注射10 ml·K g-1的咖啡因和氯丙嗪,然后分别放到两个长玻璃筒中;○2实验组II:3和4号小鼠分别腹腔注射10 ml·K g-1的咖啡因和等量生理盐水,然后分别放到两个长玻璃筒中;○3实验组III:5和6号小鼠分别腹腔注射10 ml·K g-1的氯丙嗪和等量生理盐水,然后分别放到两个长玻璃筒中;3)待玻璃筒中两只实验小鼠出现兴奋或抑制状态时,正常小鼠恢复安静状态,将玻璃筒封闭4)每隔两分钟观察小鼠的呼吸次数和呼吸频率,观察小鼠死亡时间3 实验结果3.实验结果1 2 3 4 56讨论氧是生命活动所必须的重要物质之一,当组织得不到充分的氧或组织利用氧发生障碍时,组织器官的机能、代谢,甚至形态结构将发生异常变化,严重时可导致机体死亡。
小鼠缺氧耐受性影响因素的探讨[实验目的](1)通过复制乏氧性、血液性缺氧,了解缺氧的分类。
(2)观察不同类型缺氧时,呼吸和血液颜色的变化。
(3)了解条件因素在缺氧发病中的重要性和临床冬眠和低温治疗的实用意义。
[实验动物、药品与器材]1%咖啡因,0.25%氯丙嗪,生理盐水,钠石灰,碎冰块,无氧水(用时临时配制);小鼠缺氧瓶和测耗氧量装置,1ml、5ml注射器,粗天平,1000ml烧杯[观察指标]动物一般状况,呼吸,存活时间,口唇、血液(肝)颜色[实验原理]机体对缺氧的耐受性除受缺氧程度和发生速度影响外,还与其他许多因素有关。
本实验①通过给予小白鼠中枢兴奋剂和抑制剂,改变中枢神经系统的功能代谢状态,观测动物的代谢耗氧量及存活时间,并通过计算代谢耗氧率,探讨中枢神经系统功能状况不同对缺氧耐受性的影响。
②通过改变小白鼠所处的环境温度,观测高温与低温情况下小白鼠的代谢耗氧量和存活时间,并通过计算代谢耗氧率,探讨温度对缺氧耐受性的影响。
③通过增加环境中CO2浓度,观测小白鼠在高浓度CO2情况下的代谢耗氧量和存活时间,计算代谢耗氧率以探讨环境中CO2浓度对小白鼠缺氧耐受性的影响。
④通过三次预缺氧实验,检测同样指标,观察预适应对缺氧耐受性的影响。
[实验步骤与观察指标]1.机体状况对缺氧耐受性的影响。
⑴取小白鼠3只,分别作如下处理:甲鼠,腹腔注射1%咖啡因10ml/kg;乙鼠,腹腔注射0.25%氯丙嗪10m1/kg,待动物安静后;丙鼠,腹腔注射生理盐水10ml /kg。
⑵约15~20min后,将3只小白鼠分别放入盛有钠石灰的缺氧瓶中(瓶中钠石灰大约5g),观察动物一般表现(呼吸,唇色,活动等),密闭后开始计时。
⑶持续观察各鼠在瓶中的活动情况,待小鼠死亡后,准确计算存活时间(t)。
⑷用测耗氧量装置测量小鼠的耗氧量(见附录及图示)。
按下公式计算小白鼠的耗氧率(R):耗氧率[ml/(g.min)]=耗氧量/体重(g)/存活时间2.环境温度对缺氧耐受性的影响。
葡萄糖对神经干细胞缺氧性损伤保护作用的实验研究赵舒武;高英茂;汪涛;王晓玲;魏斌【摘要】目的探讨葡萄糖对神经干细胞缺氧性损伤的保护作用.方法分离培养小鼠胚胎11.5d神经干细胞.将三气培养箱的氧气浓度调至5%,以制备缺氧环境.分别在缺氧前后于无血清培养基中加入不同剂量的葡萄糖,同时设常氧常糖正常对照.通过计数克隆形成率和MTT法检测干细胞的存活和增殖情况,Annexin Ⅴ-FITC/PI 染色、激光扫描共聚焦显微镜观察和计算其凋亡率.结果缺氧前加入30mmol/L葡萄糖,神经干细胞的存活率和增殖率较常糖缺氧组明显增高,但仍低于常糖常氧正常对照组.缺氧后再加入葡萄糖时,其保护作用不明显.结论缺氧前给予足够浓度的葡萄糖对神经干细胞的缺氧性损伤具有一定的保护作用.【期刊名称】《中国组织化学与细胞化学杂志》【年(卷),期】2010(019)002【总页数】4页(P156-159)【关键词】葡萄糖;神经干细胞;缺氧【作者】赵舒武;高英茂;汪涛;王晓玲;魏斌【作者单位】天津中医药大学基础学院组织胚胎学教研室,天津,300193;山东大学医学院组织胚胎学教研室,济南,250012;天津中医药大学基础学院组织胚胎学教研室,天津,300193;天津中医药大学基础学院组织胚胎学教研室,天津,300193;山东大学医学院组织胚胎学教研室,济南,250012【正文语种】中文【中图分类】R329.2缺氧缺血性脑损伤是严重危害人类健康、影响生活质量的常见病和多发病。
对缺氧缺血性脑损伤的研究是多年来神经科学中的一个研究热点和难点,对该病的治疗至今仍无重大突破。
近年来葡萄糖在缺氧缺血性脑损伤中的作用日益受到关注。
葡萄糖对神经组织的营养和保护作用已为人们所熟知,但对神经干细胞缺氧性损伤有无保护作用尚未见报道。
本实验利用体外培养的神经干细胞作为细胞模型,在缺氧前后加入不同浓度的葡萄糖,观察神经干细胞的存活、增殖、凋亡及分化情况,以探讨葡萄糖对神经干细胞缺氧损伤的保护作用。
不同麻醉药对小鼠缺氧耐受性的影响及机制研究目的研究不同麻醉药物(戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛)对小鼠缺氧耐受性的影响及相关机制。
方法小鼠随机分成6组:生理盐水对照组、普萘洛尔对照组、戊巴比妥钠组、三溴乙醇组、乌拉坦组、水合氯醛组。
腹腔注射给药,缺氧瓶法测定小鼠缺氧耐受时间及耗氧率,并利用生物信号采集处理系统记录心率变化。
观察常温下不同药物对小鼠缺氧耐受时间的影响,并分析缺氧耐受时间与耗氧率、心率之间的关系。
结果戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛均显著延长小鼠的缺氧耐受时间(P<0.01),其中三溴乙醇和水合氯醛作用明显高于其他组。
戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛均降低小鼠的耗氧率(P<0.05),其中三溴乙醇和水合氯醛的降低作用最显著。
三溴乙醇、水合氯醛除降低小鼠耗氧率外,还显著降低小鼠心率(P<0.05)。
结论缺氧耐受性与耗氧率和心率有关。
戊巴比妥钠、乌拉坦可通过降低小鼠耗氧率增强缺氧耐受性,而三溴乙醇和水合氯醛通过降低耗氧率和降低心率增强小鼠缺氧耐受性。
标签:麻醉药;缺氧耐受性;小鼠缺氧是常见的病理生理过程,缺氧耐受性差的器官如心、脑等,更容易发生缺血-再灌注损伤(ischemia reperfusion injury),心脑血管疾病手术特别是冠脉搭桥术和心脏移植手术等的广泛开展,均涉及缺血-再灌注过程。
近年来研究显示,麻醉药除了其麻醉效能外,还能明显减轻缺血再灌注损伤,但其机制复杂,尚不完全清楚[1-3]。
目前研究主要集中在离体细胞和单个器官上,关于麻醉药预处理对全身缺血缺氧损伤的保护作用研究很少[4]。
因此,研究麻醉药物对机体缺氧耐受性的影响具有重要临床意义,本实验拟通过不同麻醉药物对小鼠缺氧耐受性的影响及相关机制研究,以期为临床相关缺血-再灌注疾病的治疗提供理论依据,对于改善患者预后具有重要价值。
1 材料与方法1.1 动物和试剂健康成年ICR(institute of cancer research)小鼠,体重(20±2)g,购自苏州大学实验动物中心。