高中化学-选修三-配位化合物理论简介共23页
- 格式:ppt
- 大小:1.89 MB
- 文档页数:14


配位化合物理论简介【学习目标】1、认识配位键,知道简单配合物的基本组成和形成条件。
2、记住常见配位化合物,了解配合物的结构与性质之间的关系;认识配合物在生产生活和科学研究方面的重要应用。
【回顾旧知】1.孤电子对:分子或离子中, 的电子对。
2.共价键:。
【新知预习】共价键里还有一类特殊的叫配位键,与一般共价键的形成过程不同。
四、配合物理论简介一、配位键:一种特殊的共价键1、概念:成键的两个原子一方提供,一方提供而形成的共价键。
以NH4+的形成为例说明配位键的形成:NH3分子的电子式中,N原子上有一对孤电子对,而H+的核外没有电子,1s是空轨道。
因此当NH3分子与H+靠近时,NH3分子中N原子上的进入H+的,与H+共用。
H+与N原子间的共用电子由N原子单方面提供,不同于一般的共价键,是一种特殊的共价键,叫配位键。
2、形成条件:其中一个原子提供。
另一原子提供空轨道。
可用电子式表示NH4+的形成过程: + H+为了区别普通共价键与配位键,可用“→”表示配位键,箭头指向接受电子(提供空轨道)的原子,因此的结构式可表示为:从形成过程看,尽管一个N-H键与其它的三个不同,但形成NH4+后,这四个共价键的、、三个参数是完全相同的,表现的化学性质也完全相同,所以NH4+空间结构为,与CH4、CCl4相似。
〖自学检测〗1.分析H3O+中的配位键成键情况(用电子式表示H3O+的形成过程)2.气态氯化铝(Al2Cl6)中具有配位键,分解原子间的共价键关系如图所示,将图中的配位键标上箭头。
二、配合物理论简介离子(或原子)与某些分子或离子以结合形成的化合物称为配位化合物,简称配合物,又叫络合物。
目前已知配合物的品种超过数百万,是一个庞大的化合物家族。
1、有关配合物(配位化合物)的几个概念如:[ Cu (NH3) 4 ] SO4名称:硫酸四氨合铜(Ⅱ)中心原子配体配位数内界外界理解要点:①配合物中的配体,提供孤电子对,可为中性分子或阴离子。


实验:展示①CuSO4、②CuCl2·2H2O、③NaCl、④K2SO4固体的颜色,将它们溶于水,观察水溶液的颜色。
现象:CuSO4、CuCl2的溶液呈天蓝色,NaCl、K2SO4的溶液为无色。
思考:1)固态时,Cu2+、SO42-、Cl-呈什么颜色?2)水溶液中,Cu2+、SO42-、Cl-呈什么颜色?3)为什么Cu2+在固态时和水溶液中的颜色不同?1、配位键:(1)概念:共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。
(2)表示: A → B电子对给予体电子对接受体(3)条件:其中一个原子必须提供孤对电子,另一原子必须有能接受孤对的原子轨道。
举例:H3O+ ()NH4+()2、配位化合物(1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。
作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。
[Cu(H2O)4]2+的空间结构为平面正方形。
(2)配合物的结构[Cu(NH3)4]SO4为例说明。
注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。
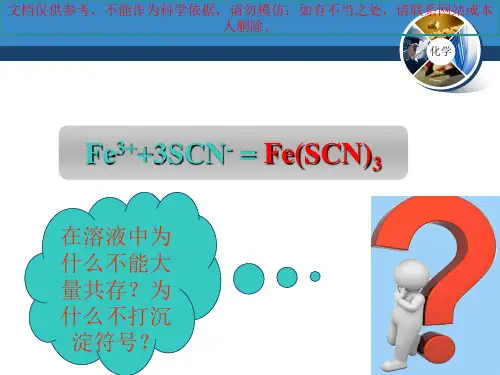
(3)配合物的命名例如:[Cu(NH3)4]SO4硫酸四氨合铜练习:对下列配合物进行命名[Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6]3、几种常见的配合物实验:硫酸四氨合铜的制备。
现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。
再加入乙醇,析出深蓝色的晶体。
有关反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2OH-Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-蓝色沉淀深蓝色溶液在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+:[Cu(NH3)4]2+的空间结构为平面正方形。

高中化学重点知识点配位化合物的构造与性质配位化合物是化学中的重要概念,它是由中心金属离子与配体形成的。
在本文中,我们将探讨配位化合物的构造和性质,帮助读者更好地理解这一概念。
1. 构造配位化合物的构造包括中心金属离子和配体。
中心金属离子通常是过渡金属离子,例如铁离子(Fe2+)或铜离子(Cu2+)。
配体则是可以通过配位作用与中心金属离子形成配位键的分子或离子。
常见的配体有水(H2O)、氨(NH3)和氯化物(Cl-)等。
2. 配位数配位数指的是中心金属离子与配体形成配位键的数量。
不同的中心金属离子具有不同的配位能力,因此其配位数也不同。
八配位是最常见的配位数,其中六个配位键通常位于一个平面上,而其余两个配位键位于该平面的上方和下方。
四配位和六配位也较为常见。
3. 配位键配位键是配位化合物中中心金属离子与配体之间的化学键。
它是通过配体中的一个或多个孤对电子与中心金属离子上的空轨道形成的。
配位键的强度取决于配位体的性质以及中心金属离子的电荷密度。
4. 配合物的稳定性配位化合物的稳定性取决于多种因素,包括中心金属离子的电荷、配体的配位能力以及配合物的化学环境等。
配体的配位能力越强,配合物越稳定。
此外,配位化合物的溶解度也受配体、溶剂和温度等因素的影响。
5. 光谱性质配位化合物具有多种特殊的光谱性质,例如紫外-可见吸收光谱和红外光谱。
紫外-可见吸收光谱可以用来确定配位化合物中的配位键的特性,例如配位键的吸收峰和颜色。
红外光谱则可以提供有关配合物中的配位键和配体的信息。
6. 磁性性质配位化合物的磁性性质可以通过观察其磁矩来研究。
根据中心金属离子的电子数目以及其取代程度,配位化合物可以分为顺磁性和抗磁性。
顺磁性配位化合物在外加磁场下会被吸引,而抗磁性配位化合物则会被磁场排斥。
7. 应用配位化合物在许多领域具有重要的应用,包括催化剂、医药和材料科学等。
例如,一些配位化合物被广泛用作医药中的金属药物,具有抗癌和抗炎等特性。

有机化学中的配位化合物与配位理论配位化合物是有机化学领域中的重要研究对象,其在催化反应、生物活性、药物设计等方面有着广泛的应用。
本文将介绍有机化学中的配位化合物以及与之相关的配位理论。
一、配位化合物的定义与特点配位化合物是指由一个或多个有机配体配位于过渡金属离子或主族金属离子上而形成的化合物。
其具有以下几个特点:1. 配位化合物含有一个或多个配体,可以是有机分子亦可是无机分子;2. 配位化合物中的金属中心通常带有正电荷;3. 配位键通常由配体提供;4. 配位化合物的结构和性质受到配位数、配位方式和配饰配位位置的影响。
二、配位理论的发展及基本原理配位理论是解释和预测配位化合物结构和性质的一个重要理论体系。
以下是配位理论的主要发展历程和基本原理:1. 晶体场理论晶体场理论主要应用于过渡金属离子的八面体和四面体配合物中,解释了它们的吸收光谱和磁性性质。
2. 电子对斥力理论电子对斥力理论主要应用于解释金属离子和配体之间的化学键,通过分析和计算配合物的几何结构和能量,来预测和解释其性质。
3. 反键理论反键理论是配位化合物中配体分子内电子的激发和反键形成的理论,可用于解释过渡金属配合物的吸收光谱和化学反应机理等。
4. 分子轨道理论分子轨道理论可用于预测和解释配位化合物的分子结构和几何构型。
三、配位化合物的合成方法配位化合物的合成方法多种多样,以下介绍其中几种常见的方法:1. 配体取代反应通过配体与金属离子的配位取代反应,生成新的配位化合物。
例如,利用氯化铂与氰基配体反应生成四氰合铂酸盐。
2. 配体加合反应配体加合反应是指配体与金属之间进行化学键形成,生成配位化合物。
例如,乙烯与二茂铁反应生成茂金属配合物。
3. 配体氧化还原反应通过氧化还原反应改变配体中的氧化态,从而形成不同的配位化合物。
例如,二次胺与氧化铜反应生成铜配合物。
四、配位化合物的应用领域配位化合物在有机化学中具有广泛的应用,以下介绍其中几个主要领域:1. 催化反应一些过渡金属配合物具有良好的催化活性,可用于催化有机合成反应。


高三化学选修三知识点总结随着高考的临近,高三学生们都在积极备考各科目,其中化学作为一门重要的科目之一,对于选修三的内容,同学们需要充分了解和掌握。
本文将对高三化学选修三的主要知识点进行总结和归纳,旨在帮助大家更好地复习和理解这一部分的内容。
一、配位化学在高三化学选修三中,配位化学是一个重要的知识点。
配位化学是研究物质中复杂化合物形成和存在的科学。
其中包括配体和中心离子之间的配位键形成以及配位化合物的性质和应用等方面。
在学习配位化学时,我们需要了解几个核心概念:1. 配位键:指的是配体和中心离子通过配位作用所形成的化学键。
2. 配体:参与配位作用的化合物或离子,可以通过提供一个或多个电子对与中心离子形成配位键。
3. 中心离子:指的是配位化合物中被配体所包围的离子。
在配位化学中,我们需要掌握配合物的命名、配位数的判定、配合物的光谱分析等内容。
同时,了解配位离子的水合和配合物的形成常数以及对于配体排列的影响等知识也很重要。
二、化学动力学化学动力学是高三化学选修三的另一个重要知识点。
化学动力学是研究化学反应速率和反应机理的科学。
在学习化学动力学时,我们需要了解以下几个关键概念:1. 反应速率:指的是反应物消失或生成物产生的变化率。
2. 反应级数:指的是反应速率与各参与反应物浓度的关系。
3. 反应机理:指的是描述反应过程中各个步骤和中间体形成的细节。
此外,化学动力学还涉及到反应速率常数、速率方程的推导和应用、表观活化能等知识点。
对于掌握化学动力学的内容,理解反应速率与温度、浓度和催化剂等因素之间的关系也非常重要。
三、化学平衡化学平衡是化学反应进行的一种特殊状态。
在高三化学选修三中,我们需要了解平衡常数、平衡常数与温度的关系、平衡常数的应用等内容。
同时也需要了解平衡常数与反应自由能之间的关系,以及如何利用平衡常数进行反应方向的判断。
在学习化学平衡时,我们还需要了解平衡的移动、平衡浓度的计算和平衡条件等知识。

第一节配位化合物的基本概念一.知识储备1.配合物的定义1.定义由中心体(原子或离子)和配位体(阴离子或分子)以配位键的形式结合而形成的具有特定组成和形状的分子,称为配位化合物,简称配合物。
[Ag(NH3)2]Cl、[Cu(NH3)4]SO4、[Ni(CO)4]等皆为配合物,其中[Ag(NH3)2]+、[Cu(NH3)4]2+称为配离子,[Ni(CO)4]称为配分子。
2.配合物特征(1)含有配位键(中心体与配位体间以配位键相结合);(2)配离子或配分子是不可分割的整体(存在于固体或溶液中)。
2.配合物的组成[Ni(CO)4]——只有内界1.中心体(离子或原子):大多数是带正电的阳离子,也有中性原子,甚至是金属阴离子,其必备的条件是具有空轨道。
(1)多数为副族金属离子:(2)中性原子:如Ni(CO)4、Fe(CO)5等中的Ni、Fe原子。
(3)金属阴离子:如Fe(CO)42-中的Fe2-。
(4)高氧化态的金属(主族金属元素)和非金属元素的离子:如[AlF6]3-中的Al3+,[SiF6]2-中的Si(Ⅳ),PF6-中的P(Ⅴ)等。
碱金属和碱土金属的离子作为中心体的能力要比副族金属离子弱得多。
2.配位体(简称配体):含有孤对电子或π键电子对以及多个不定域电子的分子或离子。
如:阴离子X-、OH-、SCN-、CN-等和中性分子H2O、NH3、CO、醇、胺、醚等都含有至少一对孤电子,它们都可作为配体;乙烯C2H4、苯C6H6、环戊二烯C5H5等都含有π键电子对或多个不定域电子,它们也可以作为配体,称为π配体。
(1)配位原子:配体中直接同中心离子(或原子)配合的原子。
例如:NH3中的N原子、CO和CN-中的C原子等。
常见的配位原子是位于周期表中p区的非金属元素的原子——ⅣA、ⅤA、ⅥA、ⅦA,如C、N、P、O、S、F、Cl、Br、I等。
(2)配体的类型:①单齿配体:只含有一个配位原子的配体,如:NH3、H2O、X-、CO等。

化学中的配位化合物知识点配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学中具有重要的地位,广泛应用于催化剂、药物、化妆品、材料等领域。
本文将介绍配位化合物的定义、配体、配位数、结构和性质等方面的知识点。
一、定义配位化合物是由一个或多个配体与一个中心金属离子或原子通过配位键相连而形成的化合物。
配位键是指配体上的一个或多个原子通过共用电子对与中心金属离子或原子形成的化学键。
二、配体配体是指能够通过配位键与中心金属离子或原子形成化学键的化合物或离子。
配体可以是简单的阴离子、分子或配合物,常见的配体有水分子(H2O)、氨分子(NH3)、氯化物离子(Cl-)等。
三、配位数配位数是指中心金属离子或原子周围配体的个数。
配位数决定了配合物的结构和性质。
一般情况下,配位数为2或4的配合物呈平面结构,配位数为6的配合物呈八面体结构。
四、结构配位化合物的结构多样,常见的几何构型有线性、正方形、八面体等。
配合物的结构与配位数、中心金属离子的价态、配体的性质等因素有关。
五、配合物的性质配合物具有许多特殊的性质,包括颜色、磁性、溶解度等。
其中,颜色是由于配合物的电子结构所引起的。
许多过渡金属离子在配位化合物中呈现出丰富多彩的颜色。
六、常见的配位化合物1. 水合物:即配位化合物中的水分子,常见于许多金属离子的溶液中,如CuSO4·5H2O(硫酸铜五水合物);2. 氨合物:即配位化合物中的氨分子,常见于许多过渡金属离子的配合物中,如[Co(NH3)6]Cl3(六氨合三氯钴);3. 配位聚合物:由多个配位单元组成的大分子化合物,如蓝色胆矾[Cu(NH3)4][Fe(CN)6](铜铁氰合物);4. 配位聚合物:由两个或多个中心金属离子和对应的配体组成的化合物,如[Fe2(CN)6]4-(四氰合二铁)。
综上所述,配位化合物是化学中的重要概念,对于理解化学反应、催化剂、材料科学等领域具有重要意义。
高中化学选修知识点详解汇总在高中化学课程中,选修知识点的学习是对学生进一步深入研究化学领域以及培养其科学思维能力的重要环节。
本文将对高中化学选修知识点进行详细解析并进行汇总,旨在帮助学生更好地掌握这些知识。
一、配位化学1. 配位化学概述配位化学是研究金属离子与配体之间的相互作用及其复合物性质的学科。
本节将详细介绍配位化学的基本概念、配合物的分类以及配位数、电荷等方面的知识。
2. 配合物的结构与性质本小节将介绍如何确定配合物的分子结构,包括金属离子的配位数、配位键的性质以及有机配体的命名等内容。
同时,还将探讨配合物的稳定性与溶解度等性质。
3. 配位理论配位理论是描述配合物形成的基本理论。
本节将介绍主要的配位理论,如Werner理论、晶体场理论和分子轨道理论,并分析其适用范围和优点。
二、化学动力学与化学平衡1. 化学动力学概述化学动力学是研究化学反应速率及其与反应条件、反应物浓度之间的关系的科学。
本节将介绍化学动力学的基本概念、速率方程和速率常数等内容。
2. 反应速率与反应机理本小节将介绍速率方程的推导与计算方法,并以具体反应为例解析反应机理的研究方法和影响反应速率的因素。
3. 化学平衡及其影响因素化学平衡是指化学反应在特定条件下达到动态平衡的状态。
本节将介绍平衡常数、化学平衡的移动以及压力、温度、浓度等因素对平衡的影响。
三、电化学1. 电化学概述电化学是研究电能与化学能之间相互转化的学科。
本节将介绍电化学的基本概念、电解质的电离与电导以及电化学电池等内容。
2. 电化学平衡与电极反应本小节将介绍电解质溶液饱和度、溶解度积常数以及电极反应的浓度极限等概念,并以具体反应为例解析电解质溶液中的平衡情况和电极反应。
3. 电化学应用电化学在生活中具有广泛的应用,如电镀、电解、电解质溶液的水解等。
本节将介绍这些应用,并解析其基本原理和实际操作过程。
四、有机化学1. 有机化学基本概念有机化学是研究有机物及其反应的学科。