氯气工业制法
- 格式:docx
- 大小:15.58 KB
- 文档页数:1

实验室制取氯气的方法制取氯气的方法制备氯气是一项重要的化学实验,氯气在许多实验和工业过程中都是必须的化学试剂。
本文将介绍两种实验室制备氯气的方法,分别为:硫酸和氯化钠的反应法和次氯酸钠和盐酸的反应法。
1.硫酸和氯化钠的反应法氯化钠和硫酸反应是制备氯气的常用方法。
这种方法既简单又经济,可以在实验室或大规模工业中应用。
以下是实验步骤:材料:- 氯化钠- 硫酸- 醋酸- 水- 氧化铜棒- 气液分离瓶- 实验室用玻璃器皿步骤:1.在一个实验室用器皿中加入少量醋酸。
2.将10克的氯化钠加入醋酸中。
此时会有气体产生,放到通风橱中进行。
3.将40毫升浓硫酸加入混合物中。
反应会产生白烟,并发热。
4.将氧化铜棒插入反应瓶中,用以催化反应。
此时,氯气开始生成并进入气液分离瓶中。
5.收集氯气。
使用实验室用器皿封闭气液分离瓶口并且将气液分离瓶逆转。
6.氯气会沉积在瓶底,可以打开器皿并使用吸管收集气体。
注意:在操作过程中,一定要保持通风良好。
硫酸对于皮肤、眼睛和肺部都有毒性。
实验室中应该使用总面积较大的喇叭式通风橱,并且穿戴化学手套、防护衣和面罩等必要的防护装备。
2.次氯酸钠和盐酸的反应法此方法是制备氯气的一个更加安全且相对简单的方法。
这种方法需要使用的是相对较为微弱的氯气产生量,因此适合较小规模的实验室。
以下是实验步骤:材料:- 次氯酸钠- 盐酸- 氢氧化钠- 实验室用器皿- 恒温水浴- 实验室用玻璃器皿步骤:1.将一定余量的次氯酸钠加入实验室用器皿中。
2.加入盐酸混合溶液,制备出次氯酸混合物。
3.将适量的氢氧化钠加入混合物中以调整pH值,并且保持温度在45℃左右。
这个温度是为了控制反应的速度和产生氯气的效率。
4.收集氯气。
使用实验室用器皿封闭反应瓶口并且逆转。
氯气进入器皿后可通过吸管收集。
注意:与前述的方法一样,操作者必须保持良好的通风环境和必要的安全防护措施。
此外,在调节pH值时需要小心,以免过多的氢氧化钠使试剂溶液变得碱性,从而影响反应产生氯气的效率。

氯气的制备方法
氯气的制备方法
氯气是一种无色、有毒的气体,具有强烈的潮热性,主要用于农药、工业消毒剂等的制造,也可以作为燃料添加剂。
下面介绍一种常见的氯气制备方法:
1. 首先,从药剂厂购买氯气的原料——氯化钠(NaCl);
2. 将氯化钠放入金属容器中,加入适量的铝粉,间隔放置;
3. 将容器放入火中,加热至钠与铝粉发生反应,并分解出氯气;
4. 将氯气收集到另一个容器中,完成氯气的制备。
以上就是氯气的常见制备方法,在操作时,一定要按照安全规定进行操作,并确保室内通风良好,以防止氯气对人体造成危害。


氯气的实验报告氯气的实验报告引言:氯气是一种常见的化学物质,具有强烈的刺激性气味,常用于消毒、水处理和工业生产中。
本实验旨在探究氯气的性质、制备方法以及其在实际应用中的重要性。
一、氯气的性质氯气是一种黄绿色气体,具有强烈的刺激性气味。
它是一种非常活泼的元素,具有较强的氧化性和消毒能力。
氯气在水中溶解度较高,可以形成盐酸。
由于其活泼性,氯气与许多物质发生反应,如金属、非金属和有机物等。
二、制备氯气的方法1. 氯化钠电解法:将氯化钠溶解在水中,通过电解将氯离子氧化为氯气。
这是最常见的制备氯气的方法,也是工业生产中主要的方法之一。
2. 高温氯气法:通过高温处理含氯化合物,如氯化钾、氯化铝等,使其分解释放出氯气。
这种方法适用于实验室小规模制备。
三、氯气的应用1. 消毒:由于氯气具有较强的氧化性和消毒能力,被广泛用于饮用水、游泳池、医疗设施等场所的消毒。
氯气可以有效杀灭细菌、病毒和其他微生物,保护人们的健康。
2. 水处理:氯气可以用于水处理,去除水中的杂质和有害物质。
它可以氧化有机物、杀灭藻类和细菌,并消除水中的异味。
3. 工业生产:氯气在工业生产中有广泛的应用,如制造塑料、橡胶、溶剂、清洁剂等。
氯气还用于制备氯化铁、氯化铜等化学物质。
四、实验过程1. 实验材料:氯化钠、稀盐酸、水、集气瓶、导管等。
2. 实验步骤:a. 将适量的氯化钠溶解在水中,制备氯化钠溶液。
b. 将稀盐酸滴加到氯化钠溶液中,产生氯气。
c. 将集气瓶倒置于溶液中,通过导管将氯气收集于瓶中。
d. 观察氯气的性质,如颜色、气味等。
五、实验结果与讨论通过实验我们观察到了氯气的黄绿色和刺激性气味。
在制备氯气的过程中,我们注意到氯化钠与稀盐酸反应生成氯气的化学方程式:2NaCl + 2HCl → Cl2 + 2NaCl + H2O。
这个反应是一个酸碱中和反应,同时产生了氯化钠和水。
实验中,我们通过将集气瓶倒置于溶液中,可以将氯气收集于瓶中。
实验结果与预期一致,验证了氯气的制备方法。

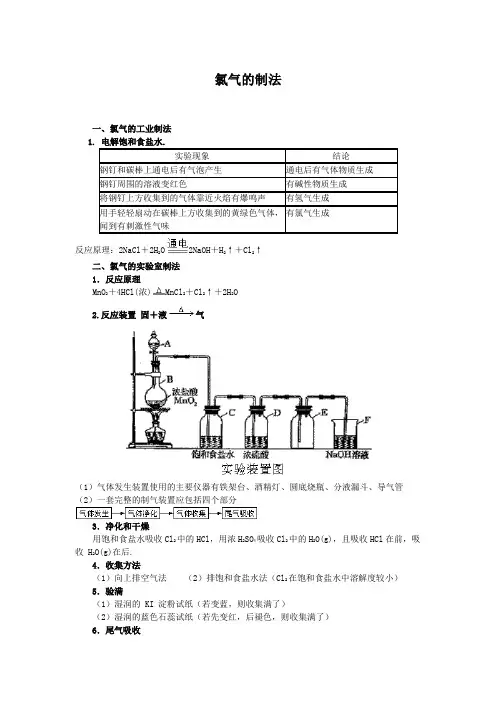
氯气的制法一、氯气的工业制法反应原理:2NaCl+2H2O2NaOH+H2↑+Cl2↑二、氯气的实验室制法1.反应原理MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O2.反应装置固+液气(1)气体发生装置使用的主要仪器有铁架台、酒精灯、圆底烧瓶、分液漏斗、导气管(2)一套完整的制气装置应包括四个部分3.净化和干燥用饱和食盐水吸收Cl2中的HCl,用浓H2SO4吸收Cl2中的H2O(g),且吸收HCl在前,吸收 H2O(g)在后.4.收集方法(1)向上排空气法(2)排饱和食盐水法(Cl2在饱和食盐水中溶解度较小)5.验满(1)湿润的 KI 淀粉试纸(若变蓝,则收集满了)(2)湿润的蓝色石蕊试纸(若先变红,后褪色,则收集满了)6.尾气吸收用NaOH溶液吸收多余的Cl2:Cl2+2NaOH=NaCl+NaClO+H2O例1.实验室制氯气时有如下操作,操作顺序正确的是 ( )①连接好装置,检查气密性;②缓慢加热,加快反应使气体均匀逸出;③在烧瓶中加入MnO2粉末;④往分液漏斗中加入浓盐酸,再缓慢滴入烧瓶中;⑤用向上排空气法收集氯气,尾气导入吸收试剂中.A.①②③④⑤ B.④③①②⑤C.①③④②⑤ D.①④③②⑤答案:C例2. 较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应.某校甲、乙两化学研究性学习小组均用200 mL 12 mol/L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气.分析实验结果发现:①甲、乙两组制得的漂白粉中Ca (ClO)2的质量明显小于理论值②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca (ClO3)2的含量较高.试回答下列问题:⑴上述实验中理论上最多可制得Ca (ClO)2多少克? ⑵实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式.解析:⑴据题意:n (HCl) = 12 mol/L×0.2 L = 2.4 mol n(MnO2) = 17.4 g÷87 g/mol = 0.2 molMnO2 + 4 HCl(浓) △MnCl2 + Cl2↑+ 2H2On(MnO2)∶n (HCl) = 2.4 mol∶0.2 mol = 12∶1 > 4所以浓HCl过量,应根据MnO2计算.根据制备氯气的化学方程式 n (Cl 2) = n (MnO2)= 0.2 mol又因为:2Cl2 + 2Ca (OH)2= Ca (ClO)2 + CaCl2 + 2H2On[Ca(ClO)2] = 1/2 n (Cl2) = 1/2×0.2 mol = 0.1 molm[Ca(ClO)2] = 143 g/mol× 0.1mol = 14.3 g⑵①随着反应进行,温度升高,会产生副产物Ca (ClO3)2;6Cl2 + 6Ca(OH)2△ 5CaCl2+ Ca(ClO3)2 + 6H2O②Cl2未与石灰乳完全反应,残余Cl2被NaOH溶液吸收Cl2 + 2NaOH = NaCl + NaClO + H2O答案:⑴上述实验中理论上最多可制得Ca(ClO)2的质量为14.3 g,⑵略.例3.家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器的电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力.与该反应器工作原理直接有关的化学方程式是()A、2NaOH +Cl2 == NaCl + NaClO + H2OB、H2 + Cl2 == 2HCl通电C、2NaCl + 2H2O == 2NaOH + H2↑ + Cl2↑D、2HClO == 2HCl + O2↑解析:根据发生器的反应物和反应条件,可以推测在发生器中电解食盐水, C中反应会发生.再根据生成液具有强烈的杀菌消毒能力,结合电解食盐水后的产物可以推断Cl2和NaOH发生作用生成了NaClO,A中反应也会发生.答案:A、C。



制备氯气的化学方程式
氯气是一种无色、有毒的气体,具有高度渗透性,用于制备氯化物和次氯酸钠等化工产品。
常用的制备氯气的化学方程式有如下几种:制备氯气的最简单方法是通过氯酸和钠反应得到,化学方程式如下:
NaClO3+2NaOH →Na2O2+2H2O+Cl2
在温度较高的条件下,氯化钠也可以用氧气和氯气反应制备,化学方程式如下:
2NaCl+2O2 → 2NaClO2+Cl2
在温度更高的条件下,氯也可以通过氯化钠与硫化氢反应得到,化学方程式如下:
NaCl+H2S → NaHS+Cl2
此外,还有许多其他的制备氯气的化学方程式,比如通过氯化钾和银反应得到,化学方程式如下:
KCl+Ag → AgCl+K
在工业上,制备氯气的方法通常是用氯酸和钠反应的方法,因为这种方法简单、成本低廉。
在进行氯气的制备反应时,需要注意的是,氯气是一种有毒的气体,可以引起人体突发性中毒。
因此,在进行氯气的制备反应时,应注意安全应注意安全的方面包括:
1.在进行氯气的制备反应时,应使用防护眼镜和手套,以防止
氯气对眼睛和皮肤的刺激。
2.氯气制备反应过程中产生的氯气应及时排出,以防止积聚过
多的氯气造成爆炸危险。
3.在进行氯气的制备反应时,应注意观察周围环境,如果出现
异常气味或有毒气体的现象,应立即疏散人员并联系专业人
员进行处理。
4.在进行氯气的制备反应时,应注意观察实验室内的温度和湿
度,以防止反应过程中的危险事故。
总之,在进行氯气的制备反应时,应特别注意安全,以防止意外事故的发生。

工业制氯气的方法工业制氯气的方法有多种,下面将详细介绍几种常用的方法。
1. 电解氯化钠法:这是目前最主要的工业制氯气的方法。
首先将氯化钠溶解在水中形成氯化钠溶液,然后通过电解设备,将氯化钠溶液分解为氯气、氢气和氢氧化钠。
电解槽两端放置阴极和阳极,在电流的作用下,阴极产生氢气,阳极产生氯气。
氯气被收集并压缩,氢气则大部分用作能源或二次加工。
2. 氯碱法:这是另一种常用的工业制氯气的方法。
氯碱法包括氯化钠法和石膏法两种方式。
氯化钠法的原理和电解氯化钠法相同,只是使用的电解设备不同。
石膏法是将氯化钠和石膏反应生成氯化钙和硫酸钠,再用稀酸将氯化钙分解为氯气和盐酸。
氯气通过压缩收集。
3. 氯气氧化法:这种方法是通过将二氧化锰和盐酸反应,生成氯气和锰(II)氯化物。
具体反应式为:2MnO2 + 4HCl →2Cl2 + 2MnCl2 + 2H2O。
氯气通过压缩收集。
4. 热氧化法:这种方法是通过将氯化钠与含氧化合物(如硫酸铜、氧化铜等)反应,在高温下氯化钠氧化产生氯气。
具体反应式为:2NaCl + 2CuO →2CuCl + O2 + Na2O。
氯气通过压缩收集。
5. 碱液法:这种方法是通过将二氧化锰和氢氧化钠反应,生成氯气和锰(II)氢氧化物。
具体反应式为:2MnO2 + 2NaOH →2NaMnO2 + H2O + Cl2。
氯气通过压缩收集。
6. 湿法氧化法:这种方法是通过氯气在水中的溶解产生次氯酸,然后将次氯酸加热,分解产生氯气和水。
具体反应式为:2Cl2O + 2H2O →4HCl + O2。
氯气通过压缩收集。
工业制氯气的选择主要取决于制氯气的成本、效率、安全性等因素。
其中,电解氯化钠法在工业中应用最为广泛,因其具有高纯度、高效率、低能耗和环保的特点。
此外,氯碱法也是一种常用的制氯气方法,尤其在中国和美国等国家,氯碱法制氯气的产量很大。
制氯气是重要的工业过程,氯气在多个行业中有广泛的应用,如化工、食品加工、水处理、纺织等。
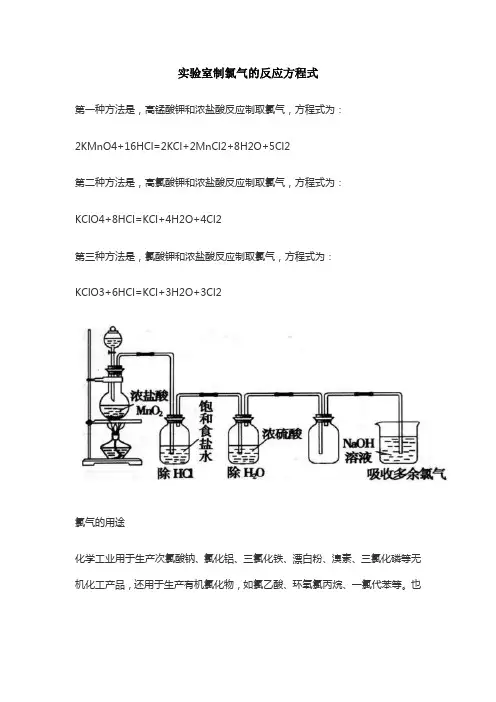
实验室制氯气的反应方程式
第一种方法是,高锰酸钾和浓盐酸反应制取氯气,方程式为:
2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2
第二种方法是,高氯酸钾和浓盐酸反应制取氯气,方程式为:
KClO4+8HCl=KCl+4H2O+4Cl2
第三种方法是,氯酸钾和浓盐酸反应制取氯气,方程式为:
KClO3+6HCl=KCl+3H2O+3Cl2
氯气的用途
化学工业用于生产次氯酸钠、氯化铝、三氯化铁、漂白粉、溴素、三氯化磷等无机化工产品,还用于生产有机氯化物,如氯乙酸、环氧氯丙烷、一氯代苯等。
也
用于生产氯丁橡胶、塑料及增塑剂。
日用化学工业用于生产合成洗涤剂原料烷基磺酸钠和烷基苯磺酸钠等。
考点37 氯气的实验室及工业制法聚焦与凝萃1.掌握氯气的实验室制法; 2.了解氯气的工业制法。
解读与打通常规考点1.氯气的实验室制法(1)反应原理:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O①盐酸是浓盐酸,一般为12mol·L -1、1.9g·mL -1,稀溶液中的HCl 不能被MnO 2氧化;HCl 是还原剂,但还表现出酸性。
②必须加热,在常温下,MnO 2与浓盐酸是不反应的。
(2)实验装置图:图中:A 是分液漏斗,加浓盐酸;B 是圆底烧瓶,用于反应,液体不超过容积的2/3,加热时必须垫石棉网;C 是洗气瓶,瓶中装饱和食盐水,除去Cl 2中混有的HCl(氯气在饱和食盐水中比在水中溶解度小,可减少氯气的损耗);D 是洗气瓶,瓶中装浓H 2SO 4,干燥Cl 2;E 为收集装置,用向上排空气法收集Cl 2,进气管伸入集气瓶的底部;F 是尾气吸收装置,因氯气有毒,多余氯气要用NaOH 的溶液将其吸收(用水和石灰水吸收效果都不好。
) (3)氯气的检验:氯气可用湿润的KI 淀粉试纸检验,试纸变蓝,其原理是:Cl 2+2KI=2KCl +I 2,置换出的碘与淀粉反应生成蓝色物质。
隐性考点2.工业制法——电解饱和食盐水法 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑融合与应用例1.实验室用如下图所示装置制备Cl 2,并进行Cl 2的性质实验。
(1)A中加入KMnO4固体(反应后产物是MnCl2),B中盛有浓盐酸,烧瓶中发生反应的化学方程式为。
(2)C中盛有紫色石蕊试液,C中的现象是;D中有白色沉淀生成,D中盛放的试剂可能是;E 中溶液由无色变为蓝色,E中盛放的试剂可能是。
(3)F中一般盛放,其作用是。
【答案】(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(2)先变红后褪色AgNO3溶液KI淀粉溶液(3)NaOH溶液吸收多余的Cl2(2)产生的Cl2通入紫色石蕊试液中,Cl2与水反应产生的盐酸使石蕊由紫色变为红色,产生的HClO又可将红色漂白。
工业上制取氯气的化学方程式氯气,这个小家伙可不简单,工业上制取氯气的方法可谓五花八门,像个调皮的孩子,让人又爱又恨。
说到氯气,大家可能第一反应是“哦,漂白水的味道”。
没错,它的确是那种能把衣服变得闪闪发亮的家伙,但同时也是个危险的角色,绝对不是你可以随便玩弄的玩具。
在工业界,制取氯气最常见的办法就是通过电解食盐水,这就像是把海洋的味道变成了一种强大的化学力量。
想象一下,咱们把食盐溶解在水里,接着用电流一激发,哇,氯气就呼之欲出了,简直像变魔术一样,太神奇了!电解的过程可有趣了。
电源一接通,水里的盐分子就开始疯狂跳舞,阳极和阴极像在举行一场化学舞会。
阳极那边,氯离子就乖乖向阳极游去,结果它们在那儿“咔嚓”一声变成了氯气,气泡冒得飞起,真是让人看得目瞪口呆。
而阴极那边,水分子也不甘示弱,拼命往阳极那儿挤,结果那边也放出氢气,真是一场“双煞”盛宴。
氯气与氢气的组合,可不是简单的化学反应,而是工业生产的重要一环,简直是为生活提供了源源不断的动力。
说到氯气的应用,那可真是多得让人眼花缭乱。
漂白衣物、消毒水、饮用水净化,统统离不开它。
想想看,如果没有氯气,我们的衣服估计都没法洗得这么干净,家里的厕所也可能是个小黑屋,令人作呕。
再加上食品工业、化工产品的生产,这小家伙可是大名鼎鼎,几乎无处不在。
很多时候我们并不知道,氯气就像隐形的超级英雄,默默为我们的生活保驾护航。
氯气并不是个温顺的家伙,处理时可得小心翼翼,别让它在你面前大摇大摆。
它有毒,吸入后可能让你咳嗽得像抽风,眼睛也可能会辣得流泪。
想象一下,在化工厂里,工人们穿着厚厚的防护服,像外星人一样,面部还带着面具,真是一场别开生面的“时尚秀”。
安全第一,这绝对是处理氯气的铁律。
只有做好了防护,才能放心大胆地使用它,毕竟咱们可不想因为一点小失误,就让生活变得灰头土脸。
而说到电解过程,设备的选择也十分重要。
选择合适的电解槽,就像挑选一台好车,得耐用、得高效。
电解槽的设计可是关键,要保证氯气和氢气分开,不然可就闹出大笑话来了。
氯气工业制法方程式1、氯气是黄绿色有强烈刺激性气味的有毒气体,吸入少量会引起胸部疼痛和咳嗽,吸入大量则会中毒死亡。
氯气不仅可溶于水,而且还能与水反应,不能用排水法收集,常用向上排空气法收集。
氯气是黄绿色气体,加压或降温后液化为液氯,液氯是黄绿色液体,进一步加压或降温则变成固态氯。
氯气、液氯是同一种物质,只是状态不同,都属于纯净物,但氯水是氯气的水溶液,属于混合物。
注意实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
2、(1)从氯的原子结构认识氯气的化学性质——氧化性(2)氯气是很活泼的非金属单质,具有很强的氧化性。
氯气能与绝大多数金属反应,把变价金属(如Fe、Cu)一般氧化到最高价。
①与钠反应2Na+Cl22NaCl,产生大量白烟;②与铁反应2Fe+3Cl22FeCl3,产生大量棕褐色烟;在常温、常压下,干燥的氯气不能与铁发生反应,故可用钢瓶储存、运输液氯。
③与铜反应Cu+Cl2CuCl2,铜在氯气中剧烈燃烧,集气瓶中充满了棕黄色的烟.一段时间后,集气瓶内壁附着有棕黄色的固体粉末.向集气瓶内加入少量蒸馏水,棕黄色固体粉末溶解并形成绿色溶液,继续加水,溶液变成蓝色。
④“烟”是固体小颗粒分散到空气中形成的物质.如铜在氯气中燃烧,产生的棕黄色的烟为CuCl2晶体小颗粒;钠在氯气中燃烧,产生的白烟为NaCl晶体小颗粒;2Al+3Cl22AlCl3Mg+Cl2MgCl2(3)氯气能与非金属单质(如H2)反应①在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中。
观察到的现象是氢气在氯气中安静地燃烧,发出苍白色火焰。
②燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,观察到的现象是集气瓶口上方出现白雾。
③反应的化学方程式是H2+Cl22HCl。
④氯气和氢气的混合气体在强光照射时爆炸,产生此现象的原因是H2和Cl2混合后点燃,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸。
⑤H2与Cl2反应生成的HCl气体具有刺激性气味,极易溶于水。