人教版高一必修一化学第三章知识点:氧化钠和过氧化钠
- 格式:doc
- 大小:23.00 KB
- 文档页数:1

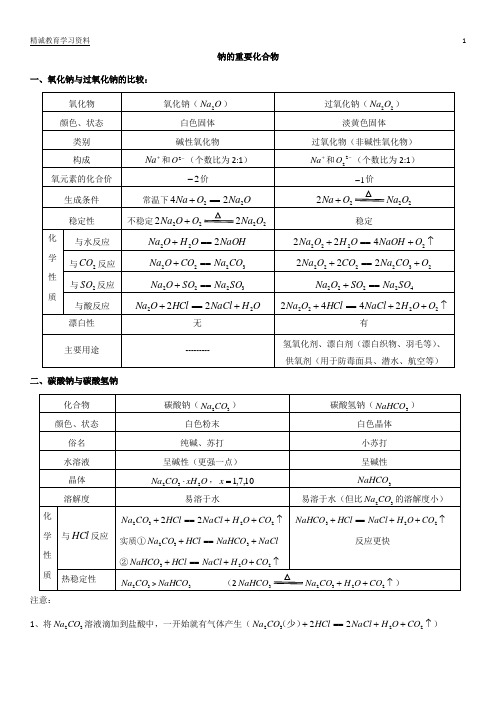
钠的重要化合物一、氧化钠与过氧化钠的比较:二、碳酸钠与碳酸氢钠注意:1、将32CO Na 溶液滴加到盐酸中,一开始就有气体产生(↑++==+223222CO O H NaCl HCl CO Na (少))将盐酸滴加到32CO Na 溶液中,刚开始不会产生气体(NaCl NaHCO HCl CO Na +==+332(少)),过会才产生气体。
2、相互转化: 32CO Na →3NaHCO : 322322NaHCO CO O H CO Na ===++3NaHCO →32CO Na : ① 23NaHCO (固体) ↑++2232CO O H CO Na② O H CO Na NaOH NaHCO 2323+===+(溶液) ③(固体)(固体)NaOH NaHCO +3 O H CO 232+(如果3NaHCO 过量,会继续分解) 3、将2CO 通入到32CO Na 溶液中,现象是:有白色晶体析出原因:322322NaHCO CO O H CO Na ===++,①32CO Na 比3NaHCO 的溶解度大,②溶剂水反应掉一些,③溶质从32CO Na 变成3NaHCO ,质量增加。
三、焰色反应——很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。
操作:洗、烧、蘸、烧。
焰色反应是一种物理现象,它是元素的性质;并不是所有的元素都有这种性质。
金属元素 钠 钾钙 铜 钡 焰色黄色紫色(透过蓝色钴玻璃)砖红色绿色黄绿色应用:检验元素的存在,制成节日火焰。
四、强化训练1、把4.48L 2CO 通过一定量的固体过氧化钠后收集到3.36L 气体(气体的测量均在标准状况下),则这3.36L 气体的质量是( )A. 6.0gB. 5.6gC. 4.8gD. 3.8g2、等物质的量混合的过氧化钠和碳酸氢钠固体在密闭容器中加热,使其充分反应,排出气体物质后冷却,残留的固体物质是( )A. NaOH 、32CO NaB. 22O Na 、32CO NaC. 32CO NaD. 22O Na 、NaOH 、32CO Na 3、在一定条件下,将钠与氧气反应的生成物1.4g 溶于水,所得溶液恰好能被80mL 浓度为0.501-⋅L mol 的HCl 溶液中和,则该生成物的成分是( )A. O Na 2B.22O NaC. O Na 2和22O NaD. 无法判断 4、过氧化钠常作漂白剂、杀菌剂、消毒剂。

氧化钠和过氧化钠课后篇素养形成合格考达标练1.下列关于Na2O和Na2O2的叙述正确的是()A.Na2O和Na2O2均可与盐酸反应,故二者均为碱性氧化物B.Na2O在一定条件下可以转化为Na2O2C.Na2O与H2O的反应属于化合反应,而Na2O2与H2O的反应属于氧化还原反应,其中Na2O2是氧化剂,H2O是还原剂D.在呼吸面具中,Na2O常作供氧剂解析能与盐酸反应的氧化物不一定是碱性氧化物,还必须考虑生成物是否仅为盐和H2O:Na2O+2HCl 2NaCl+H2O、2Na2O2+4HCl4NaCl+2H2O+O2↑,A项错误;Na2O在一定条件下可以转化为Na2O2:2Na2O+O22Na2O2,B项正确;Na2O+H2O2NaOH是化合反应(非氧化还原反应),2Na2O2+2H2O4NaOH+O2↑是氧化还原反应,其中Na2O2既是氧化剂又是还原剂,C项错误;Na2O2常作为供氧剂,D项错误。
2.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向试管内滴加水时,发现U形管内液体右移,静置后液面左边低于右边,则试管内的物质是()A.过氧化钠B.氯化钠C.铝D.铁形管内液体右移,静止后液面左边低于右边,说明锥形瓶内气体压强增大,结合选项,可知其原因是Na2O2与水反应生成O2,使瓶内压强增大。
3.向装有Na2O2的试管中加入一定量水,再滴入2滴酚酞溶液,振荡,下列叙述正确的是()A.加水后,将燃着的木条放到试管口,燃着的木条熄灭B.滴入酚酞溶液先变红,振荡后褪色C.滴入酚酞溶液,溶液仍为无色D.因为Na2O2与酚酞发生氧化还原反应使溶液变为红色解析Na2O2与水发生反应2Na2O2+2H2O4NaOH+O2↑,O2能使燃着的木条燃烧更旺,NaOH与酚酞作用使无色的酚酞溶液变红色,在反应过程中Na2O2表现出强氧化性,它能将红色物质氧化而褪色,故滴入酚酞溶液先变红,振荡后褪色。
4.(2021山东聊城高一检测)王刚同学将Na、Na2O、Na2O2、Na2CO3分别投入盛有足量盐酸的1号、2号、3号、4号四支试管中,结果他不会观察到有气泡生成的是() A.1号 B.2号 C.3号 D.4号、Na2O2、Na2CO3投入盐酸中分别放出H2、O2、CO2气体;Na2O与盐酸反应生成NaCl和H2O。



(氧化钠与过氧化钠)《氧化钠与过氧化钠》的教学设计一、教学设计思路分析(一)教学内容分析“氧化钠和过氧化钠、”是高中化学必修模块《化学1》第三章第二节“几种重要的金属氧化钠和过氧化钠是对钠的性质和用途等知识的深入和完善,又是对研究金属单质及其化合物性质的一般方法与规律的进一步体会,通过一些形象直观的实验,分别介绍它们与水的反应,与二氧化碳及与盐酸的反应,并结合生活实际延伸出过氧化钠的用途。
(二)教材分析1、教材编排本节教材的内容是在金属的化学性质之后对钠、铝等重要元素的化学性质的延伸,对其化合物的性质的实行讨论,它与第一节教材相类似,也很重视实验教学,是一节通过大量实验事实来归纳知识,以“事实学习”为特征的课程,教材中对氧化钠与过氧化的编排,都是先通过实验给学生以感性知识,然后再通过对实验现象的观察和分析,引导学生得出相关结论。
这样编写方式有利于学生参与教学过程,使学生能够主动学习。
2、地位与作用高中化学新课标中要求通过实验提升学生对“化学是一门以实验为基础的科学”的理解,培养学生实验意识、操作技能、观察水平和分析问题的水平;通过比较归纳,让学生逐步掌握学习元素化合物知识的一般方法;通过知识在生活中的应用,提升学生学习化学的兴趣,增强学好化学、服务社会的责任感和使命感,为化学必修2的学习打下重要的基础。
3、课时安排“钠的重要化合物”的课时安排:第一课时:氧化钠与过氧化钠第二课时:碳酸钠和碳酸氢钠;以及颜色反应;第三课时:铝的重要化合物;第四课时:铁的重要化合物。
(三)学情分析此时,学生已经学习了“离子反应”、“氧化还原反应”这两类重要化学反应的相关概念和基本规律,以及金属钠、铝的性质等知识基础,对钠的重要化合物也已有一定的了解,但是,学生对于过氧化钠仅仅是物理性质的了解,缺乏金属氧化物与二氧化碳反应的知识,对理解过氧化钠与二氧化碳的反应缺乏基础,而且高一的学生对研究金属单质性质的一般方法和规律已经有了一定水准的理解、实验基础和自学水平,为本节学习打下了较好的基础。
高一化学必修一第三章知识点总结归纳其实,不是化学太难,而是你的学习方法出现了严重的问题。
只要方法得当,你完全可以很快告别“差生”!今天小编在这给大家整理了高一化学必修一第三章,接下来随着小编一起来看看吧!高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳总结金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
【活学活用】1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
第一课时氧化钠和过氧化钠一、教材分析、学情分析、新课标要求1. 教材分析本节课的教学内容是人教版高中化学,必修一第三章《金属及其化合物》,第二节《钠的重要化合物》第一课时:钠的重要化合物——氧化钠和过氧化钠,这是继学生初中学习氯化钠、氢氧化钠后又一组重点学习的物质。
本节内容承上是对物质的量、离子反应、氧化还原反应知识的巩固,是对本章第一节内容《金属与非金属的反应》的延伸;启下是对后面元素化合物知识的学习奠定基础、积累学习方法。
并且,本节知识不仅和生活常识有着密不可分的关系,在高科技领域也有所涉及。
因此,本节教材具有很强的理论指导意义和实际应用意义,通过本节课的学习,学生探究能力、运用所学知识解决实际问题的能力等均会得到提高。
2.学情分析在此之前,学生已经学习了物质的量、离子反应、氧化还原反应等知识,同时通过本章第一节的学习,已经初步对金属钠、氧化钠、过氧化钠有所认识。
能够对化学反应类型、氧化还原反应中电子得失情况等做出正确的判断。
绵阳中学高一(25)班的学生属于该年级第四层次班级,学习情况在同层次班级中处于较为平均的水平,课上思维活跃,课堂氛围良好,求知欲强,对化学实验有浓厚的兴趣,在老师的引导下能够自觉完成学习任务。
3.新课标要求(2017版)二、教学目标1.通过与CaO类比,掌握Na2O的化学性质;通过氧元素化合价的分析,预测Na2O2的性质;2.通过实验探究,掌握Na2O2与H2O的反应,理解Na2O2与H2O反应的历程;强化“宏观辨识与微观探析”的核心素养;3.通过“吹气生火”实验,掌握Na2O2与CO2的反应,了解Na2O2的应用,提高“科学态度与社会责任”的核心素养。
三、教学重难点1. 教学重点:Na2O2与H2O、CO2的反应2. 教学难点:①Na2O2与H2O、CO2反应②Na2O2与H2O反应的历程四、教学过程活动一迁移类比掌握氧化钠的性质时间:10min活动二动手实验探索Na2O2和水的反应时间:25min活动三学以致用联系生活实际时间:10min五、板书设计钠的重要化合物一、氧化钠 过氧化钠1.Na 2O —碱性氧化物2. Na 2O 2—过氧化物① 2Na 2O 2+2H 2O == 4NaOH +O 2↑2Na 2O 222②2Na 2O 2+2CO 2 == 2Na 2CO 3+O 2③保存:密封器皿、干燥处④用途:潜艇/呼吸面具供氧剂、杀菌、消毒、漂白。