第六章酸碱平衡与酸碱滴定法19133ppt课件
- 格式:ppt
- 大小:4.53 MB
- 文档页数:55










第六章酸碱平衡与酸碱滴定【知识导航】本章是基础化学课程学习中的重点,是专升本考试必考内容,如:近年来安徽中医学院专升本考试中都有一题计算题是溶液pH值计算。
同时很多的药物是有机的弱酸弱碱,药典中近一半的药物是用酸碱滴定法测含量,故此在执业药师考试中也有相关考题出现。
学好本章内容有利于同学们备战专升本考试和执业药师考试。
【重难点】1.酸碱理论(1)酸碱电离理论要点定义:水溶液中能够电离出H+的是酸,电离出OH-的碱。
反应的实质:H+ + OH-H2O。
不足:只适用于水溶液体系优点:酸碱概念明确(2)酸碱质子理论要点定义:凡是能给出H+的是酸,能接受H+的是碱。
共轭酸碱对的关系是组成上只相差一个H。
反应的实质:Na+ + Cl- + H2O。
即:质子的传递。
反应的方向:由强向弱进行,强弱差距越大,进行的越彻底。
优点:酸碱概念明确,应用范围更广。
不足:对不含H的反应无法解释。
(3)酸碱质子电子要点(简略)定义:凡是能给出电子对的是酸,能接受电子对的是碱。
优点:应用范围最广。
不足:酸碱概念不够清楚。
2.水的离子积(1)概念定义:一定温度下,水中电离出的H+与OH-浓度的乘积,该乘积是一个常数。
K W=[H+][OH-]=10-14(2)酸碱性浓度定义:[H+]=[OH-]=10-7……中性[H+]>[OH-]……酸性由水中的离子积10-14得来[H+]<[OH-]……碱性由于浓度值往往非常小,对浓度非常小的酸碱溶液用pH表示pH定义:pH = -lg[H+]pH=7……中性pH<7……酸性由H+浓度的负对数求出来的值pH>7……碱性pH值相差1,H+浓度值相差10倍。
通常pH的范围在1~14之间。
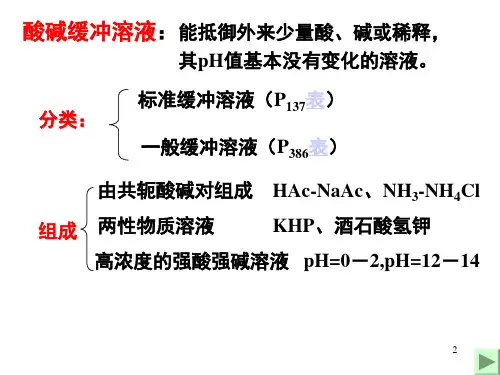
3.共轭酸碱对K a与K b的关系(1)关系K a·K b=K W=10-14(2)值的意义K a越大,物质的酸性越强,K b越大,物质的碱性越强。
物质的酸性越强,其共轭碱的碱性就越弱。
酸碱平衡与酸碱滴定第六章酸碱平衡与酸碱滴定第六章酸碱平衡与酸碱滴定第⼀节酸碱质⼦理论阿仑尼乌斯1887年提出了酸碱电离理论。
酸碱电离理论包括:1.酸碱定义:在⽔溶液中,电离阳离⼦全都是H +的化合物叫作酸,电离阴离⼦全都是-OH 的化合物叫做碱。
2.酸碱反应:-++OH H H 2O3.优缺点:优点:揭露酸碱本质,⽤平衡原理进⾏定量标度,直到现在的普遍应⽤。
不⾜之处:①强调以⽔为溶剂②分⼦酸、分⼦碱③机械唯物论:酸就是酸,碱就是碱④把碱限制为氢氧化物,氨⽔表现碱性⽆法解释⼀、酸碱的定义酸碱质⼦理论(1923年布朗斯特,劳莱)提出:1.酸碱定义:凡是能给出质⼦(H +)的分⼦或离⼦都是酸,凡是能接受质⼦的分⼦或离⼦都是碱酸碱分⼦ H 2O-++OH H ++H NH 3+4NHHAc-++Ac H H 2O+H +H +3O离⼦ NH 4+H ++NH 3 +-+H OH O H 2H 3O +H ++H 2O +-+H Ac HAc 酸碱是相互依存、转化,对⽴统⼀,不可分割的关系—共轭关系。
酸碱的共轭关系主要体现在:(1)酸碱通过质⼦相互转化,相互依存酸→质⼦ + 碱:HCl →H ++Cl -酸中有碱,碱可变酸, HCl 、Cl -(共轭酸碱对)(2)没有盐的概念,不局限于分⼦酸、分⼦碱。
(有的离⼦在某个共轭酸碱对中是碱,在另⼀个共轭酸碱对中却是酸):H 2PO 4-(3)在⼀对共轭酸碱中,酸强碱弱,酸弱碱强HCl>HAc (两个都是酸,HCl 更易给出质⼦),Cl -⼆、酸碱反应(质⼦论)(1)本质:两对共轭酸碱之间的质⼦传递(或质⼦争夺)HCl + NH 3NH 4++Cl - (反应规则:强酸和强碱作⽤⽣成弱酸弱碱)(2)酸碱反应类型:(质⼦传递反应)①电离作⽤(经典理论)在质⼦论中为质⼦传递式酸碱作⽤,分⼦酸与⽔的反应,⽔是两性物质HCl + H 2O →H 3O ++Cl - (完全电离)HAc +H 2O H 3O ++Ac - (部分电离)②经典理论中的中和作⽤(分⼦酸与分⼦碱、离⼦酸与离⼦碱反应)HCl + NH 3·H 2O === NH 4Cl + H 2OH 3O ++OH - = 2H 2O③盐的⽔解(离⼦酸、碱和⽔之间的酸碱反应)Ac -+ H 2OHAc + OH - NH 4++H 2O NH 3 + H 3+O④同离⼦效应(离⼦酸、离⼦碱之间的酸碱反应)(也是质⼦传递反应)H3O ++Ac -HAc + H 2O酸1 碱2 酸2 碱1三、酸碱的强度指酸给出质⼦的能⼒和碱接受质⼦的能⼒。