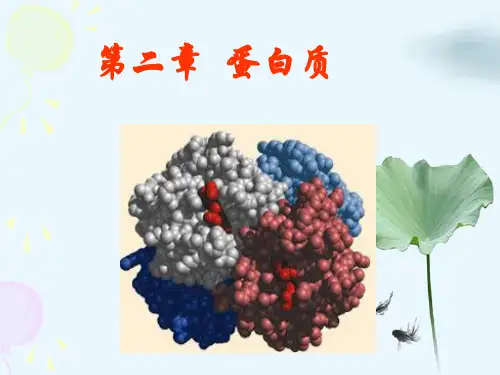
生物化学总结 蛋白质
- 格式:doc
- 大小:3.34 MB
- 文档页数:3

简单蛋白质:完全由氨基酸构成的蛋白质结合蛋白质:由AAs和其他非蛋白质化合物所组成球状蛋白质:多肽链能够折叠,使分子外形成为球状的蛋白质。
纤维状蛋白质:能够聚集为纤维状或细丝状的蛋白质。
主要起结构蛋白的作用,其多肽链沿一个方向伸展或卷曲,其结构主要通过多肽链之间的氢键维持。
单体蛋白质:仅含有AAs寡聚蛋白质:由两个以上、十个以下亚基或单体通过非共价连接缔合而成的蛋白质。
等电点:蛋白质或两性电解质(如氨基酸)所带净电荷为零时溶液的pH,此时蛋白质或两性电解质在电场中的迁移率为零。
符号为pI。
氨基酸残基:在多肽链中的氨基酸,由于其部分基团参与了肽键的形成,剩余的结构部分则称氨基酸残基。
它是一个分子的一部分,而不是一个分子。
氨基酸的氨基上缺了一个氢,羧基上缺了一个羟基。
简单的说,氨基酸残基就是指不完整的氨基酸。
一个完整的氨基酸包括一个羧基(—COOH),一个氨基(—NH2),一个H,一个R基。
缺少一个部分都算是氨基酸残基,并没有包括肽键的。
钛键:氨基和羧基脱去一分子水形成的化学键。
钛键平面:肽键所在的酰胺基成为的刚性平面。
由于肽键具有部分双键性质,使得肽基的六个原子共处一个平面,称为肽平面。
同源蛋白质:在不同有机体中实现同一功能的蛋白质。
(结构和功能类似的蛋白质。
)蛋白质一级结构:蛋白质多肽链的氨基酸通过肽键连接形成的线性序列。
蛋白质二级结构:指多肽链借助H键折叠盘绕成沿一维方向具有周期性结构的构象。
构象:分子的三维结构即分子中的所有原子在空间的位置总和。
构型:分子中的原子在空间的相对取向。
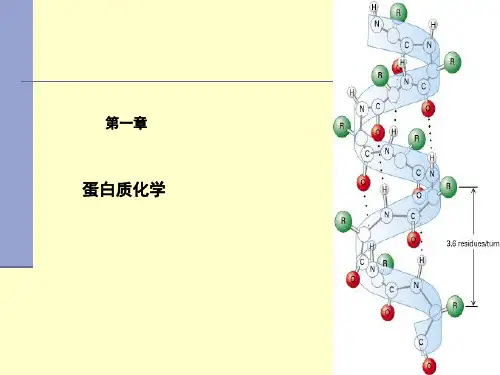
α-螺旋:它是蛋白质当中最为常见、最丰富的二级结构。
多肽主链沿中心轴盘绕成右手或左手螺旋;每个螺旋周期有3.6个氨基酸残基,螺距0.54nm,螺旋直径0.5nm;氨基酸残基侧链伸向外侧;同一肽链上的每个残基的酰胺氢原子和位于它后面的第4个残基上的羰基氧原子之间形成氢键,并且与螺旋轴保持大致上的平行。
此外,肽键上的酰胺氢和羰基氧既能形成内部氢键,也能与水分子形成外部氢键。

蛋白质化学复习总结1、蛋白质概念:是由20种α-氨基酸通过肽键相互连接而成的具有特定空间构象和生物学活性的高分子有机化合物。
几乎所有的酶都是蛋白质。
2、各种蛋白质的含氮量很接近,平均含氮16%(凯氏定氮),粗蛋白质含量=蛋白氮(样品含氮量)×6.25。
3、氨基酸(amino acids)是蛋白质的基本组成单位。
组成蛋白质的标准氨基酸有20种,19种氨基酸具有一级氨基(-NH2)和羧基(-COOH)结合到α碳原子(Cα),同时结合到(Cα)上的是H原子和各种侧链;Pro具有二级氨基(α-亚氨基酸),各种氨基酸的差别在于侧链R基的不同。
4、20种氨基酸都属于L-构型。
20种氨基酸平均分子量为138。
5、氨基酸的分类:⑴根据R的化学结构:①脂肪族氨基酸;②芳香族氨基酸;③杂环氨基酸;④杂环亚氨基酸。
⑵根据R的极性:①非极性氨基酸;②极性、不带电荷氨基酸;③酸性氨基酸;④碱性氨基酸。
6、一般物理学性质:①形态:均为白色结晶或粉末,不同氨基酸的晶型结构不同。
②溶解性:一般都溶于水,不溶或微溶于醇,不溶于丙酮,在稀酸和稀碱中溶解性好。
③熔点:氨基酸的熔点一般都比较高,一般都大于200℃,超过熔点以上氨基酸分解产生胺和二氧化碳。
④旋光性:除甘氨酸外的氨基酸均有旋光性。
⑤光吸收:氨基酸在可见光范围内无光吸收,在近紫外区含苯环氨基酸有光的吸收。
⑥紫外吸收:蛋白质在280nm波长下的紫外吸收性质绝大部分是由色氨酸和酪氨酸所引起的。
色氨酸:279nm苯丙氨酸;259nm;酪氨酸:275nm。
7、氨基酸的化学性质:⑴两性解离(amphoteric ionization):氨基酸在水溶液中或在晶体状态时都以两性离子形式存在,在同一个氨基酸分子上带有能放出质子的-NH3+正离子和能接受质子的-COO-负离子,所以氨基酸为两性电解质。
氨基酸在酸性环境中,主要以阳离子的形式存在,在碱性环境中,主要以阴离子的形式存在。

生物化学知识点总整理一、蛋白质1.蛋白质的概念:由许多氨基酸通过肽键相连形成的高分子含氮化合物,由C、H、O、N、S元素组成,N的含量为16%。
2.氨基酸共有20种,分类:非极性疏水R基氨基酸、极性不带电荷R基氨基酸、带正电荷R基氨基酸(碱性氨基酸)、带负电荷R基氨基酸(酸性氨基酸)、芳香族氨基酸。
3.氨基酸的紫外线吸收特征:色氨酸和酪氨酸在280纳米波长附近存在吸收峰。
4.氨基酸的等电点:在某一PH值条件下,氨基酸解离成阳离子和阴离子的趋势及程度相同,溶液中氨基酸的净电荷为零,此时溶液的PH值称为该氨基酸的等电点;蛋白质等电点:在某一PH值下,蛋白质的净电荷为零,则该PH值称为蛋白质的等电点。
5.氨基酸残基:氨基酸缩合成肽之后氨基酸本身不完整,称为氨基酸残基。
6.半胱氨酸连接用二硫键(—S—S—)7.肽键:一个氨基酸的α-羧基与另一个氨基酸α-氨基脱水缩合形成的化学键。
8.N末端和C末端:主链的一端含有游离的α氨基称为氨基端或N端;另一端含有游离的α羧基,称为羧基端或C端。
9.蛋白质的分子结构:(1)一级结构:蛋白质分子内氨基酸的排列顺序,化学键为肽键和二硫键;(2)二级结构:多肽链主链的局部构象,不涉及侧链的空间排布,化学键为氢键,其主要形式为α螺旋、β折叠、β转角和无规则卷曲;(3)三级结构:整条肽链中,全部氨基酸残基的相对空间位置,即肽链中所有原子在三维空间的排布位置,化学键为疏水键、离子键、氢键及范德华力;(4)四级结构:蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用。
10.α螺旋:(1)肽平面围绕Cα旋转盘绕形成右手螺旋结构,称为α螺旋;(2).螺旋上升一圈,大约需要 3.6个氨基酸,螺距为0.54纳米,螺旋的直径为0.5纳米;(3).氨基酸的R基分布在螺旋的外侧;(4).在α螺旋中,每一个肽键的羰基氧与从该羰基所属氨基酸开始向后数第五个氨基酸的氨基氢形成氢键,从而使α螺旋非常稳定。


生物化学蛋白质章节考点总结第三章蛋白质第一节蛋白质概论蛋白质是所有生物中非常重要的结构分子和功能分子,几乎所有的生命现象和生物功能都是蛋白质作用的结果,因此,蛋白质是现代生物技术,尤其是基因工程,蛋白质工程、酶工程等研究的重点和归宿点。
一、蛋白质的化学组成与分类1、元素组成碳 50% 氢7% 氧23% 氮16% 硫 0-3% 微量的磷、铁、铜、碘、锌、钼凯氏定氮:平均含氮16%,粗蛋白质含量=蛋白氮?6.252、氨基酸组成从化学结构上看,蛋白质是由20种L-型α氨基酸组成的长链分子。
3、分类(1)、按组成:简单蛋白:完全由氨基酸组成结合蛋白:除蛋白外还有非蛋白成分(辅基)详细分类,P 75 表 3-1,表 3-2。
(注意辅基的组成)。
(2)、按分子外形的对称程度:球状蛋白质:分子对称,外形接近球状,溶解度好,能结晶,大多数蛋白质属此类。
纤维状蛋白质:对称性差,分子类似细棒或纤维状。
(3)、功能分:酶、运输蛋白、营养和贮存蛋白、激素、受体蛋白、运动蛋白、结构蛋白、防御蛋白。
4、蛋白质在生物体内的分布含量(干重) 微生物 50-80%人体 45%一般细胞 50%种类大肠杆菌 3000种人体 10万种1012 生物界 10-10,二、蛋白质分子大小与分子量蛋白质是由20种基本aa组成的多聚物,aa数目由几个到成百上千个,分子量从几千到几千万。
一般情况下,少于50个aa的低分子量aa多聚物称为肽,寡肽或生物活性肽,有时也罕称多肽。
多于50个aa的称为蛋白质。
但有时也把含有一条肽链的蛋白质不严谨地称为多肽。
此时,多肽一词着重于结构意义,而蛋白质原则强调了其功能意义。
P 76 表3-3 (注意:单体蛋白、寡聚蛋白;残基数、肽链数。
)蛋白质分子量= aa数目*110对于任一给定的蛋白质,它的所有分子在氨基酸组成、顺序、肽链长度、分子量等方面都是相同的,均一性。
三、蛋白质分子的构象与结构层次蛋白质分子是由氨基酸首尾连接而成的共价多肽链,每一种天然蛋白质都有自己特有的空间结构,这种空间结构称为蛋白质的(天然)构象。

蛋白质(protein)蛋白质(protein)是生活细胞内含量最丰富、功能最复杂的生物大分子,并参与了几乎所有的生命活动和生命过程。
因此,研究蛋白质的结构与功能始终是生命科学最基本的命题。
可以说没有蛋白质就没有生命。
蛋白质的分离纯化是研究其结构与功能的基础。
在生物制药工业中,Pro、酶、多肽类激素等药物生产制备都涉及到Pro分离纯化的问题。
Pro分离纯化的工艺过程,既要考虑尽可能的除去杂蛋白,又要保持目的蛋白的产量,也就是要提高回收率。
一、蛋白质的提取1、材料的选择:选择材料的原则是选取新鲜、富含所需Pro的材料。
2、组织细胞的破碎:不同来源的组织细胞、其批破碎方法不同。
动物来源:可用电动捣碎机、匀浆器、超声波处理。
植物来源:植物组织或细胞(具有纤维素、半纤维素和果胶等物质),在研磨过程中加入一定量的石英沙或用纤维素酶处理。
细菌来源:细菌的细胞壁含肽聚糖,较为坚韧。
破碎方法有:超声波震荡、压榨、溶菌酶处理(分解肽聚糖)或用表面活性剂处理。
例如:三角酵母提取D-氨基酸氧化酶,用TritonX-100作用细胞壁,改变细胞膜通透性,使酶释放出来。
3、提取:组织细胞破碎后,选择适当的介质(一般用缓冲液)把所要的提出出来,在提取过程中应尽量防止细胞内蛋白酶对目的Pro的降解。
二、蛋白质的分离与提取从组织细胞中提取的Pro溶液,含有许多不同分子量的Pro,要获取目的蛋白,须进一步分离纯化,将目的Pro与其它Pro分开。
这里介绍几种根据Pro在溶液中的性质进行分离混合蛋白的方法。
(一)根据溶解度不同的分离纯化利用各种Pro的溶解度差异进行分离。
影响Pro溶解度的因素有PH值、离子强度、溶液的介电常数等,各种Pro的溶解度取决于它们的分子结构,如:氨基酸组成、极性和非极性基团的多少等。
1、等电点沉淀:Pro在PI使溶解度最小,此方法常与其它分离方法配合使用。
2、盐析沉淀:不同Pro可通过加入不同饱和度的中式盐分别沉淀出来(即分级沉淀)。


生物化学知识点总结一、生物大分子1. 蛋白质蛋白质是生物体内功能最为多样的大分子化合物,其分子量从几千到上百万不等。
蛋白质是由氨基酸通过肽键连接而成的,其结构包括一级结构、二级结构、三级结构和四级结构。
蛋白质的功能包括酶、结构蛋白、免疫蛋白等。
在生物体内,蛋白质不断地受到合成和降解的调控。
2.核酸核酸也是生物体内非常重要的大分子,主要包括DNA和RNA。
DNA是生物遗传信息的分子载体,其双螺旋结构具有很高的稳定性,基因组里的信息以DNA的形式存在,RNA则是DNA的复制和表达过程中的关键参与者。
核酸的功能包括遗传信息的传递、蛋白质的合成控制等。
3.多糖多糖是由多个单糖分子经由糖苷键链接而成的高分子化合物。
生物体内包括多种多糖类物质,如纤维素、淀粉、糖原、聚合葡萄糖和壳多糖等。
在生物体中,多糖具有贮存能量、提供结构支持以及信号识别等生理功能。
4.脂质脂质是一类疏水性的生物大分子,其结构包括脂类、脂肪酸、甘油和磷脂等。
脂质在细胞膜的形成和维护、能量的储存和释放以及信号转导等生理过程中扮演着重要的角色。
二、酶和酶动力学1. 酶的结构和功能酶是生物体内催化生物化学反应的分子,在酶的作用下,生物体内的化学反应可以以更快的速度进行。
酶的结构包括活性位、辅基和蛋白质结构。
酶的功能包括催化特定的反应、特异性和高效性等。
2. 酶动力学酶动力学研究的是酶催化反应的速率和反应机理。
酶动力学参数包括最大反应速率(Vmax)、米氏常数(Km)、酶的抑制和激活等。
酶动力学研究为理解生物化学反应提供了重要的信息。
三、生物体内代谢途径糖代谢包括糖异生途径、糖酵解途径、糖原代谢和半乳糖代谢等,主要在细胞内进行,产生能量和代谢产物。
2. 脂质代谢脂质代谢包括脂质合成、脂质分解、脂蛋白代谢和胆固醇代谢等,涉及到脂肪酸、三酰甘油、磷脂和胆固醇等的合成和降解过程。
3. 氨基酸代谢氨基酸代谢包括氨基酸合成、氨基酸降解、氨基酸转运等,对于蛋白质的降解和合成具有重要的作用,同时参与许多代谢途径。

第一章蛋白质的结构与功能一、名词解释肽键:一个氨基酸的a--羧基与另一个氨基酸的a--氨基脱水缩合所形成的结合键,称为肽键.等电点:蛋白质分子净电荷为零时溶液的pH值称为该蛋白质的等电点.蛋白质的一级结构:是指多肽链中氨基酸的排列顺序.三、填空题1,组成体内蛋白质的氨基酸有20种,根据氨基酸侧链R的结构和理化性质可分为①非极性侧链氨基酸;②极性中性侧链氨基酸:;③碱性氨基酸:赖氨酸、精氨酸、组氨酸;④酸性氨基酸:天冬氨酸、谷氨酸.3,紫外吸收法280 nm定量测定蛋白质时其主要依据是因为大多数可溶性蛋白质分子含有色氨酸, 苯丙氨酸,或酪氨酸.5,蛋白质结构中主键称为肽键,次级键有氢键、离子键、疏水作用键、范德华力、二硫键等,次级键中属于共价键的有范德华力、二硫键第二章核酸的结构与功能一、名词解释DNA的一级结构:核酸分子中核苷酸从5’-末端到3’-末端的排列顺序即碱基排列顺序称为核酸的一级结构.DNA双螺旋结构:两条反向平行DNA链通过碱基互补配对的原则所形成的右手双螺旋结构称为DNA的二级机构.三、填空题1,核酸可分为 DNA 和 RNA 两大类,前者主要存在于真核细胞的细胞核和原核细胞拟核部位,后者主要存在于细胞的细胞质部位2,构成核酸的基本单位是核苷酸 ,由戊糖、含氮碱基和磷酸 3个部分组成6,RNA中常见的碱基有腺嘌呤、鸟嘌呤,尿嘧啶和胞嘧啶7,DNA常见的碱基有腺嘌呤、鸟嘌呤、胸腺嘧啶和胞嘧啶四、简答题1,DNA与RNA 一级结构和二级结构有何异同4,叙述DNA双螺旋结构模式的要点.DNA双螺旋结构模型的要点是:1,DNA是一平行反向的双链结构,脱氧核糖基和磷酸骨架位于双链的外侧,碱基位于内侧,两条链的碱基之间以氢键相交接触.腺嘌呤始终与胸腺嘧啶配对存在,形成两个氢键A=T,鸟嘌呤始终与胞嘧啶配对存在,形成三个氢键G≡C,碱基平面与线性分子的长轴相垂直.一条链的走向是5’→3’,另一条链的走向就一定是3’→5’;2,DNA是一右手螺旋结构;3,DNA双螺旋结构稳定的维系横向靠两条链间互补碱基的氢键维系,纵向则靠碱基平面间的疏水性堆积力维持.第三章酶酶:由活细胞合成的、对其特异底物具有高效催化作用的特殊蛋白质.酶原:无活性的酶的前身物质称为酶原酶原激活:酶原受某种因素作用后,转变成具有活性的酶的过程Km值:是酶促反应速度为最大反应速度一半时的底物浓度,是酶的特征性常数.竞争性抑制作用:抑制剂与酶的正常底物结构相似,抑制剂与底物分子竞争地结合酶的活性中心,从而阻碍酶与底物结合形成中间产物,这种抑制作用称为竞争性抑制作用非竞争性抑制作用:抑制剂与酶活性中心外的其他位点可逆的结合,使酶的空间结构改变,使酶催化活性降低,此种结合不影响酶与底物分子的结合,同时酶与底物的结合也不影响酶与抑制剂的结合.底物与抑制剂之间没有竞争关系,这种抑制作用称为非竞争性抑制作用填空题1,酶是活细胞产生的具有催化作用的蛋白质,是机体内催化各种代谢反应最主要的催化剂.个别核糖核酸RNA也具有酶一样的催化活性,称为核酶.5,由细胞合成和分泌的尚不具有催化活性的酶的前体,叫做酶原9,可逆性抑制作用包括竞争性抑制作用、非竞争性抑制作用和反竞争性抑制作用三种四,简答题1,以酶原的激活为例说明结构与功能的关系.在一定条件下,酶原受某种因素作用后,分子结构发生变化,暴露或形成活性中心,转变成具有活性的酶,这一过程叫做酶原的激活.酶原激活过程说明了蛋白质结构与功能密切相关,结构改变,功能也随之改变,结构破坏,功能丧失.7,酶促反应高效率的机制是什么酶高效催化作用的机制可能与以下几种因素有关:①邻近效应与定向排列:在两个以上底物参与的反应中,底物之间必须以正确的方向互相碰撞,才有可能发生反应.②多元催化:同一种酶兼有酸碱催化作用,这种多功能基团的协同作用可极大的提高酶的催化效率.③表面效应;酶活性中心内部多种疏水性氨基酸,常常形成疏水性“口袋”以容纳并结合底物.一种酶的催化反应不限于上述某一种因素,而常常是多种催化作用的综合机制,这是酶促反应高效的重要原因.第四章糖代谢名词解释1,糖酵解:在不需要氧条件下,葡萄糖经一系列酶促反应生成丙酮酸进而还原生成乳酸的过程称为糖酵解4,三羧酸循环TAC:乙酰辅酶A与草酰乙酸缩合生成柠檬酸,历经4次脱氢及2次脱羧反应,又生成草酰乙酸,此过程是由含有三个羧基的柠檬酸作为起始物的循环反应,故称为三羧酸循环7,糖异生:由非糖物质转变为葡萄糖或糖原的过程称为糖异生9,血糖:血液中的葡萄糖称为血糖.其正常水平为~ mmol/L二、填空题2,人体内主要通过磷酸戊糖途径生成核糖,它是核苷酸的组成成分3,在三羧酸循环中,催化氧化脱羧的酶是异柠檬酸脱氢酶和α-酮戊二酸脱氢酶4,在糖酵解途径中,产物正反馈作用的步骤为 1,6-双磷酸果糖对磷酸果糖激酶- 1 的正反馈调节9, 1 mol 葡萄糖氧化生CO2和 H2O时净生成 30或32 mol ATP15,糖异生的原料有甘油、乳酸和生糖氨基酸19, 糖有氧氧化的反应过程可分为三个阶段,即糖酵解途径、丙酮酸进入线粒体氧化脱羧成乙酰CoA,乙酰CoA进入三羧酸循环及氧化磷酸化.四、简答1,糖酵解的主要生理意义是什么①是机体在缺氧条件下供应能量的重要方式;②是某些组织细胞的主要供能方式;③糖酵解的产物为某些物质合成提供原料;④红细胞中经糖酵解途径生成的2,3-BPG可调节血红蛋白的带氧功能2糖有氧氧化的主要生理意义是什么①是机体获得能量的主要方式;②三羧酸循环是三大营养物质彻底氧化分解的共同途径;③三羧酸循环是三大物质代谢互相联系、互相转化的枢纽20,简述乳酸循环的生理意义肌肉组织中不存在葡萄糖-6-磷酸酶,因此不能将肌糖原分解为葡萄糖.肌肉组织中糖异生酶类活性也较低,没有足够的能力进行糖异生作用.当氧供应不足时,肌肉组织糖酵解加强,必然导致乳酸生成增多,通过乳酸循环将有助于乳酸的再利用,并防止因乳酸堆积导致中毒.第五章脂类代谢名词解释1,必需脂肪酸:亚油酸、亚麻酸、花生四烯酸等维持机体生命活动所必需,但体内不能合成,必须由食物提供的脂肪酸,称为必需脂肪酸2,脂肪动员:储存在脂肪细胞中的脂肪,经脂肪酶逐步水解为甘油和脂肪酸,并释放入血供全身各组织氧化利用的过程称为脂肪动员3,脂肪酸β-氧化:脂肪酸的β-氧化是从脂酰基的β-原子开始,进行脱氢、加水、再脱氢及硫解四步连续的反应,将脂酰基断裂生成一分子乙酰CoA和比原来少两个碳原子的脂酰CoA的过程.4,酮体:酮体包括乙酰乙酸、β-羟丁酸和丙酮,是脂肪酸在肝内分解产生的特有正常中间产物.二、填空题1,乙酰辅酶A是合成脂肪酸的主要原料,脂肪酸的合成是在细胞液内进行,反应中所需的NADPH来自磷酸戊糖途径.2,脂肪酸β-氧化过程中的第一次脱氢由FAD 接受,第二次脱氢由NAD+接受. 4,脂肪酸β-氧化过是在细胞的线粒体中而脂肪的合成是在细胞的内质网中进行的.5,脂肪酸β-氧化的过程包括脱氢、水化、再脱氢和硫解四个连续反应步骤9,血脂的主要来源有食物物中脂类、体内合成和脂库中脂肪动员的释放. 10,血脂的主要去路有氧化供能、进入脂库中储存构成生物膜和转变为其他物质15,酮体合成的原料为乙酰辅酶A20,脂肪动员的产物为甘油和脂肪酸23,酮体是在肝内生成,肝外组织利用.和 7 分子NADH+H, 8 28,软脂酸的β-氧化,共进行 7次,生成 7 分子FADH2乙酰CoA,净生成129 分子ATP.四、简答题1,何谓酮体酮体是怎样生成的,又是如何氧化利用的酮体的生成包括乙酰乙酸、β-羟丁酸和丙酮. 酮体的生成部位在肝细胞线粒体,合成原料为脂肪酸β-氧化生成的乙酰CoA,2分子乙酰CoA缩合生成乙酰乙酸CoA,乙酰乙酸CoA再与1分子乙酰CoA缩合生成NMGCoA,催化此反应的 NMGCoA 合成酶是酮体合成的限速酶,NMGCoA 裂解生成乙酰乙酸和乙酰CoA ,乙酰乙酸还原生成β-羟丁酸或脱羧生成丙酮.肝能生成酮体,但不能利用酮体. 肝外组织的乙酰乙酸经过乙酰乙酸硫激酶或琥珀酰CoA 转硫酶及硫解酶的催化下,转变成乙酰CoA并进入三磷酸循环而被氧化利用,丙酮可经肾、肺排出.2,简述硬脂酸的氧化过程及彻底氧化的能量计算.必考硬脂酸的氧化可分为活化、进入线粒体、β-氧化及乙酰CoA的彻底氧化四个阶段.①,硬脂酸在胞液中进行,由脂酰CoA合成酶催化形成脂酰CoA.②,活化的硬脂酰CoA经CAT I 及 CAT II的催化,以肉碱为载体,由胞液进入线粒体基质.CAT I 是脂肪酸β-氧化的限速酶.③,脂酰CoA进入线粒体基质后,在脂肪酸β-氧化多酶复合体的催化下,从脂酰基的β-碳原子开始,进行脱氢、加水、再脱氢和硫解四步连续反应,脂酰基断裂生成一分子乙酰CoA和一分子比原来少二个碳原子的脂酰CoA.如此反复进行,直到脂酰CoA 全部生成乙酰CoA.④乙酰CoA通过三磷酸循环彻底氧化成CO2和H2O,并释放出能量.能量计算:硬脂酸18C -2ATP 硬脂酰CoA 8次β氧化 9乙酰CoA +8FADH2+NADH +H+8 FADH2 X ATP∕FADH2= 12 ATP8 NADH + H+ X ATP ∕NADH + H+ = 20 ATP9 CH3CO~SCoA X 10 ATP∕CH3CO~SCoA =90 ATP故一分子硬脂酸彻底氧化生成CO2 和 H2O 净生成90 + 32-2=120 ATP第六章生物氧化名词解释1,生物氧化:营养物质在体内氧化分解为CO2和H2O,并逐步释放能量的过程成为生物氧化5,呼吸链:位于线粒体内膜上起生物氧化作用的一系列递氢体或递电子体,它们按一定的顺序排列在内膜上,与细胞摄取氧的呼吸过程有关,故称呼吸链三、填空题1,由递氢体和递电子体按一定的顺序组成的整个体系位于线粒体内膜,通常称为呼吸链.2,生物氧化的主要产物是H2OCO2ATP.6,线粒体内两条重要的呼吸链为 NADH 呼吸链和琥珀酸呼吸链,两条链的汇合点是CoQ13,NADH 在细胞内的线粒体和胞液内产生,在线粒体内氧化并产生ATP14,NADH 呼吸链中氧化磷酸化发生的部位在NADH→CoQ之间,Cytb →CytC之间 Cytaa3→O2之间四,简答题3,试述呼吸链的组成成分及功能并写出体内两条主要呼吸链的传递链呼吸链的组成成分:①NAD+为辅酶的脱氢类,其作用为递氢体作用;②黄素蛋白,其辅酶为FMN或FAD,其作用为递氢体;③铁硫蛋白,其作用为递电子体;④CoQ其作用是递氢体;⑤细胞色素体系包括b-c1-c –aa3,其功能为递电子体.NADH氧化呼吸链顺序为:SH2→NAD+→FMN-Fe-S → COQ →Cytb-c1-caa3→O2. FADH2氧化呼吸链顺序为SH2→FAD-Fe-S →CoQ →Cytb-c1-c-aa3 →O2第七章氨基酸代谢名词解释2.联合脱氨基作用:由转氨酶催化的转氨基作用和L-谷氨酸脱氢酶催化的谷氨酸氧化脱氨基作用联合进行.9.必需氨基酸:体内不能合成必需由食物提供的氨基酸.填空题5,氨基酸的脱氨基方式有:转氨基、氧化脱氨基、联合脱氨基和嘌呤核苷酸循环8,血氨的去路有:合成尿素、合成谷氨酰胺、转为非必需氨基酸16,生成一碳单位的氨基酸有组氨酸、甘氨酸、丝氨酸、蛋氨酸.17,一碳单位主要形式有 -CH=NH、-CHO、-CH、-CH2、-CH3.简答题1,简述血氨的来源和去路.答:来源:氨基酸脱氨基、肠道吸收、肾产生.去路:合成尿素、重新合成氨基酸合成其它含氮化合物.8,何谓鸟氨酸循环有何生理意义鸟氨酸循环是指鸟氨酸与氨基甲酰磷酸反应生成瓜氨酸,瓜氨酸再与另一分子氨生成精氨酸,精氨酸在肝精氨酸酶的催化下水解生成尿素和鸟氨酸.鸟氨酸可再重复上述过程,如此循环一次,2分子氨和1分子CO2变成1分子尿素.在鸟氨酸循环的过程中,精氨酸代琥珀酸合成酶为限速酶,此步反应是一个耗能反应.鸟氨酸循环在线粒体和胞浆中进行.生理意义:肝脏通过鸟氨酸循环将有毒的氨转变成无毒的尿素,经肾排除体外.这是肝的一个重要生理功能,其意义在于解除氨毒.第九章物质代谢的联系与调节名词解释1.限速酶或调解酶:关键酶都是一些催化单向反应的酶,通常是催化整条途径的第一步反应,也可催化整条途径的反应速率最慢的一个反应,起着限制或调控整个代谢进行调速的作用.填空题4.饥饿时机体血液中浓度升高的物质是脂肪酸、葡萄糖 .5,大脑平时及饥饿时的主要供能物质是血糖、酮体 .6,线粒体中分布的多酶体系主要有三羧酸循环、脂肪酸β-氧化、氧化磷酸化 .简答题1.物质代谢的特点.答:整体性;代谢的调节性;各组织器官物质代谢各具特色;各种物质代谢均具有共同的代谢池;ATP是机体能量的共同形式;NADPH是合成代谢所需的还原当量.第十章 DNA的生物合成名词解释2.半保留复制:半保留复制指DNA复制过程,双螺旋解开成单链各自作为模板合成与其互补的子链,从一个亲代DNA双螺旋复制出两个与亲代完全相同的子代DNA,子代DNA中的一条DNA链来自亲代,另一条链是新合成的复制方式.5.冈崎片段:指复制中随从链上合成的不连续DNA片段.填空题2,所有的冈崎片段链的增长都是按 5'→3' 方向进行的.3.前导链的合成是连续的 ,合成方向和复制叉移动的方向相同;随从链的合成是不连续的 ,合成方向和复制叉移动的方向相反.8.能引起DNA分子损伤的主要理化因素有紫外线、电离辐射、化学诱变剂 . 3.DNA半保留复制的意义是什么答:生物的遗传特性就蕴藏在DNA分子的一级结构,即碱基排列顺序中,而子细胞的DNA分子是经半保留复制方式得到的,其一级结构与母细胞DNA分子完全相同.因此,通过半保留复制,生物就能保证其遗传特性代代相传,保持相对稳定,这是遗传保守性的分子基础.第十一章 RNA 的生物合成转录名词解释1,转录:以DNA一条单链为模板,四种NTP为原料,在DNA指导的RNA聚合酶作用下,按照碱基互补原则合成RNA链的过程,称为转录.4,模板链:转录时,结构基因的DNA双链中仅一条链为转录的模板,另一条链无转录功能,故前者叫做转录的模板链.5,编码链:转录时,结构基因的DNA双链中有一条链不作为转录的模板,无转录功能.因该DNA链的走行方向和碱基排列顺序与转录生成的RNA链基本相同,只是前者碱基中的T在后者为U而已,故称其为编码连.15,外显子:在断裂基因及其初级转录产物上出现,并表达为成熟RNA 的核酸序列.16,内显子:隔断基因的线性表达而在剪接过程中被除去的核酸序列.三、填空题1,RNA的转录过程的特点是不对称转录2,具有指导转录作用的DNA 链称为模板链 ,与之互补的另一条DNA 链称为编码连5,真核生物 mRNA 的5’帽子结构是 m7GpppG- ,其3’末端有polyA结构四、简答题1,简述DNA复制与RNA 转录合成的主要区别2,简述原核生物中RNA转录合成的基本过程原核生物中RNA转录合成的基本过程:1)转录的起始:首先由RNA聚合酶的σ亚基辨认启动子,并促使RNA聚合酶全酶与启动子结合,然后RNA聚合酶使DNA 局部解链.接着,RNA 聚合酶催化第一个磷酸二脂键形成.2)转录的延伸:RNA 链的延伸过程中由核心酶催化.3)转录的终止:有两种方式.自动终止和依赖ρ因子的终止.第十二章蛋白质的合成名词解释1,翻译:是细胞内以mRNA为模板,按照mRNA分子中由核苷酸组成的密码信息合成蛋白质的过程.5,遗传密码或三联密码:mRNA 分子中每三个相邻的核苷酸组成一组,形成三联体,在蛋白质生物合成时,代表一种氨基酸信息,称为遗传密码或密码子13,进位或注册:根据mRNA 下一组遗传密码指导,使相应氨基酰-tRNA进入并结合到核糖体A位的过程称为进位.填空题1,翻译的直接模板是mRNA ;间接模板是DNA2,蛋白质合成的原料是氨基酸 ,细胞中合成蛋白质的场所是核蛋白体. 4,mRNA是指导翻译的直接模板, 蛋白质是基因表达的最终产物.10,原核生物的起始密码子只能辨认甲酰化的甲硫氨酸.简答题1,论述遗传密码的特点.模板从mRNA5’端的起始密码开始.到3’端称为开放读码框架.在框架内每3个碱基组成一个密码子,体现一个氨基酸的信息.遗传密码共64个,其中,61个密码分别代表各种氨基酸.3个为肽链合成的终止信号.遗传密码特点:1,连续性;2,密码的简并性;3,摆动性;4,通用性3,简述蛋白质生物合成的基本过程.蛋白质生物合成的基本过程:1)氨基酸的活化与转运:由氨基酰tRNA合成酶催化,ATP供能,使氨基酸的羧基活化并与相应的tRNA连接.2)核糖体循环:为蛋白质合成的中心环节,通常将其分为肽链合成的开始、延长和终止三个阶段.3)翻译后的加工:指从核糖体上释放出来的多肽链,经过一定的加工和修饰转变成具有一定构象和功能的蛋白质的过程.第十三章肝的生物化学名词解释2,生物转化作用:来自体内外的非营养物质在肝进行氧化、还原、水解和结合反应,这一过程称为肝的生物转化作用3,胆汁酸:存在于胆汁中一大类胆烷酸的总称,以钠盐或钾盐的形式存在,即胆汁酸盐,简称胆盐6,胆汁酸肠肝循环:是胆汁酸随胆汁排入肠腔后,通过重吸收门静脉又回到肝,在肝内转变为结合型的胆汁酸,经肠道再次排入肠腔的过程.填空题1,生物转化的第一相反应包括氧化、还原和水解反应 ,第二相反应是结合反应.5,胆色素是铁卟啉化合物在体内分解代谢的产物,包括胆色素等多种化合物,其代谢障碍会导致黄疸.简答题2,何谓生物转化作用有何生理意义肝对进入体内的非营养物质在肝进行氧化、还原、水解和结合反应,这一过程称为肝的生物转化作用意义:生物转化的生理意义在于它将体内的非营养物质进行转化,使生物活性物质的生物学活性降低或消失,或使有毒物质的毒性降低或消失.更重要的是生物转化可将这些物质的溶解性增高,变为易于从胆汁或尿液中排出体外的物质.生物化学解答题1计算一分子软脂酸C15H31COOH彻底氧化成CO2和H2O, 产生多少ATP12分氧化过程:脂肪酸β-氧化,经脱氢、水化、再脱氢、硫解四步反应,产生乙酰CoA和比原来脂酰辅酶A少两个碳原子的脂酰CoA.新生成的脂酰辅酶A再经上述四个反应,最终全部转化为乙酰CoA.乙酰CoA再进入三羧酸循环TCA循环,最后形成二氧化碳和水.步骤:7次-氧化分解产生5×7=35分子ATP;2分8分子乙酰CoA可得12×8=96分子ATP; 2分一分子软脂酸C15H31COOH彻底氧化分解可生成:()[]()ATP m ol 1288122732=⨯+-⨯+2分2 DNA 双螺旋结构有什么基本特点这些特点能解释哪些最重要的生命现象 答案要点:a. 两条反向平行的多聚核苷酸链沿一个假设的中心轴右旋相互盘绕而形成,螺旋表面有一条大沟和一条小沟.2分b. 磷酸和脱氧核糖单位作为不变的骨架组成位于外侧,作为可变成分的碱基位于内侧,链间碱基按A-T 配对,之间形成2个氢键,G-C 配对,之间形成3个氢键碱基配对原则,Chargaff 定律.2分c. 螺旋直径2nm,相邻碱基平面垂直距离,螺旋结构每隔10个碱基对重复一次,间隔为.2分该模型揭示了DNA 作为遗传物质的稳定性特征,最有价值的是确认了碱基配对原则,这是DNA 复制、转录和反转录的分子基础,亦是遗传信息传递和表达的分子基础.该模型的提出是本世纪生命科学的重大突破之一,它奠定了生物化学和分子生物学乃至整个生命科学飞速发展的基石.3什么是遗传密码简述其基本特点1.遗传密码子codon :存在于信使RNA 中的三个相邻的核苷酸顺序,是蛋白质合成中某一特定氨基酸的密码单位.密码子确定哪一种氨基酸参入蛋白质多肽链的特定位置上;共有64个密码子,其中61个是氨基酸的密码子,3个是作为终止密码子1分.2,其特点有:①方向性:编码方向是5ˊ→3ˊ.②无标点性:密码子连续排列,既无间隔又无重叠.③简并性:除了Met和Trp各只有一个密码子之外,其余每种氨基酸都有2—6个密码子.④通用性:不同生物共用一套密码.⑤摆动性:在密码子与反密码子相互识别的过程中密码子的第一个核苷酸起决定性作用,而第二个、尤其是第三个核苷酸能够在一定范围内进行变动.4影响酶促反应的因素有哪些pH、温度、紫外线、重金属盐、抑制剂、激活剂等通过影响酶的活性来影响酶促反应的速率,1紫外线、重金属盐、抑制剂都会降低酶的活性,使酶促反应的速度降低,2激活剂会促进酶活性来加快反应速度,3pH和温度的变化情况不同,既可以降低酶的活性,也可以提高,所以它们既可以加快酶促反应的速度,也可以减慢;4酶的浓度、底物的浓度等不会影响酶活性,但可以影响酶促反应的速率.酶的浓度、底物的浓度越大,酶促反应的速度也快.5简述DNA复制的基本规律. 6分1半保留复制:复制时,母链的双链DNA解开成两股单链,各自作为模板指导子代合成新的互补链.子代细胞的DNA双链,其中一股单链从亲代完整地接受过来,另一股单链则完全重新合成.由于碱基互补,两个子细胞的DNA双链,都和亲代母链DNA碱基序列一致.这种复制方式称为半保留复制分. 2双向复制:复制时,DNA从起始点origin向两个方向解链,形成两个延伸方向相反的复制叉,称为双向复制.原核生物是单个起始点的双向复制,真核生物是多个起始点的双向复制分.3半不连续性复制: DNA双螺旋的两条链是反平行的,而DNA合成的方向只能是5ˊ→3ˊ .在DNA复制时,1条链的合成方向和复制叉的前进方向相同,可以连续复制,叫作前导链;而另一条链的合成方向和复制叉的前进方向正好相反,不能连续复制,只能分成几个片段冈崎片段合成,称之为滞后链.领头链连续复制而随从链不连续复制,就是复制的半不连续复制.分.4复制的高保真性: DNA复制的精确度极高,误差率很低,高保真性的机制分.6简述基因突变有哪几种形式6分1. 转换:发生在同型碱基之间,即嘌呤代替另一嘌呤,或嘧啶代替另一嘧啶分.2.颠换:发生在异型碱基之间,即嘌呤变嘧啶或嘧啶变嘌呤分.3. 缺失:一个碱基或一段核苷酸链从DNA大分子上消失分.4.插入:原来没有的一个碱基或一段核苷酸链插入到DNA大分子中间分.7请列举细胞内乙酰CoA的代谢去向,乙酰CoA可进入哪些代谢途径请列出.。
第二章蛋白质蛋白质分类1、根据蛋白质分子的外形,可以将其分作3类。
①球状蛋白质:分子形状接近球形,水溶性较好,种类很多,可行使多种多样的生物学功能。
②纤维状蛋白质:分子外形呈棒状或纤维状,大多数不溶于水,是生物体重要的结构成分,或对生物体起保护作用,如胶原蛋白和角蛋白。
有些可溶于水,在一定的条件下聚集成固态,如血纤维蛋白原。
还有一些与运动机能有关,如肌球蛋白。
有些纤维状蛋白质是由球蛋白聚集形成的,一般归类于球蛋白,如微管蛋白和肌动蛋白。
③膜蛋白质:一般折叠成近球形,插入生物膜,也有一些通过非共价键或共价键结合在生物膜的表面。
生物膜的多数功能是通过膜蛋白实现的。
2、根据分子组成可将蛋白质分为两类。
(1)简单蛋白质:仅由肽链组成,不包含其它辅助成分的蛋白质称简单蛋白质(simple protein),按照溶解度的差别,可将简单蛋白质分为7类,清蛋白、球蛋白、醇溶蛋白、谷蛋白、精蛋白、组蛋白、硬蛋白(2)结合蛋白质:结合蛋白质(conjugated protein)由简单蛋白质和辅助成分组成,其辅助成分通常称为辅基。
根据辅基的不同,结合蛋白质可分为5类:核蛋白、糖蛋白、脂蛋白、色蛋白和金属蛋白。
3、按功能将蛋白质分为10类。
(1)酶:酶是具催化活性的蛋白质,是蛋白质中种类最多的类群,新陈代谢的每一步反应都是由特定的酶催化完成的。
(2)调节蛋白:许多蛋白质具有调控功能,这些蛋白质称为调节蛋白。
其中一类为激素,如调节动物体内血糖浓度的胰岛素,刺激甲状腺的促甲状腺素,促进生长的生长素等。
另一类可参与基因表达的调控,它们能激活或抑制基因的转录或翻译。
(3)贮存蛋白质:有些蛋白的生物功能是贮存必要的养分,称贮存蛋白。
例如,卵清蛋白为鸟类胚胎发育提供氮源。
许多高等植物的种子含高达60%的贮存蛋白,为种子的发芽准备足够的氮素。
铁蛋白能贮存铁原子,用于含铁蛋白如血红蛋白的合成。
(4)转运蛋白质:主要有两类,一类存在于体液中,如血液中的血红蛋白转运氧气,血清蛋白转运脂肪酸。
蛋白质
一、概述
1.蛋白质:一切生物体中普遍存在的,由天然氨基酸通过肽键连接而成的生物大分子;其种类繁多,各具有一定的相对分子质量,复杂的分子结构和特定的生物功能;是表达生物遗传性状的一类主要物质。
2.元素组成:CONH。
基本组成单位:氨基酸(氨基酸通过肽键连接为无分支的长链,该长链又称为多肽链)。
一些蛋白质含有非氨基酸成分.
3.分类:按形状和溶解性:纤维状蛋白质(形状呈细棒或纤维状,多不溶于水);球状蛋白质(形状接近球形或椭球形,可溶于水);膜蛋白(与细胞的各种膜系统结合而存在。
“溶于膜”)。
4.性质:生物大分子;胶体性质;带电性质;溶解性与沉淀;灼烧时可以产生特殊气味;颜色反应;可以被酸、碱或蛋白酶催化水解。
5.为什么加热降低了蛋白质的溶解性?
二、氨基酸
1.α-氨基酸结构:
2.分类:必需/半必需/非必需~~
根据R基团的化学结构:脂肪族/芳香族/杂环~~
根据R基团的极性和带电性质:
a.非极性氨基酸:Gly、Ala、Val、Leu、Ile、Phe、Met、Pro、Trp
b.极性氨基酸:
不带电:Ser、Thr、Tyr、Asn、Gln、Cys;
带正电:His、Lys、Arg;
带负电:Asp、Glu
*非极性氨基酸:R基团为一个氢原子/R基团为脂肪烃/R基团为芳香环。
*不带电荷的极性氨基酸:R基团含有羟基/R基团含有巯基(SH)/R基团含有酰胺基。
*带负电荷的极性氨基酸,R基团带有负电。
*带正电荷的极性氨基酸,R基团带有正电。
3.酸碱化学:氨基酸是两性电解质,氨基酸在水溶液中或在晶体状态时都以不带电形式和兼性离子形式离子形式存在,在同一个氨基酸分子上带有能放出质子的-NH3+正离子和能接受质子的-COO-负离子。
氨基酸完全质子化时,可以看成是多元酸,侧链不解离可看作二元酸(阳离子—兼性离子—阴离子)。
氨基酸的解离常数K1/K2可用测定滴定曲线的实验方法求得,二元酸的滴定曲线可大致分解为2条一元酸的滴定曲线。
4.等电点:在某一pH值下,氨基酸所带正电荷和负电荷相等,即净电荷为零,此时的pH值称为氨基酸的等电点,用pI表示。
氨基酸在等电点时主要以兼性离子形式存在。
当氨基酸所处环境pH值等于该氨基酸等电点时,氨基酸净电荷数等于零,在电场中不能移动;氨基酸在等电点可以解离,解离成阳离子和阴离子的数目和趋势相等。
pI值等于等电兼性离子两边的pK值的算术平均值,pI=(pKa1+pKa2)/2。
5.α-氨基、α-羧基参加的反应:
共同参加的反应:茚三酮显色反应。
二者的聚合反应(成肽反应)。
侧链R基参加的反应:二硫键的形成和打开
6.氨基酸巨星:
Pro—亚氨基酸;影响蛋白质的空间结构和蛋白质的折叠。
Phe,Trp,Tyr—侧链具有芳香环;有特殊的光谱性质,是生物物理学家的宠儿。
Cys—巯基是很活跃的化学基团;在蛋白质内部和蛋白质之间形成二硫键;影响蛋白质的结构和功能。
Asp,Glu,Arg,Lys—侧链带电荷、可解离;影响氨基酸与蛋白质的酸碱性质;参与许多酶的催化作用。
His—侧链可解离;可带正电荷;解离常数接近生物体液pH;供出和接受质子的速率很大;在酶和其它蛋白的功能中具有重要地位。
三、肽
1.一个氨基酸的氨基与另一个氨基酸的羧基之间脱水缩合形成的共价键称为肽键。
两个或两个以上氨基酸通过肽键共价连接形成的聚合物即称为肽,组成肽的氨基酸单元称为氨基酸残基。
2.肽键是一种酰胺键。
由于酰胺氮原子上的孤电子对离域与羰基碳轨道重叠,因此在酰胺氮和羰基氧之间发生共振相互作用。
肽键共振产生几个重要结果:
a.肽键具有部分双键性质。
b.限制绕肽键的自由旋转。
c.组成肽键的4个原子和2个相邻的C原子处于同一酰胺平面。
d.在肽平面内,两个C可以处于顺式构型或反式构型,反式构型比顺式构型稳定,肽链中的肽键绝大多数都是反式构型。
e.肽键具有永久偶极,肽基具有较低的化学反应性。
3.肽链具有方向性:N-端氨基酸残基为起点,C-端氨基酸残基为终点。
4.命名:12~20寡肽,后为多肽。
5.肽的物理和化学性质:小肽的理化性质与氨基酸类似。
肽的酸碱性质与带电性质取决于肽的末端氨基、羧基和侧链上的基团。
肽的等电点可以通过取等电兼性离子两边的pKa的平均值,算出其pI值。
6.双缩脲反应:含有两个或两个以上肽键的化合物都能与CuSO4碱性溶液发生双缩脲反应而生成紫红色或蓝紫色的复合物。
可利用这个反应测定多肽与蛋白质的含量。
7.多肽的人工合成方法:多肽的人工合成有两种类型,一种是由不同氨基酸按照一定顺序排列的控制合成,另一种是由一种或两种氨基酸聚合或共聚合。
四、一级结构
1.每一种天然蛋白质都有自己特有的三维空间结构,这种三维结构通常被称为蛋白质的构象。
一个给定的蛋白质理论上可采取多种构象,但该蛋白质在生理条件下占优势的构象只有一种或很少几种,它们在热力学上是最稳定的,处于这种有生理功能的构象状态的蛋白质称为天然蛋白质
2.一级结构:多肽链的氨基酸序列。
二级结构:多肽链借助氢键排列成的局部规则结构(如α螺旋)。
三级结构:多肽链借助多种非共价键折叠成的特定三维空间结构。
四级结构:指寡聚蛋白质中各亚基之间在空间上的相互关系和结合方式。
3.一级结构包括二硫键的数目和位置。
4.蛋白质的一级结构具有重要意义:
蛋白质的一级结构决定它的高级结构;蛋白质的氨基酸序列是阐明蛋白质生物活性的分子基础;蛋白质序列的多样性是蛋白质结构多样性与功能多样性的基础;氨基酸序列的改变可以导致蛋白结构与功能的改变;信号序列决定蛋白质的细胞定位、化学修饰与寿命;通过对一些蛋白质一级结构(氨基酸序列)的比较可以反映出生物之间的亲缘关系,推演生物的进化。
五、高级结构
1.稳定蛋白质三维结构的作用力主要是一些称为非共价键或次级键的弱相互作用:氢键、范德华力、疏水作用、盐键。
氢键:是稳定蛋白质二级结构的主要作用力,静电作用
范德华力:包括三种弱的作用力:定向效应、诱导效应和分散效应,吸引力和斥力,本质是静电相互作用。
疏水作用:熵驱动。
离子键:正电荷和负电荷之间的一种静电作用。
2.
3.
4.
5.
6.
7.
8.
9.
10.
六、功能
七、研究。