材料科学基础1
- 格式:ppt
- 大小:8.07 MB
- 文档页数:73


材料科学基础期中试题一、名词解释(每小题 1 分,共20 小题20 分)1.材料: 材料是具有一定性能,可以用来制作器件、构件、工具、装置等物品的物质。
2.材料科学: 材料科学就是研究各种材科的成分、工艺、组织和性能之同相互关系的科学。
3.密排方向: 原子排列最密集的晶向。
4.相变: 从一种相到另一种相的转变称为相变。
5.多晶型性: 元素的晶体结构随外界条件的变化而发生转变的性质。
6.中间相: 两组元A 和8 组成合金时,除了可形成以A 为基或以B 为基的固溶体(端际固溶体)外,还可能形成晶体结构与A, B 两组元均不相同的新相。
由于它们在二元相图上的位置总是位于中间,故通常把这些相称为中间相。
7.非晶体: 原子没有长程的周期排列,无固定的熔点,各向同性等。
8.置换固溶体: 将质原子溶入溶剂中形成固溶体时,溶质原子占据溶剂点阵的阵点,或者说溶质原子置换了溶剂点阵的部分溶剂原子,这种固溶体就称为置换固溶体。
9.螺型位错: 位错附近的原子是按螺旋形排列的。
螺型位错的位错线与滑移矢量平行,因此一定是直线。
10.混合位错: 一种更为普遍的位错形式,其滑移矢量既不平行也不垂直于位错线,而与位错相交成任意角度。
可看作是刃型位错和螺型位错的混合形式。
11.组织组成物: 合金显微组织中的独立组成部分。
12.固态相变: 不同固相之间的转变称为固态相变。
13.均匀形核: 新相晶核是在母相中均勾地生成的,即晶核由液相中的一些原子团直接形成,不受杂质粒子或外表面的影响。
14:间隙化合物:非金属(X)和金属(M)原子半径的比值比R X/R M>0.59 时,形成具有复杂晶体结构的相,通常称为间隙化合物。
15.晶格畸变: 点缺陷破坏了原子的平衡状态,使晶格发生扭曲,称晶格畸变。
从而使强度、硬度提高,塑性、韧性下降;电阻升高,密度减小等。
16.共析反应: 由特定成分的单相固态合金,在恒定的温度下,分解成两个新的,具有一定晶体结构的固相的反应。


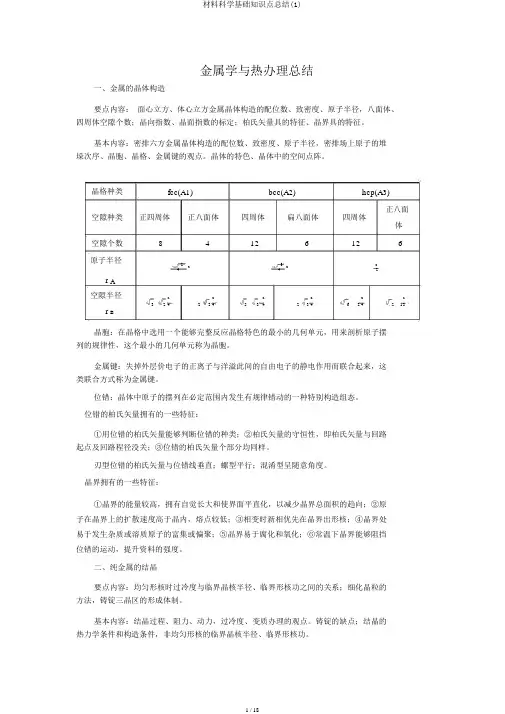
金属学与热办理总结一、金属的晶体构造要点内容:面心立方、体心立方金属晶体构造的配位数、致密度、原子半径,八面体、四周体空隙个数;晶向指数、晶面指数的标定;柏氏矢量具的特征、晶界具的特征。
基本内容:密排六方金属晶体构造的配位数、致密度、原子半径,密排场上原子的堆垛次序、晶胞、晶格、金属键的观点。
晶体的特色、晶体中的空间点阵。
晶格种类fcc(A1)bcc(A2)hcp(A3)空隙种类正四周体正八面体四周体扁八面体四周体正八面体空隙个数84126126原子半径2a3a a442r A空隙半径32a22a53a23a62a21a 444442r B晶胞:在晶格中选用一个能够完整反应晶格特色的最小的几何单元,用来剖析原子摆列的规律性,这个最小的几何单元称为晶胞。
金属键:失掉外层价电子的正离子与洋溢此间的自由电子的静电作用而联合起来,这类联合方式称为金属键。
位错:晶体中原子的摆列在必定范围内发生有规律错动的一种特别构造组态。
位错的柏氏矢量拥有的一些特征:①用位错的柏氏矢量能够判断位错的种类;②柏氏矢量的守恒性,即柏氏矢量与回路起点及回路程径没关;③位错的柏氏矢量个部分均同样。
刃型位错的柏氏矢量与位错线垂直;螺型平行;混淆型呈随意角度。
晶界拥有的一些特征:①晶界的能量较高,拥有自觉长大和使界面平直化,以减少晶界总面积的趋向;②原子在晶界上的扩散速度高于晶内,熔点较低;③相变时新相优先在晶界出形核;④晶界处易于发生杂质或溶质原子的富集或偏聚;⑤晶界易于腐化和氧化;⑥常温下晶界能够阻挡位错的运动,提升资料的强度。
二、纯金属的结晶要点内容:均匀形核时过冷度与临界晶核半径、临界形核功之间的关系;细化晶粒的方法,铸锭三晶区的形成体制。
基本内容:结晶过程、阻力、动力,过冷度、变质办理的观点。
铸锭的缺点;结晶的热力学条件和构造条件,非均匀形核的临界晶核半径、临界形核功。
相起伏:液态金属中,时聚时散,起伏不定,不停变化着的近程规则摆列的原子公司。


第一章原子结构与键合1. 主量子数n、轨道角动量量子数l i、磁量子数m i和自旋角动量量子数S i。
2. 能量最低原理、Pauli不相容原理,Hund规则。
3. 同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素核外电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低;4. 在元素周期表中占据同一位置,尽管它们的质量不同,然它们的化学性质相同的物质称为同位素。
由于各同位素的含中子量不同(质子数相同),故具有不同含量同位素的元素总的相对原子质量不为正整数。
5. 52.0576. 73% (Cu63); 27% (Cu65)8. a:高分子材料;b:金属材料;c:离子晶体10.a) Al2O3的相对分子质量为M=26.98×2+16×3=101.961mm3中所含原子数为1.12*1020(个)b) 1g中所含原子数为2.95*1022(个)11. 由于HF分子间结合力是氢键,而HCl分子间结合力是范德化力,氢键的键能高于范德化力的键能,故此HF的沸点要比HCl的高。
第2章固体结构1.每单位晶胞内20个原子2.CsCl型结构系离子晶体结构中最简单一种,属立方晶系,简单立方点阵,Pm3m空间群,离子半径之比为0.167/0.181=0.92265,其晶体结构如图2-13所示。
从图中可知,在<111> 方向离子相接处,<100>方向不接触。
每个晶胞有一个Cs+和一个Cl-,的配位数均为8。
3.金刚石的晶体结构为复杂的面心立方结构,每个晶胞共含有8个碳原子。
金刚石的密度(g/cm3)对于1g碳,当它为金刚石结构时的体积(cm3)当它为石墨结构时的体积(cm3)故由金刚石转变为石墨结构时其体积膨胀4.]101[方向上的线密度为1.6. 晶面族{123}=(123)+(132)+(213)+(231)+(321)+(312)+)231(+)321(+)132(+)312(+)213(+)123(+)321(+)231(+)312(+)132(+)123(+)213(+)312(+)213(+)321(+)123(+)132(+)231(晶向族﹤221﹥=[221]+[212]+[122]+]212[+]122[+]221[+]122[+]212[+]221[+]122[+]221[+]212[7. 晶带轴[uvw]与该晶带的晶面(hkl)之间存在以下关系:hu+kv+lw=0;将晶带轴[001]代入,则h×0+k×0+l×1=0;当l=0时对任何h,k取值均能满足上式,故晶带轴[001]的所有晶带面的晶面指数一般形式为(hk0)。

材料是人类社会经济地制造有用器件的物质。
所谓有用,是指材料满足产品使用需要的特性,即使用性能,它包括力学性能、物理性能和化学性能;制造是指将原材料变成产品的全过程,材料对其所涉及的加工工艺的适应能力即为工艺性能,它包括铸造性能、塑性加工性能、切削加工性能、焊接性能和热处理性能等。
全面地理解材料性能及其变化规律,是设计、选材用材、制订加工工艺及质量检验的重要依据。
一、力学性能1. 强度 —— 材料抵抗变形、断裂的能力,单位 MN/m2(MPa )。
拉伸试验比例极限σp: 弹性变形阶段,应力和应变关系符合虎克定律的极限力。
弹性极限σe: 完全卸载后不出现任何明显微量塑性变形的极限应力值。
屈服强度σs: 材料开始明显塑性变形的抗力,是设计和选材的主要依据。
•条件(名义)屈服强度σ0.2:中、高碳钢等无明显屈服现象。
抗拉强度σb (强度): 铸铁、陶瓷、复合材料等脆性材料σb=σs。
•比强度σb /ρ :玻璃钢ρ= 2.0, σb = 1060 MN/m2,比强度为铝的三倍。
•屈强比:材料屈服强度与抗拉强度之比,表征了材料强度潜力的发挥,利用程度和该种材料零件工作时的安全程度许用应力[σ]:[]n sσσ= n: 安全系数………………全面理解☆注意σ0.2、比强度、屈强比等概念2. 刚度EE =比例变形阶段的σ/ε金属材料的刚度对结构不敏感刚度(或刚性)是材料对弹性变形的抵抗能力指标。
如果说强度保证了材料不发生过量塑性变形甚至断裂的话,刚度则保证了材料不发生过量弹性变形,从这个角度来看,刚度和强度具有相同的技术意义而同等的重要,因而机械设计时既包括强度设计又包括刚度设计。
刚度的对立面是挠度,即外力作用下工件产生的弹性变形量。
3. 弹性:用来描述在外力作用下材料发生弹性行为的综合性能指标。
比例极限σp 、弹性极限σe 和弹性模量E 等在一定的程度上均可用来说明材料的弹性性能a )最大弹性变形量εe 是材料在外力作用下所能发生的最大可恢复变形量,即弹性变形能力。



1.金属中的与相互作用所构成的键合称为金属键。
2.由两个或多个相差不大的原子间通过而形成的化学键叫共价键。
3.决定材料性能的最根本的因素是组成材料的各元素的,其中又以对材料的性能影响最大。
4.化学键中既无方向性又无饱和性的是键。
NaCl是以键结合的。
5.属于物理键的是()。
A.共价键B.范德华力C.氢键6 原子Ca、Ar的电子结构表达?1.fcc结构的密排方向是,密排面是,致密度为 ,配位数是 ,晶胞中原子数为,把原子视为刚性球时,原子的半径r与点阵常数a的关系是: 。
2.bcc结构的密排方向是,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为,原子的半径r与点阵常数a的关系是: 。
3.hcp结构的密排方向是,密排面是,致密度为,配位数是,晶胞中原子数为。
4.根据溶质原子在溶剂点阵中所处的位置,可将固溶体分为和。
5.纯Al是结构,密排面是 ,晶胞致密度 ,晶胞中原子数为,原子的半径r与点阵常数a的关系是: 。
6.α-Fe是结构,密排面是 ,晶胞致密度为 ,晶胞中原子数为,原子的半径r与点阵常数a的关系是: 。
7.在晶面(110)和(111)所在的晶带,其晶带轴的指数为:()A.[1-10]B. [100]C. [011]D.[011];8.渗碳体是一种( )。
A.间隙相B.金属化合物C. 电子化合物D.固溶体9.晶体的本质特征是:( )A.内部质点在三维空间周期排列B.具有规则的几何外形C.具有对称性D.具有各向异性10.以[112]为晶带轴的共带面为:()A.(111)B.(111̅)C.(1̅1̅1̅)D.(1̅11̅)11.晶面(011)和(111)所在晶带轴。
( )A.[1̅10]B.[11̅0]C.[011̅]D.[1̅01]12.影响置换固溶体溶解度的因素表述正确的是。
( )A尺寸差,原子尺寸差越小,溶解度越小B电负性差,电负性差越小,溶解度越小C电子浓度,电子浓度越小,溶解度越小D晶体结构,晶格类型相同溶解度越大13.立方晶系中(110)和(211)同属于晶带。