新版化工原理习题答案第六章蒸发
- 格式:doc
- 大小:164.50 KB
- 文档页数:4

6.蒸发-概念题(题目)[一]单选择题(1) x06a02908为了提高蒸发器的生产强度A 应设法提高总传热系数或提高传热温度差, 或同时提高二者B 不应考虑传热系数问题, 而应设法提高传热温度差C 不应考虑传热温度差问题, 而应设法提高传热系数(2) x06a03037当加热蒸汽压力及冷凝器真空度相同,且每个蒸发器的传热面积、传热系数都相同,多效蒸发与单效蒸发操作相比较(1) 生产能力( ) (2) 经济性( ) (3) 生产强度( )(4) 有效温差( ) (5) 理论温差( )请选择以下答案之一填入A 多效蒸发大于单效蒸发B 多效蒸发小于单效蒸发C 多效蒸发与单效蒸发一样(3) x06a05009为了蒸发浓缩某种粘度随浓度和温度变化较大的溶液,应采用A 并流加料流程B 逆流加料流程C 平流加料流程(4) x06a05010下列几条措施中, 哪一条不能提高加热蒸汽的经济程度?A 采用多效蒸发流程B 引出额外蒸汽C 使用热泵蒸发器D 增大传热面积(5) x06a05037真空蒸发时, 冷凝器操作压强的最低极限取决于A 冷凝水的温度B 真空泵的能力C 当地大气压力D 蒸发器的蒸发水量(6) x06b02038为了工业化蒸发浓缩粘度偏高的稀磷酸水溶液,应采取的适宜蒸发方式是A 并流多效真空蒸发C 逆流多效真空蒸发D 单效真空蒸发(7) x06b03036设计蒸发器时,为减少蒸发所需的传热面积并降低设备费,应选择以下哪几种方案A 高的加料温度B 低的加料温度C 高的蒸发室压力D 低的蒸发室压力E 高的加热蒸汽压力F 低的加热蒸汽压力[二]填空题(1) t06a01103在Q=Wr式中,W表示______________________________________。
(2) t06a01104用135℃的饱和水蒸汽在蒸发室中加热某液体,使之沸腾,操作条件下,液体的沸点温度为95℃,蒸汽冷凝在饱和温度下排出,则传热的推动力为_________。
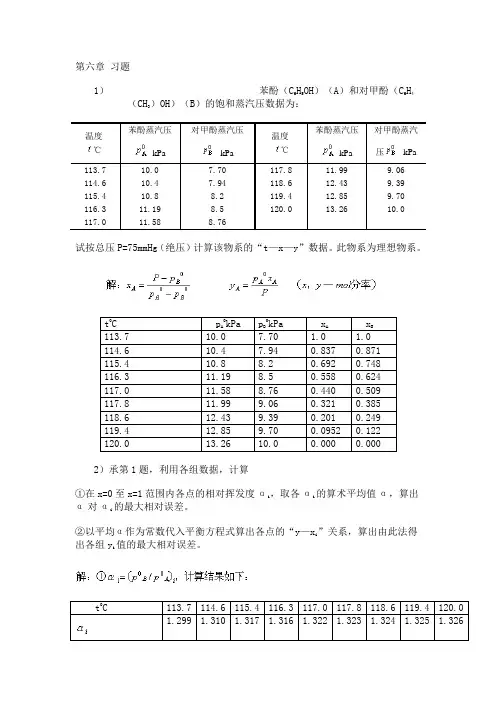
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa113.710.07.70117.811.999.06 114.610.47.94118.612.439.39 115.410.88.2119.412.859.70 116.311.198.5120.013.2610.0 117.011.588.76试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C pA 0kPa pB0kPa xAxB113.7 10.0 7.70 1.0 1.0 114.6 10.4 7.94 0.837 0.871 115.4 10.8 8.2 0.692 0.748 116.3 11.19 8.5 0.558 0.624 117.0 11.58 8.76 0.440 0.509 117.8 11.99 9.06 0.321 0.385 118.6 12.43 9.39 0.201 0.249 119.4 12.85 9.70 0.0952 0.122 120.0 13.26 10.0 0.000 0.0002)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi ,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—xi”关系,算出由此法得出各组yi值的最大相对误差。
t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.01.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x1.0 0.837 0.692 0.558 0.440 0.321 0.201 0.0952 0i1.0 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0yi最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C p A0kPa p B0kPa x A x B2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—x i”关系,算出由此法得出各组y i值的最大相对误差。
t0Ct0Cx i0y i0最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
问:总压为60mmHg(绝压)时,A与B的沸点各为多少℃在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率4)苯(A)和甲苯(B)混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p0的单位是mmHg,t的单位是℃。
试计算总压为850mmHg(绝压)下含苯25%(摩尔百分率)的该物系混合液的泡点。
5)试计算总压为760mmHg(绝压)下,含苯、甲苯(摩尔分率)的混合蒸汽的露点。
若令该二元物系降温至露点以下3℃,求平衡的汽、液相摩尔之比。
6)有一苯(A)、甲苯(B)、空气(C)的混合气体,其中空气占2%,苯与甲苯浓度相等(均指摩尔百分数),气体压强为760mmHg(绝压)。
若维持压强不变,令此三元物系降温至95℃,求所得平衡汽相的组成。
A、B组分均服从拉乌尔定律。
已知95℃时,。
设X A算得的X‘A7)常压下将含苯(A)60%,甲苯(B)40%(均指摩尔百分数)的混合液闪蒸(即平衡蒸馏),得平衡汽、液相,汽相摩尔数占总摩尔数的分率——汽化率(1-q)为。
物系相对挥发度α=,试求:闪蒸所得平衡汽、液相的浓度。

第一章绪论习题1.热空气与冷水间的总传热系数K值约为42.99k c a l/(m2・h・℃),试从基本单位换算开始,将K值的单位改为W/(m2・℃)。
[答案:K=50M(m2・C)]。
解:从附录查出:1k c a l=1.1622×10-3K W·h=1.1622W·h所以:K=42.99K c a l/(m2·h·℃)=42.99K c a l/(m2·h·℃)×(1.1622W·h/1k c a l)=50w/(m2·℃)。
2.密度ρ是单位体积物质具有的质量。
在以下两种单位制中,物质密度的单位分别为:S I k g/m2;米制重力单位为:k g f.s2/m4;常温下水的密度为1000k g/m3,试从基本单位换算开始,将该值换算为米制重力单位的数值。
〔答案:p=101.9k g f/s2/m4〕解:从附录查出:1k g f=9.80665k g·m/s2,所以1000k g/m3=1000k g/m3×[1k g f/(9.80665k g·m/s2)]=101.9k g f·s2/m4.3.甲烷的饱和蒸气压与温度的关系符合下列经验公式:今需将式中p的单位改为P a,温度单位改为K,试对该式加以变换。
〔答案:〕从附录查出:1m m H g=133.32P a,1℃=K-273.3。
则新旧单位的关系为:P=P’/133.32;t=T-273.3。
代入原式得:l g(P’/133.32)=6.421-352/(T-273.3+261);化简得l g P=8.546-3.52/(T-12.3).4.将A、B、C、D四种组分各为0.25(摩尔分数,下同)的某混合溶液,以1000m o l/h 的流量送入精馏塔内分离,得到塔顶与塔釜两股产品,进料中全部A组分、96%B组分及4%C组分存于塔顶产品中,全部D组分存于塔釜产品中。

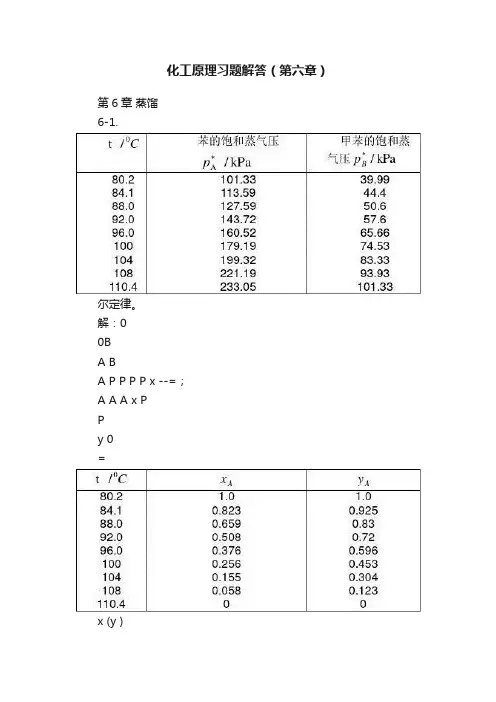
化工原理习题解答(第六章)第6章蒸馏6-1.尔定律。
解:00BA BA P P P P x --=;A A A x PPy 0=x (y )t/0C0.00.20.40.60.81.00.00.20.40.60.81.0yx6-2.利用习题6-1的数据(1)计算相对挥发度α。
(2)写出平衡方程式。
(3)算出x y -的一系列平衡数据与习题1作比较。
(答:(1)44.2=α,(2)xxy 44.1144.2+=)解:⑴0A P P =α,44.22==α⑵()xxx x y 44.1144.211+=-+=αα⑶由α计算所得的一系列y 、x 值与习题6-1之值很接近。
6-3.将含%24(摩尔分数,下同)易挥发组分的某液体混合物送入一连续精馏塔中。
要求馏出液含%95易挥发组分,釜液含%3易挥发组分。
送至冷凝器的蒸气量为1h kmol 850-?,流入精馏塔的回流液量为1h kmol 670-?。
试求:(1)每小时能获得多少kmol 的馏出液?多少kmol 的釜液?(2)回流比DLR = 为多少?(答:1h kmol 180-?=D , 1h kmol 6.608-?=W ;72.3=R ) 解:D L V +=,1h kmol 180670850-?=-=-=L V D ,72.3180D L R , W W D F +=+=180,W D F Wx Dx Fx +=即()03.018018095.024.0?-+?=F F ,解得:1h kmol 6.788-?=F ,1h kmol 6.6081806.788-?=-=-=D F W 。
6-4.有1hkg 10000-?含物质A (摩尔质量为1kmol8kg 7-? )3.0(质量分数,下同)和含物质B (摩尔质量为1kmol 0kg 9-? )7.0的混合蒸气自一连续精馏塔底送入。
若要求塔顶产品中物质A 的组成为95.0,釜液中物质A 的组成为01.0。

化工原理《蒸发》习题及答案1、用一单效蒸发器将2500kg/h 的NaOH 水溶液由10%浓缩到25%(均为质量百分数),已知加热蒸气压力为450kPa ,蒸发室内压力为101.3kPa,溶液的沸点为115℃,比热容为3.9kJ/(kg ·℃),热损失为20kW 。
试计算以下两种情况下所需加热蒸汽消耗量和单位蒸汽消耗量。
(1)进料温度为25℃;(2)沸点进料。
解:(1) 求水蒸发量W应用式(4-1)kg/h 1500)25.01.01(2500)1(10=-=-=x x F W (2)求加热蒸汽消耗量应用式(4-4)rQ Wr t t FC D L 010')(++-= 由书附录查得450kPa 和115℃下饱和蒸汽的汽化潜热为2747.8和2701.3kJ/kg则进料温度为25℃时的蒸汽消耗量为:kg/h 18208.2747102.71005.41078.88.27473600203.27011500)25115(2500465=⨯+⨯+⨯=⨯+⨯+-⨯=D单位蒸汽消耗量由式(4-5a )计算,则21.1=W D原料液温度为115℃时kg/h 15008.27473600203.270115002=⨯+⨯=D 单位蒸汽消耗量0.12=WD 由以上计算结果可知,原料液的温度愈高,蒸发1 kg 水所消耗的加热蒸汽量愈少。
2、试计算30%(质量百分数)的NaOH 水溶液在60 kPa (绝)压力下的沸点。
解:''ΔT t A +=T ‘查 蒸汽在600kPa 下的饱和温度为85.6℃,汽化潜热为2652kJ/kg 'Δ由式(4-9) 常''f ΔΔ=可求其中 f 由式(4-10)求得,即785.01.2652)2736.85(0162.0')273'(0162.02=+=+=r T f 查附录 常'Δ为160℃则 常'Δ=160-100=60℃1.47785.060'=⨯=∴Δ℃即 7.1321.476.85=+=A t ℃3、在一常压单效蒸发器中浓缩CaCl 2水溶液,已知完成液浓度为35.7%(质分数),密度为1300kg/m 3,若液面平均深度为1.8m ,加热室用0.2MPa (表压)饱和蒸汽加热,求传热的有效温差。

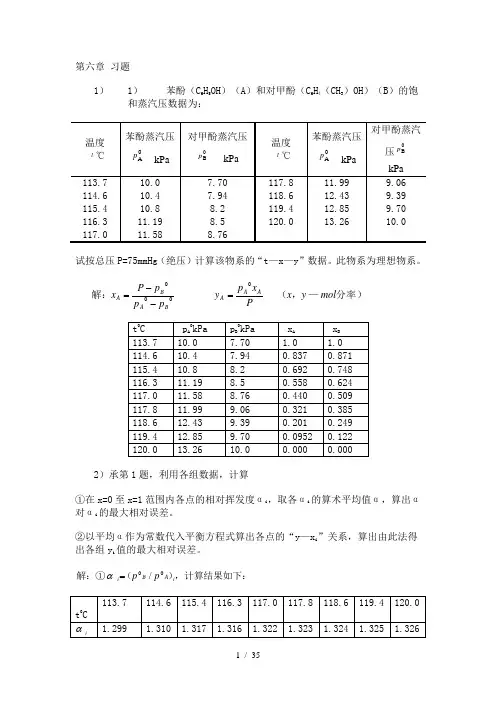
第六章 习题1)1) 苯酚(C 6H 5OH )(A )和对甲酚(C 6H 4(CH 3)OH )(B )的饱和蒸汽压数据为:试按总压P=75mmHg (绝压)计算该物系的“t —x —y ”数据。
此物系为理想物系。
分率)—,(解:mol y x P xp y p p p P x AA A BA BA 00=--=2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi ,取各αi 的算术平均值α,算出α对αi 的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y —x i ”关系,算出由此法得出各组y i 值的最大相对误差。
,计算结果如下:)(解:①i A B i p p 00/=α%46.1299.1299.1318.1318.1=-===∑最大误差niαα计,结果如下:按)()318.1112αααiii x x y -+=t 0C113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x i 1.0 0.837 0.692 0.558 0.440 0.321 0.201 0.0952 0 y i1.0 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0最大误差=31060.2385.0385.0384.0-⨯-=-3)已知乙苯(A )与苯乙烯(B )的饱和蒸汽压与温度的关系可按下式算得:式中p 0的单位是mmHg ,T 的单位是K 。
问:总压为60mmHg (绝压)时,A 与B 的沸点各为多少℃?在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率?CK T T Ln B t p p CK T T Ln A t p p B B A A 00007.6985.34272.63/57.33280193.16608.6195.33495.59/47.32790195.1660)1==∴--====∴--==)(的沸点为,算得的令)(的沸点为算得的,令解:mmHgp Lnp KC t mmHg p A A 81.6895.5915.338/47.32790195.1615.33865602000=∴--====)(,)639.060557.081.68557.092.4881.6892.486092.4872.6315.338/57.33280193.1600=⨯==--==∴--=A A B B y x mmHgp Lnp )(4)苯(A )和甲苯(B )混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p 0的单位是mmHg ,t 的单位是℃。

蒸发习题解1.试计算30%(质量分数)的NaOH 水溶液在60kPa 压力(绝压)下的沸点。
解:查附录9:在60kPa 压力(绝压)下水的沸点 T ′=85.6℃,r ′=2292kJ/kg查附录19:无机盐溶液在常压下的沸点,得30%NaOH 溶液的沸点为 t =118.1℃r )T (.f '+'=227301620=909.02292)2736.85(0162.02=+= △′=f 'a ∆=0.909×(118.1-100)=16.45℃故 相应沸点 t =T ′+ △′=85.6+16.45=102.1℃2.浓度为30%(质量分数)的NaOH 水溶液,在绝压为60kPa 的蒸发室内进行单效蒸发操作。
器内溶液的深度为2m ,溶液密度为3/1280m kg =ρ,加热室用表压为MPa 1.0的饱和蒸汽加热,求传热的有效温差t ∆。
解:在60kPa 压力(绝压)下水的沸点 t 0=85.6℃在MPa 1.0(表压)下水的沸点 T =120.2℃查图5-2,30% NaOH ,t 0=85.6℃下, t =103℃△′=103-85.6=17.4℃2'glp p m ρ+==60×103+21×1280×9.81×2=7.256×104 Pa 查P m 下水的沸点为90.8℃∴ △″=90.8-85.6=5.2℃△=△′+△″=17.4+5.2=22.6℃t =t 0+△=85.6+22.6=108.2℃∴t ∆=T -t =120.2-108.2=12℃3.已知单效常压蒸发器每小时处理2000kgNaOH 水溶液,溶液浓度由15 %(质量分数,下同)浓缩到25%,加热蒸汽压力为392kPa(绝压),冷凝温度下排出。
分别按20℃加料和沸点加料(溶液的沸点为113℃)。
求此两种情况下的加热蒸汽消耗量和单位蒸汽消耗量。

化工原理杨祖荣1-7章习题答案(完美排版)目录第一章流体流动与输送机械 (2)第二章非均相物系分离 (32)第三章传热 (42)第四章蒸发 (69)第五章气体吸收 (73)第六章蒸馏 (95)第七章固体干燥 (119)第三章 传热1、某加热器外面包了一层厚为300mm 的绝缘材料,该材料的导热系数为0.16W/(m ⋅℃),已测得该绝缘层外缘温度为30℃,距加热器外壁250mm 处为75℃,试求加热器外壁面温度为多少? 解:22321121λλb t t b t t A Q -=-=C 3007516.025.016.005.03075o 21122321=+⨯-=+λ⨯λ-=∴t b b t tt2、某燃烧炉的平壁由下列三种砖依次砌成;耐火砖 b 1=230mm , λ1=1.05 W/(m·℃)绝热砖 b 2=230mm , λ2=0.151W/(m·℃)建筑砖 b 3=240mm , λ3=0.93W/(m·℃)已知耐火砖内侧温度为1000℃,耐火砖与绝热砖界面处的温度为940℃,要求绝热砖与建筑砖界面处的温度不得超过138℃,试求:(1) 绝热层需几块绝热砖;(2) 普通砖外侧温度为多少?解:(1)b 2=?m442.09.273151.013894005.123.094010002222321121=∴=-=-λ-=λ-=b b b t t b t t A Q230mm<b 2=442mm<230×2mm则:绝热层需两块绝热砖。
校核t 2=? C C t t o o 1386.1059.273151.046.094022<=∴=- (2)t 4=?C9.3493.024.06.1059.273o 443343=∴-==λ-=t t b t t A Q 3、Φ50×5㎜的不锈钢管,导热系数λ1=16W/(m·K),外面包裹厚度为30mm 导热系数λ2=0.2W/(m·K)的石棉保温层。
第六章 蒸发1.采用标准蒸发器将10%的NaOH 水溶液浓缩至25%(质量分数)。
蒸发室的操作压力为50 kPa ,试求操作条件下溶液的沸点升高及沸点。
解:溶液的沸点升高及沸点均按完成液来计算。
查得水的有关数据为压力p /kPa 温度t /℃ 汽化热r /(kJ ∙kg -1)101.3 10050 81.2 2304.5在101.3 kPa 时,25%NaOH 溶液的沸点为113.07 ℃。
常压下溶液的沸点升高为Δ a =(113.07–100)℃=13.07℃50 kPa 时,溶液的沸点升高可用两种方法计算。
(1)用杜林规则在杜林线图的横标81.2 ℃作垂直线交组成为25%的杜林线,再由该点查得纵标的温度为93 ℃,此即50kPa 下溶液的沸点t A 。
∆'=(93–81.2)℃=11.8 ℃(2)用式6-17经验公式估算a f '∆=∆=2(81.2273)0.016213.072304.5+⎡⎤⨯⨯⎢⎥⎣⎦℃=11.5 ℃ 则溶液的沸点升高为11.8 ℃,50kPa 下的沸点为93 ℃。
两种方法计算结果相差不大。
2.用连续操作的真空蒸发器将固体质量分数为4.0%的番茄汁浓缩至30%,加热管内液柱的深度为2.0 m ,冷凝器的操作压力为8 kPa ,溶液的平均密度为1 160 kg/m 3,常压下溶质存在引起的沸点升高a ∆'=1 ℃,试求溶液的沸点t B 。
解:8 kPa 压力下对应二次蒸汽温度为41.3 ℃,水的汽化热为2497 kJ/kg 。
取冷凝器到蒸发室的温差损失∆'''=1.5℃。
溶质引起的沸点升高取常压下数据,即∆'=1℃。
则溶液的沸点为B 41.341.31 1.543.8t ''''=+∆=+++∆=+∆∆''的计算如下:m 2Lg p p ρ'=+与43.8 ℃相对应的压力p '=9.25 kPa则 m 1160 2.09.819.2510002p ⨯⨯⎡⎤=+⎢⎥⨯⎣⎦kPa=20.63 kPa 与p m 对应的溶液沸点为60.7 ℃,即t B =60.7 ℃3.在一连续操作的单效蒸发器中将NaOH 水溶液从10%浓缩至45%(质量分数),原料液流量为1 000 kg/h 。
化工原理学习指导 第6章 蒸馏 计算题答案6-31 某二元混合物蒸汽,其中轻、重组分的摩尔分数分别为0.75和0.25,在总压为300kPa 条件下被冷凝至40℃,所得的汽、液两相达到平衡。
求其汽相摩尔数和液相摩尔数之比。
已知轻、重组分在40℃时的蒸汽压分别为370kPa 和120kPa 。
解:两相中,720.01203701203000B0A 0B =--=--=p p p p x 888.0300720.03700A A =⨯===x p p p p y设汽相摩尔量为V ,液相摩尔量为L ,总量为F ,则L V F +=Lx Vy Fx F +=由以上两式可得:217.075.0888.072.075.0F F =--=--=x y x x L V 事实上,汽液平衡体系中,两相的摩尔量比值服从杆杠定律。
6-32 苯和甲苯组成的理想溶液送入精馏塔中进行分离,进料状态为汽液共存,其两相组成分别如下:5077.0F =x ,7201.0F =y 。
用于计算苯和甲苯的蒸汽压方程如下:8.2201211031.6lg 0A +-=t p5.2191345080.6lg 0B +-=t p其中压强的单位为Pa ,温度的单位为℃。
试求:(1)该进料中两组份的相对挥发度为多少?(2)进料的压强和温度各是多少?(提示:设进料温度为92℃) 解:(1)混合物中两组分的相对挥发度:49.25077.015077.07201.017201.011F F F F=--=--=x x y y α (2)设进料温度为92℃,则16.28.220921211031.6lg 0A =+-=pkPa 38.1440A =p 762.15.219921345080.6lg 0B =+-=pkPa 83.570B =p由此求得体系的相对挥发度为:496.283.5738.144'0B0A ===p p α 其值与(1)中所求相对挥发度足够接近,故可认为进料温度为92℃。
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa 113.710.07.70117.811.999.06 114.610.47.94118.612.439.39 115.410.88.2119.412.859.70 116.311.198.5120.013.2610.0 117.011.588.76试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C p A0kPa p B0kPa x A x B113.710.07.70 1.0 1.0114.610.47.940.8370.871115.410.88.20.6920.748116.311.198.50.5580.624117.011.588.760.4400.509117.811.999.060.3210.385118.612.439.390.2010.249119.412.859.700.09520.122120.013.2610.00.0000.0002)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—x i”关系,算出由此法得出各组y i值的最大相对误差。
t0C 113.7114.6115.4116.3117.0117.8118.6119.4120.01.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326t0C113.7114.6115.4116.3117.0117.8118.6119.4120.0x i 1.00.8370.6920.5580.4400.3210.2010.09520y i 1.00.8710.7480.6250.5090.3840.2490.1220最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
第六章 蒸发
1.采用标准蒸发器将10%的NaOH 水溶液浓缩至25%(质量分数)。
蒸发室的操作压力为50 kPa ,试求操作条件下溶液的沸点升高及沸点。
解:溶液的沸点升高及沸点均按完成液来计算。
查得水的有关数据为
压力p /kPa 温度t /℃ 汽化热r /(kJ ∙kg -1)
100
50
在 kPa 时,25%NaOH 溶液的沸点为113.07 ℃。
常压下溶液的沸点升高为
Δ a =(–100)℃=13.07℃
50 kPa 时,溶液的沸点升高可用两种方法计算。
(1)用杜林规则
在杜林线图的横标81.2 ℃作垂直线交组成为25%的杜林线,再由该点查得纵标的温度为93 ℃,此即50kPa 下溶液的沸点t A 。
∆'=(93–)℃=11.8 ℃
(2)用式6-17经验公式估算
a f '∆=∆=2(81.2273)0.016213.072304.5+⎡⎤⨯⨯⎢⎥⎣⎦
℃=11.5 ℃ 则溶液的沸点升高为11.8 ℃,50kPa 下的沸点为93 ℃。
两种方法计算结果相差不大。
2.用连续操作的真空蒸发器将固体质量分数为%的番茄汁浓缩至30%,加热管内液柱的
深度为2.0 m ,冷凝器的操作压力为8 kPa ,溶液的平均密度为1 160 kg/m 3,常压下溶质存
在引起的沸点升高a ∆'=1 ℃,试求溶液的沸点t B 。
解:8 kPa 压力下对应二次蒸汽温度为41.3 ℃,水的汽化热为2497 kJ/kg 。
取冷凝器到蒸发室的温差损失∆'''=1.5℃。
溶质引起的沸点升高取常压下数据,即∆'=1℃。
则溶液的沸点为
B 41.341.31 1.543.8t ''''=+∆=+++∆=+∆
∆''的计算如下:
m 2
Lg
p p ρ'=+ 与43.8 ℃相对应的压力p '= kPa
则 m 1160 2.09.819.2510002p ⨯⨯⎡⎤=+⎢⎥⨯⎣⎦
kPa= kPa 与p m 对应的溶液沸点为60.7 ℃,即t B =60.7 ℃
3.在一连续操作的单效蒸发器中将NaOH 水溶液从10%浓缩至45%(质量分数),原料液流量为1 000 kg/h 。
蒸发室的操作绝对压力为50 kPa (对应饱和温度为81.2 ℃),加热室中溶液的平均沸点为115 ℃,加热蒸汽压力为 MPa (133.3 ℃),蒸发器的热损失为12 kW 。
试求(1)水分蒸发量;(2)60 ℃和115 ℃两个加料温度下加热蒸汽消耗量及单位蒸汽耗用量。
解:(1)水分蒸发量
010.10(1)1000(1)0.45x W F x ⎡⎤=-=⨯-⎢⎥⎣⎦
kg/h=777.8 kg/h (2)加热蒸汽消耗量及单位蒸汽耗用量
用焓浓图计算。
10%NaOH 水溶液60 ℃的焓220 kJ/kg ,115 ℃的焓为440 kJ/kg ;
45% NaOH 水溶液115℃的焓545kJ/kg ;115℃水蒸汽的焓为kg,
MPa 下r = kJ/kg 。
60 ℃加料时
10L ()WH F W h Fh Q D r
'+--+= =777.82702.5(1000777.8)54510002203600122168.1⨯+-⨯-⨯+⨯⎡⎤⎢⎥⎣⎦
kg/h=943.9 kg/h 214.18
.7779.943===
W D e 115 ℃加料时 =D ⎥⎦
⎤⎢⎣⎡⨯+⨯-⨯-+⨯1.21681236004401000545)8.7771000(5.27028.777kg/h=842.4kg/h 083.18
.7774.842==
e 显然,随加料温度提高,D 及e 值均下降。
4.在单效蒸发装置中,将1/4的二次蒸汽用来预热原料液。
原料液的流量为1 000kg/h ,温度从20 ℃升到70 ℃,其比热容C 0= kJ/(kg ∙℃)。
完成液的组成为(质量分数,下同)。
已知溶液的沸点为98 ℃,蒸发室内二次蒸汽温度为91 ℃,加热蒸汽温度为125 ℃。
忽略蒸发装置的热损失。
试求(1)传热的有效温差和温差损失;(2)原料液的组成x 0;(3)加热蒸汽消耗量和经济性。
解:(1)有效温差和温差损失 ()m 112598t T t ∆=-=-℃=27 ℃
()91981-='-=∆T t ℃=7℃
(2)料液组成
91 ℃下蒸汽的冷凝热6.2281='r kJ/kg
h kJ 1098.1h kJ )2070(96.31000)(500⨯=-⨯⨯=-t t FC p 6
.22811980004⨯=W kg/h=347.1 kg/h 1.347kg/h )28
.01(1000)1(010=-⨯=-=x x x F W kg/h 1828.00=x
(3)加热蒸汽消耗量及其经济性
98 ℃和125 ℃的相变热分别为kg 和kg
r Q t t FC r W D L p +-+'=)(10=0.409kg/h 8
.2191)7098(96.310004.22631.347=-⨯⨯+⨯kg/h
8486.00
.4091.347===
D W
E 5.在单效真空蒸发器中将牛奶从15%浓缩至50%(质量分数),原料液流量为
F =1500 kg/h , 其平均比热容C 0= kJ/(kg ∙℃),进料温度为30 ℃。
操作压力下,溶液的沸点为
65 ℃,加热蒸汽压力为105 Pa (表压)。
当地大气压为 kPa 。
蒸发器的总传热系数K 0=1 160
W/(m 2∙℃),其热损失为8 kW 。
试求(1)产品的流量;(2)加热蒸汽消耗量;(3)蒸发器的传热面积。
解:(1)产品流量 )50
.015.01(1500)1(10-⨯=-=x x F W kg/h=1050 kg/h ⎪⎭⎫ ⎝⎛⨯=⎥⎦⎤⎢⎣
⎡--=-=50151500)1(110x x F W F L kg/h=450 kg/h
(2)65 ℃下水的汽化热为r '= kJ/kg
kPa 下的蒸汽冷凝热r =kg ,T =120.3 ℃
忽略牛奶的稀释热,则
010L ()p Wr FC t t Q D r +-+==⎥⎦
⎤⎢⎣⎡⨯+-⨯⨯+⨯5.220483600)3065(90.315004.23431050kg/h =1222 kg/h
164.11050
1222==e (3)蒸发器的传热面积
[]4.23431050)3065(90.31500⨯+-⨯⨯=Q kJ/h=×106kJ/h=740 kW
()m B 120.365t T t ∆=-=-℃=55.3 ℃
3
.55116010740300⨯⨯=∆=m t K Q S m 2=11.54 m 2 6.在双效并流蒸发装置上浓缩盐的水溶液。
已知条件为:第1效,浓缩液的组成为x 1(质量分数,下同),流量为L 1=500 kg/h ,溶液沸点为105 ℃(即二次蒸汽温度),该温度下水的汽化热1r '=2 kJ/kg ,物料平均比热容c p = kJ/(kg ∙℃);第2效,完成液组成为32%,溶液沸点为90 ℃,该温度下水的汽化热2r '= kJ/kg 。
忽略溶液的沸点升高、稀释热及蒸发
装置的热损失。
试计算原料液的处理量F 及其组成x 0。
解:12120.16(1)500(1)0.32
x W L x =-=⨯-kg/h=250 kg/h 22121211()2502283.1500 3.52(25)2245.4p W r LC t t D W r '+-⨯+⨯⨯-⎡⎤===⎢⎥'⎣⎦
kg/h=234.6 kg/h ()11234.6500F W L =+=+kg/h=734.6 kg/h
6.234)16
.01(6.73401=-⨯=x W kg/h
解得 x 0=
7.在三效并流蒸发装置上浓缩糖水溶液。
沸点升高及蒸发器的热损失均可忽略不计。
已知第一效的生蒸汽压力p 0= kPa (对应饱和温度130 ℃)、第三效溶液的沸点t 3=55℃(对
应p 3= k Pa )。
各效的总传热系数分别为:K 0,1=2600 W/(m 2∙℃),K 0,2=2000 W/(m 2∙℃),K 0,3=1400
W/(m 2∙℃)。
各效蒸发器传热面积相等。
试按如下两种简化估算各效溶液沸点:
(1)各效传热量相等;
(2)各效等压力降。
解:(1)各效传热量相等的溶液沸点
0,11m 0,10,20,3112600(13055)18.04C 111111260020001400
K t t K K K ∆=∆⨯=-⨯=︒++++ ()04.181301-=t ℃=111.96 ℃
同理 223.45C t ∆=︒ 288.51C t =︒ 355C t =︒
(2)等压力降原则的沸点
相邻两效间的压力差为
i 270.315.743p -⎛⎫∆= ⎪⎝⎭
kPa= kPa 5.1851=p kPa 6.1171=t ℃
同理 6.1002=p kPa 9.992=t ℃
可见,不同简化方法估算溶液的沸点值有一定差别。