化学除杂分离和提纯中考经典题型带答案经典
- 格式:doc
- 大小:83.00 KB
- 文档页数:7

(化学) 中考化学化学除杂分离和提纯专项训练100(附答案)及解析一、中考化学除杂分离和提纯1.下列哪种试剂最适合用来除去NaCl 溶液中混有的少量NaOH ( ) A .23Na CO 溶液 B .24H SO 溶液C .HCl 溶液D .2Ca(OH)溶液【答案】C 【解析】 【分析】 【详解】A 、23Na CO 溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故A 错;B 、24H SO 溶液和NaOH 发生反应生成硫酸钠和水,会引入新杂质硫酸钠,故B 错;C 、HCl 溶液和NaOH 发生反应生成氯化钠和水,不会引入新杂质,符合题意故C 正确;D 、2Ca(OH)溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故D 错; 故选:C 。
【点睛】除杂的原则不引入新杂质,被提纯物质不能减少,杂质容易分离。
2.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是 A .CO 2(CO )→CuO B .CaCl 2溶液(HCl )→碳酸钙 C .NaCl (泥沙)→水D .NaOH 溶液(Na 2CO 3)→稀盐酸 【答案】D 【解析】A 、CO 能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确.B 、HCl 能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确.C 、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的试剂正确.D 、NaOH 溶液和Na 2CO 3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.故选D .3.除去下列物质中的杂质,所选方法正确的是( )A C CuO加入足量稀硫酸,过滤、洗涤、干燥B NaCl Na2CO3加入足量稀硫酸,蒸发结晶C CO2CO点燃D MnO2KCl加水溶解、过滤、蒸发A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、碳不与稀硫酸反应,氧化铜能与稀硫酸反应生成硫酸铜和水,待完全反应后,过滤、洗涤、干燥可得碳,符合题意;B、加入足量稀硫酸,碳酸钠能与稀硫酸反应生成硫酸钠、二氧化碳和水,氯化钠与稀硫酸不反应,虽然除去了碳酸钠,但是引入了新的杂质硫酸钠,硫酸,不符合题意;C、二氧化碳不燃烧,也不支持燃烧,二氧化碳中混有少量一氧化碳,无法点燃,不符合题意;D、二氧化锰不溶于水,氯化钾溶于水,加水溶解、过滤,洗涤、干燥可得二氧化锰,不符合题意。

【化学】初三化学化学除杂分离和提纯解题技巧及练习题(含答案)含解析一、中考化学除杂分离和提纯1.下列各组除杂质(括号内表示少量杂质)的试剂或方法错误的一组是A.NaCl溶液(MgCl2);适量NaOH溶液,过滤B.CaO(CaCO3);稀盐酸C.铜粉(铁粉);足量硫酸铜溶液,过滤D.O2(水蒸气);固体NaOH【答案】B【解析】【分析】【详解】A、MgCl2能与适量NaOH溶液反应生成氢氧化镁沉淀和氯化钠,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
B、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
C、铁粉能与硫酸铜溶液反应生成硫酸亚铁和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、氢氧化钠具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:B。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.除去下列各物质中混有的少量杂质,拟订的实验方案可行的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、除去氯化铜中的硫酸铜,加入硝酸钡,硝酸钡与硫酸铜反应生成硫酸钡和硝酸铜,虽然除去了杂质,但是会引入新的杂质硝酸铜,不符合题意;B、除去氯化钾中的碳酸钾,加入稀盐酸,碳酸钾与稀盐酸反应生成氯化钾,水和二氧化碳,可以达到目的,符合题意;C、二氧化碳不燃烧也不支持燃烧,二氧化碳中混有少量的一氧化碳,无法点燃,且通入过量的氧气,会引入新的杂质氧气,不符合题意;D、除去氯化钠中的泥沙经过溶解,过滤,洗涤和蒸发结晶,不符合题意。
故选B。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。

B.BC.CD.D初中化学化学除杂分离和提纯解题技巧及经典题型及练习题(含答案) 一、中考化学除杂分离和提纯1 .除去下列物质中混有的少量杂质(括号内为杂质),所用方法错误的是() A. FeCb 溶液(CuCh 溶液):加快粉 B. CO (C02):通过足量澄清的石灰水 C. N 2(02):通过灼热的铜网 D. Cu 粉(Fe ):加稀硫酸【答案】A 【解析】 【详解】A 、铁与氯化铜反应生成氯化亚铁和铜,铁与氯化铁反应生成氯化亚铁,混合溶液中加铁粉会将主要物质除去,生成新的杂质,故A 错误;B 、二氧化碳与氢氧化钙反应生成碳酸钙和水,一氧化碳不能与澄清石灰水反应,混合气体通过足量澄清的石灰水,能除去杂质,且不引入新的杂质,故B 正确;C 、氧气与铜加热时生成氧化铜,氮气的化学性质较稳定加热时不能与铜反应,混合气体通过灼热的铜网能除去杂质,且不引入新的杂质,故C 正确:D 、在金属活动顺序中,铁排在氢之前,铜排在氢之后,铁能与稀硫酸反应生成可溶性的氯化亚铁和氢气,铜不能与稀硫酸反应,混合物加稀硫酸能除去杂质,且不引入新的杂质,故D 正确。
故选A 。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
加入试剂除杂时至少要满足两个条件:①加入的试剂只能与杂质反应,不能与主要物质反应;②反应后不能引入新的杂质。
A.A【答案】D 【解析】 【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、Zn和Fe均能与过量稀硫酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钠的溶解度受温度影响较小,氯化钠溶液中含有少量的硝酸钾,应用蒸发结晶的方法提纯氯化钠,故选项所采取的方法错误。
C、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质(氧气),故选项所采取的方法错误。
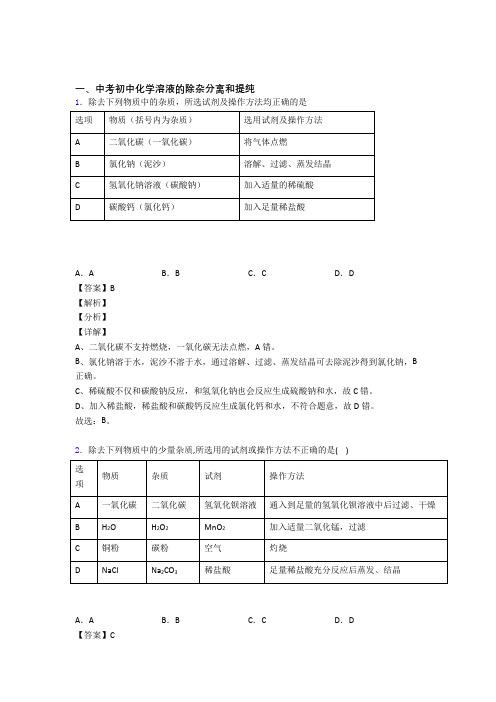
一、中考初中化学溶液的除杂分离和提纯1.除去下列物质中的杂质,所选试剂及操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、二氧化碳不支持燃烧,一氧化碳无法点燃,A错。
B、氯化钠溶于水,泥沙不溶于水,通过溶解、过滤、蒸发结晶可去除泥沙得到氯化钠,B 正确。
C、稀硫酸不仅和碳酸钠反应,和氢氧化钠也会反应生成硫酸钠和水,故C错。
D、加入稀盐酸,稀盐酸和碳酸钙反应生成氯化钙和水,不符合题意,故D错。
故选:B。
2.除去下列物质中的少量杂质,所选用的试剂或操作方法不正确的是( )A.A B.B C.C D.D【答案】C【解析】【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、将混合气体通入氢氧化钡溶液,二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,一氧化碳不反应,然后通过干燥除掉溶液中带入的水分,可得一氧化碳,选项正确;B、过氧化氢在二氧化锰的作用下生成水和氧气,过滤后液体只有水,选项正确;C、在空气中灼烧时,铜和碳都会与氧气发生反应,选项错误;D、碳酸钠能与过量的稀盐酸反应生成氯化钠、水和二氧化碳,所得溶液是氯化钠和氯化氢的混合溶液,蒸发结晶,可得氯化钠晶体,选项正确。
故选C。
3.为除去下列各物质中混有的少量杂质,采用的相应除杂方案正确的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、铜粉中含有氧化铜杂质,在空气中充分灼烧,铜与氧气在加热条件下反应生成氧化铜,不能除去杂质,反而将铜粉反应了。
故A不符合题意;B、NaCl溶液中含有Na2CO3杂质,加入适量稀硫酸,碳酸钠与稀硫酸反应生成硫酸钠、二氧化碳和水,可以除去碳酸钠,但是引入了新的杂质硫酸钠。
故B不符合题意;C、H2中含有CO2气体,通过足量NaOH溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,除去了二氧化碳,再对出来的氢气进行干燥,可以除去从氢氧化钠溶液中带出的水蒸气,从而得到纯净的氢气。

初三化学化学除杂分离和提纯试题(有答案和解析)一、中考化学除杂分离和提纯1.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是()A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、将混合气体通过足量的铜网,铜与氮气不反应,铜与氧气能在加热的条件下反应生成氧化铜,但是常温下铜与氧气不反应,常温下,通过足量的铜网,不能除去混合气体中的氧气,不符合题意;B、氯化钾能溶于水,二氧化锰不溶于水,加水溶解、过滤,除去二氧化锰,蒸发、结晶得到氯化钾,符合题意;C、活性炭具有吸附性,能吸附水中的色素和异味,故加活性炭可除去水中的臭味,过滤,除去活性炭,才能得到水,需加过滤步骤,不符合题意;D、将混合气体通过适量的氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然除去了杂质二氧化碳,但是一氧化碳通过氢氧化钠溶液会携带上水蒸气,引入了新的杂质水蒸气,不符合题意。
故选B。
2.除去CO气体中少量CO2,可采用的方法是()A.把混合气体点燃B.把混合气体通过水中C.把混合气体通过灼热的CuO粉末D.把混合气体通过足量的澄清石灰水【答案】D【解析】【分析】【详解】A、一氧化碳能与氧气反应生成二氧化碳,反而会把原物质除去,不符合除杂原则,故选项错误。
B、二氧化碳能与水反应生成碳酸,但是碳酸不稳定会分解成二氧化碳和水,不能彻底除去杂质,故选项出错误。
C、一氧化碳能与灼热的氧化铜反应生成铜和二氧化碳,二氧化碳不能与灼热的氧化铜反应,反而会把原物质除去,不符合除杂原则,故选项错误。
D、CO2能与足量澄清石灰水反应生成碳酸钙和水,CO不与足量澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项正确。
故选:D。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.3.为除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,可将粗盐溶于水,再进行下列五步操作:①过滤②加过量的氢氧化钠溶液③加稍过量的盐酸④加过量的碳酸钠溶液⑤加过量的氯化钡溶液⑥蒸发结晶。

化学除杂分离和提纯练习题(含答案)经典一、中考化学除杂分离和提纯1.下列哪种试剂最适合用来除去NaCl 溶液中混有的少量NaOH ( ) A .23Na CO 溶液 B .24H SO 溶液C .HCl 溶液D .2Ca(OH)溶液【答案】C 【解析】 【分析】 【详解】A 、23Na CO 溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故A 错;B 、24H SO 溶液和NaOH 发生反应生成硫酸钠和水,会引入新杂质硫酸钠,故B 错;C 、HCl 溶液和NaOH 发生反应生成氯化钠和水,不会引入新杂质,符合题意故C 正确;D 、2Ca(OH)溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故D 错; 故选:C 。
【点睛】除杂的原则不引入新杂质,被提纯物质不能减少,杂质容易分离。
2.下列除杂(括号内为杂质)选用的试剂或方法错误的是( ) A .Cu (CuO ):加入足量的稀盐酸,过滤,洗涤、烘干 B .NaCl 溶液(HCl ):加入过量碳酸钠,充分反应后过滤 C .CO 2 气体(CO ):将气体通过灼热的氧化铜层后收集气体 D .NaCl (泥沙):加适量水充分溶解,过滤、蒸发结晶 【答案】B 【解析】 【分析】 【详解】A 、在金属活动性顺序里,铜位于氢之前,不与稀盐酸反应,氧化铜能与稀盐酸反应生成氯化铜和水,加入足量稀盐酸,过滤、洗涤、干燥可得铜,不符合题意;B 、加入过量的碳酸钠,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钠过量,虽然除去了杂质,但是引入了新的杂质碳酸钠,符合题意;C 、将混合气体通过灼热的氧化铜,氧化铜能与一氧化碳在加热的条件下反应生成铜和二氧化碳,收集气体可得纯净的二氧化碳,不符合题意;D 、氯化钠溶于水,泥沙不溶于水,加适量水充分溶解,过滤、蒸发结晶,可得氯化钠,不符合题意。
故选B 。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
中考化学初中化学化学除杂分离和提纯解题技巧及经典题型及练习题(含答案)一、中考化学除杂分离和提纯1.下列除去杂质的试剂和方法可行的是A.A B.B C.C D.D【答案】B【解析】试题分析:A、铁粉与硝酸银反应,生成银和硝酸亚铁,引来新的杂质,错误;B、硫酸钠与适量氯化钡反应,生成硫酸钡和氯化钠,正确;C、CO与澄清石灰水不发生反应,错误;D、氧化铜与氧气不发生化学反应,错误。
故选B考点:除杂质问题。
2.下列除去杂质的方法正确的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、除去二氧化碳中少量的氯化氢气体,把混合气体依次通过足量的NaOH溶液吸收,再用浓硫酸干燥,虽然能把氯化氢气体除去,但二氧化碳气体也被氢氧化钠吸收了,A不正确;B、除去碳酸氢钠固体中少量的碳酸钠,加热至固体质量不再发生变化,碳酸钠受热不易分解,而碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳气体,从而把碳酸氢钠除去了,B 不正确;C、除去氯化钙溶液中少量的稀盐酸,向溶液中加入过量的CaCO3,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳气体,再把过量的碳酸钙固体过滤除去,得到氯化钙溶液,C正确;D、除去硝酸钾溶液中少量的硫酸铜,向溶液中加入适量的NaOH溶液,氢氧化钠溶液与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,然后把沉淀过滤,虽然除去了硫酸铜,但得到的溶液中含有生成的硫酸钠,D不正确。
故选C。
【点睛】用化学方法除去混合物中某种杂质时,就是把杂质转化生成与主要物质不同状态的物质进行除去,但在除去过程中不能引进新的杂质。
3.下列实验操作中(括号内为杂质)不能达到实验目的的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、浓氢氧化钠溶液可以去除氯化氢,再经过浓硫酸可以去除水蒸气,得到较为纯净的氢气,选项A不符合题意;B、碳酸钙不溶于水,氯化钙溶于水,溶解过滤后,将固体洗涤、干燥后就可以得到纯净的碳酸钙,滤液经过蒸发溶剂,得到氯化钙,达到分离的目的,选项B不符合题意;C、氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,加入盐酸除杂,杂质和主要物质都被反应掉,选项C符合题意;D、铜金属活动性强于银,所以银不能置换出硫酸铜中的铜,因此观察不到有红色固体析出,由此判断银的金属活动性弱于铜,选项D不符合题意。
九年级化学化学除杂分离和提纯试题(有答案和解析)及解析一、中考化学除杂分离和提纯1.海水晒制的粗盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主SO、Ca2+、Mg2+的形式存在。
为将这些杂质除净,可向粗盐浴液中加入过量的氢氧要以2-4化钠、碳酸钠、氯化钡溶液、加入盐酸调至溶液pH=7、还有过滤等操作,最后经过蒸发得到精盐。
下列操作及加入溶液顺序错误的是A.BaCl2、NaOH、Na2CO3、过滤、HClB.BaCl2、Na2CO3、 NaOH、过滤、HClC.NaOH、 BaCl2、 Na2CO3、过滤、HClD.Na2CO3、BaCl2、 NaOH、过滤、HCl【答案】D【解析】【分析】【详解】镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;先除镁离子,或者先除硫酸根离子都可以,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了之后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。
据此分析各选项,D选项不符合上述要求。
故选D。
【点睛】粗盐精制中碳酸钠要在氯化钡之后加入,这样可除去过量的氯化钡。
2.下列实验方案中,能达到目的的是()A.分离CaCO3和NaCl的混合物:加水溶解、过滤、干燥B..制取Mg(OH)2:将Ba(OH)2溶液和MgSO4溶液混合后过滤C.除去H2中水蒸气和HCl气体:依次通过浓硫酸和NaOH溶液D..检验KCl溶液中混有的K2CO3:取样,加入足量的Ca(OH)2溶液【答案】D【解析】【分析】【详解】A、CaCO3和NaCl的混合物加水溶解、过滤得到碳酸钙和氯化钠溶液,氯化钠溶液需要蒸发结晶才能得到氯化钠,故A错;B、将Ba(OH)2溶液和MgSO4溶液混合后过滤,得到的是硫酸钡沉淀和氢氧化镁沉淀的混合物,故B错;C、除去H2中水蒸气和HCl气体,应依次通过NaOH溶液和浓硫酸,否则氢气中还会有水蒸气,C错;D、检验KCl溶液中混有的K2CO3,取样,加入足量的Ca(OH)2溶液,氢氧化钙能够和碳酸钾生成碳酸钙沉淀和氯化钾,有白色沉淀说明有碳酸钾,D正确;故选:D3.除去下列物质中少量杂质(括号内为杂质),所用除去杂质的方法正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、向混合溶液中加入适量锌粉,锌能与硫酸铜反应生成硫酸锌和铜,虽然除去了杂质,但是引入了新的杂质,不符合题意;B、氯化钾溶于水,二氧化锰不溶于水,加水溶解、过滤,可将二氧化锰除去,然后蒸发结晶可得氯化钾,不符合题意;C、向混合溶液中加入过量的氢氧化钠,氢氧化钠与氯化铁反应生成氢氧化铁和氯化钠,虽然除去了杂质,但是氢氧化钠过量,引入了新的杂质,不符合题意;D、将混合气体通过灼热足量的氧化铜,氧化铜与一氧化碳反应生成铜和二氧化碳,可将杂质除去,符合题意。
化学除杂分离和提纯中考经典题型带答案经典一、中考化学除杂分离和提纯1.欲除去下列物质中的少量杂质,所用试剂及方法不正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、因为二氧化碳不与铜反应,氧气在加热条件下可以与铜反应,所以可以除掉氧气,故正确;B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故正确;C、铁粉能与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故错误;D、碳酸钾能与适量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故正确。
故选:C。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.如表中除去物质中少量杂质的方法正确的是A.A B.B C.C D.D【答案】A【解析】试题分析:除杂质的原则:所加的物质只与杂质反应,不能引入新的杂质,A、除去氯化钙溶液中的稀盐酸,加入过量的碳酸钙,发生反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,然后再过滤,即可得到氯化钙溶液,正确,B、除去硫酸钾溶中的氢氧化钾,加入适量的稀盐酸,发生反应:KOH+HCl==KCl+H2O,引入了新的杂质KCl,错误,C、除去二氧化碳中氯化氢,通过足量的氢氧化钠溶液,两者都会发生反应,错误,D、除去二氧化锰中的氯化钾,根据二氧化锰不溶于水,氯化钾溶于水,故加水溶解、过滤、洗涤、烘干即可,不需要蒸发、结晶,错误,故选A考点:物质的除杂3.下列除杂、提纯的方法或选用的试剂中,不正确的是A.A B.B C.C D.D【答案】D【解析】【详解】A、因为硝酸钾的溶解度随温度升高而增大且变化较大,氯化钠的溶解度受温度影响较小,所以硝酸钾中混有少量氯化钠,可以采用降温结晶的方法提纯硝酸钾,选项A正确;B、氮气不能跟灼热的铜反应,氧气通过灼热的铜网时铜和氧气反应生成氧化铜,因此氮气中混有氧气时可以将混合气体通过灼热的铜网,氧气和铜反应生成氧化铜而除去,从而得到纯净的氮气,选项B正确;C、CaCl2溶液中含有稀盐酸,加入过量的碳酸钙,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,然后过滤得到氯化钙溶液,选项C正确;D、铁中混有铁锈,加入稀硫酸,铁和铁锈都能和稀硫酸反应,在除去铁锈的同时也使铁减少,不符合除杂原则,选项D不正确。
故选D。
【点睛】除杂时一定要注意:“不增”、“不减”、“易分离”。
4.下列除去杂质的方法正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、二氧化碳不燃烧,也不支持燃烧,故二氧化碳中混有少量一氧化碳,无法点燃,不符合题意;B、加水溶解、加入过量铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤除去生成的铜和过量的铁,即可得到氯化亚铁,符合题意;C、加入适量稀盐酸,氢氧化钙与稀盐酸反应生成氯化钙和水,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,虽然除去了碳酸钙,也除去了原物质,不符合题意;D、加适量硝酸银溶液,硝酸银与氯化钠反应生成氯化银和硝酸钠,盐酸与硝酸银反应生成氯化银和硝酸,虽然除去了杂质,也除去了原物质,不符合题意。
故选B。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
5.下列各组除杂质(括号内表示少量杂质)的试剂或方法错误的一组是A.NaCl溶液(MgCl2);适量NaOH溶液,过滤B.CaO(CaCO3);稀盐酸C.铜粉(铁粉);足量硫酸铜溶液,过滤D.O2(水蒸气);固体NaOH【答案】B【解析】【分析】【详解】A、MgCl2能与适量NaOH溶液反应生成氢氧化镁沉淀和氯化钠,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
B、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
C、铁粉能与硫酸铜溶液反应生成硫酸亚铁和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、氢氧化钠具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:B。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
6.除去二氧化碳中混有少量一氧化碳的方法是()A.将气体通过炽热的炭层B.将气体点燃C.将气体通过足量澄清石灰水中D.将气体通过灼热的氧化铜【答案】D【解析】【分析】【详解】A、将气体通过炽热的炭层,二氧化碳与碳反应产生一氧化碳;故选项错误;B、混合气体不易点燃;故选项错误;C、将气体通过足量澄清石灰水中,二氧化碳与氢氧化钙反应,剩余一氧化碳;故选项错误;D、将气体通过灼热的氧化铜,一氧化碳与氧化铁反应产生铜和二氧化碳;故选项正确;故选:D。
7.为除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,可将粗盐溶于水,再进行下列五步操作:①过滤②加过量的氢氧化钠溶液③加稍过量的盐酸④加过量的碳酸钠溶液⑤加过量的氯化钡溶液⑥蒸发结晶。
正确的操作顺序是()A.④②⑤③①⑥B.②④⑤①③⑥C.②⑤④①③⑥D.⑤④②③①⑥【答案】C【解析】【详解】镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,进行过滤,再加入稍过量盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后蒸发结晶,所以正确的顺序为:②⑤④①③⑥或⑤②④①③⑥。
故选:C。
【点睛】根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
8.下列除去杂质(括号内物质为杂质)的方法正确的是A.盐酸(硫酸)——加入过量的 BaC12溶液、过滤B.CaCl2溶液(稀盐酸)——加入过量的CaCO3、过滤C.CaO[Ca(OH)2]——加过量水,过滤D.MnO2(KCl)——加入适量的水,溶解、过滤、蒸发【答案】B【解析】【详解】A、加入过量的 BaC12溶液会引入新杂质,不符合除杂原则,选项错误;B、碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,将盐酸转化为氯化钙,过滤能除去过量的碳酸钙,得到纯净的氯化钙溶液,选项正确;C、过量的水会与氧化钙反应生成氢氧化钙,会将欲保留的物质反应掉,不符合除杂原则,选项错误;D、除去二氧化锰中的氯化钾,采用的方法是加入适量的水,溶解、过滤、洗涤干燥,选项错误,故选B。
【点睛】除杂的原则:1、不能引入新杂质;2、除杂剂只能与杂质反应,不能与欲保留的物质发生反应;3、最佳的除杂方法是除杂剂与杂质反应生成欲保留的物质。
9.下列实验操作一定能达到实验目的的是()A.A B.B C.C D.D【答案】D【解析】【详解】A、在混合溶液中加入足量的锌粉,锌能和氯化铜反应生成氯化锌和铜,锌也能和氯化亚铁反应生成氯化锌和铁,虽然除去了氯化铜,但是也除去了原物质,不符合题意;B、氢气和甲烷燃烧都有水生成,分别点燃,在火焰上方罩一干冷烧杯,都有水雾生成,不能达到目的,不符合题意;C、二氧化碳不燃烧也不支持燃烧,二氧化碳中混有少量一氧化碳,一氧化碳无法点燃,不能达到目的,不符合题意;D、将Zn和Ag分别放入CuSO4溶液中,锌能与硫酸铜反应生成硫酸锌和铜,有红色固体析出,说明在金属活动性顺序里,锌位于铜之前,银不与硫酸铜反应,说明在金属活动性顺序里,银位于铜之后,故可以比较Zn、Cu、Ag的金属活动性,符合题意。
故选D。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
10.下列除去杂质的方法正确的是A.A B.B C.C D.D【答案】B【解析】【详解】A、硫酸能与过量的BaCl2溶液反应生成硫酸钡沉淀和盐酸,能除去杂质但引入了新的杂质氯化钡(过量的),不符合除杂原则,故选项所采取的方法错误。
B、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、NaCl能与过量AgNO3溶液反应生成氯化银沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸银(过量的),不符合除杂原则,故选项所采取的方法错误。
D、CaO能与水反应生成氢氧化钙,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选:B。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。