基因工程知识点
- 格式:doc
- 大小:65.50 KB
- 文档页数:10
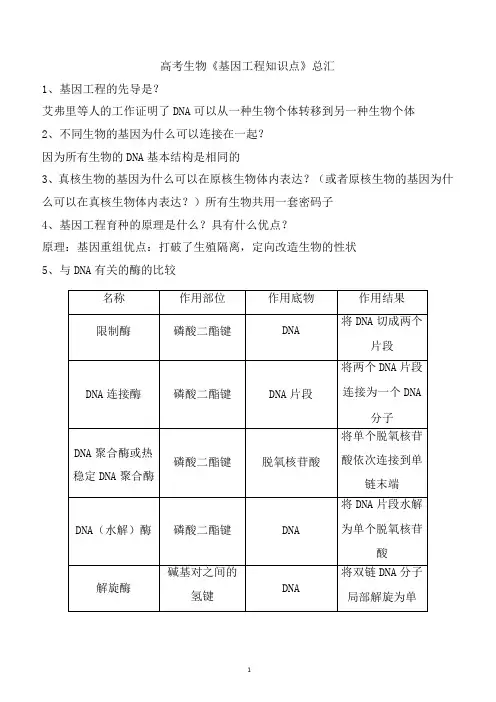
高考生物《基因工程知识点》总汇1、基因工程的先导是?艾弗里等人的工作证明了DNA可以从一种生物个体转移到另一种生物个体2、不同生物的基因为什么可以连接在一起?因为所有生物的DNA基本结构是相同的3、真核生物的基因为什么可以在原核生物体内表达?(或者原核生物的基因为什么可以在真核生物体内表达?)所有生物共用一套密码子4、基因工程育种的原理是什么?具有什么优点?原理:基因重组优点:打破了生殖隔离,定向改造生物的性状5、与DNA有关的酶的比较6、特定的核苷酸序列,并在特定的位点上进行切割7、限制酶不切割自身DNA的原因是什么?原核生物DNA分子中不存在该酶的识别序列或识别序列已经被修饰。
8、DNA连接酶可以连接什么样的末端?①同一种限制酶切割形成的相同的黏性末端②两种不同限制酶切割后形成的相同黏性末端③任意的两个平末端9、如何防止载体或目的基因的黏性末端自己连接即所谓“环化”?可用不同的限制酶分别处理含目的基因的DNA和载体,使目的基因两侧及载体上各自具有两个不同的黏性末端。
10、载体需具备的条件及其作用11、基因工程的基本操作步骤是哪四步?目的基因的获取;基因表达载体的构建;将目的基因导入受体细胞;目的基因的检测与鉴定12、目的基因的获取方法有哪些?三种方法都需要模板吗?①从基因文库中获取目的基因②利用PCR技术扩增目的基因③通过化学方法人工合成前两种需要模板,从基因文库中寻找目的基因时需要用DNA探针利用DNA分子杂交的方法找到目的基因;化学方法人工合成不需要模板,只要知道核苷酸序列就行,这是一个纯粹的化学反应13、CDNA文库和基因组文库的区别?cDNA是指以mRNA为模板,在逆转录酶的作用下形成的互补DNA。
以细胞的全部mRNA 逆转录合成的cDNA组成的重组克隆群体成为cDNA文库。
cDNA文库只包含表达的基因,并且逆转录得来的基因缺乏内含子和启动子、终止子等调控序列基因组文库指的是将某种生物的基因组DNA切割成一定大小的片段,并与合适的载体重组后导入宿主细胞,进行克隆得到的所有重组体内的基因组DNA片段的集合,它包含了该生物的所有基因。

基因工程绪论1、克隆(clone):作名词:含有目的基因的重组DNA分子或含有重组分子的无性繁殖。
作动词:基因的分离和重组的过程。
2、基因工程(gene engineering):体外将目的基因插入病毒、质粒、或其他载体分子中,构成遗传物质的新组合,并使之掺入到原先没有这些基因的宿主细胞内,且能稳定的遗传。
供体、受体和载体是基因工程的三大要素。
3、基因工程诞生的基础三大理论基础:40年代发现了生物的遗传物质是DNA;50年代弄清楚DNA 的双螺旋结构和半保留复制机理;60年代确定遗传信息的遗传方式。
以密码方式每三个核苷酸组成一个密码子代表一个氨基酸。
三大技术基础:限制性内切酶的发现;DNA连接酶的发现;载体的发现3、基因工程的技术路线:切:DNA片段的获得;接:DNA片段与载体的连接;转:外源DNA片段进出受体细胞;选:选择基因;表达:目的基因的表达;基因工程的工具酶1、限制性内切酶(restriction enzymes):主要是从原核生物中分离纯化出来的,是一类能识别双链DNA分子中某种特定核苷酸序列,并由此切割DNA双链的核酸内切酶。
2、限制酶的命名:属名(斜体)+种名+株系+序数3、II型限制性内切酶识别特定序列并在特定位点切割4、同裂酶:来源不同,其识别位点与切割位点均相同的限制酶。
5、同尾酶:来源不同,识别的靶序列不同,但产生相同的黏性末端的酶形成的新位点不能被原来的酶识别。
6、限制性内切酶的活性:在适当反应条件下,1小时内完全酶解1ug特定的DNA 底物,所需要的限制性内切酶的量为1个酶活力单位。
7、星号活性:改变反应条件,导致限制酶的专一性和酶活力的改变。
8、DNA连接酶的特点:具有双链特异性,不能连接两条单链DNA分子或闭合单链DNA,连接反应是吸能反应,最适反应温度是4至15度,最常用的是T4连接酶。
9、S1核酸酶:特异性降解单链DNA或RNA。
10、RNAH降解与DNA杂交的RNA,用于cDNA文库建立时除去RNA以进行第二链的合成。

名词说明1.基因工程:是将目的基因或DNA片段与适合的载体连接转入目标生物细胞,通过复制、转录、翻译外源目的基因和蛋白质的活性表达,使转基因生物取得新的遗传性状的操作。
2.限制性内切核酸酶:能够识别双链DNA分子中的某一段特定核苷酸序列,并在此切割DNA 双链的内切核酸酶。
3.同切点酶:又称同裂酶,是一类来源于不同微生物、能识别相同DNA序列的限制性内切核酸酶。
4.同尾酶:是一类限制性内切核酸酶,它们来源各异,识别的靶序列也各不相同,但切割后能产生相同的黏性结尾。
5.酶的星号活性(Star activity):高浓度的酶、高浓度的甘油、低离子强度、极端pH值等,会使一些核酸内切酶的识别和切割序列发生低特异性,即所谓的酶的星号活性现象。
连接酶:是能催化双链DNA片段靠在一路的3’羟基结尾与5’端磷酸基团结尾之间通过形成磷酸二酯键,使两结尾连接的一种核酸酶。
7.载体:在基因克隆中能携带外源基因进入受体细胞复制、整合或表达的工具称为载体。
8.多克隆位点:是包括多种同一个限制性酶切点的一段很短的9. α互补:为质粒DNA编码β—半乳糖苷酶的α亚基,宿主细胞可编码β亚基尽管宿主和质粒编码的片段各自都没有酶活性,但它们能够融为一体,形成具有酶学活性的蛋白质,这种互补现象叫α互补。
10.黏粒载体(考斯质粒载体):是一类人工构建的含有λ-DNAcos序列和质粒复制子的特殊类型的载体。
11.质粒:是生物细胞内固有的、能独立于寄主染色体而自主复制、并被稳固遗传的一类核酸分子12.探针:当用一个标记的核酸分子与核酸样品杂交,即可查明该样品中是不是存在与该标记核酸分子具有同源性的核酸分子。
那个标记的核酸分子称为探针(probe),能够是DNA,也能够是RNA,或合成的寡核苷酸.13、SD序列:是存在于原核生物起始密码子上游7-12个核苷酸内的一种4-7个核苷酸的保守片段,它与16SrRNA3’端反向互补,因此可将mRNA的AUG起始密码子置于核糖体的适当位置以便起始翻译作用。

基因工程总结一.概念(1)原理:。
(2)优点:与杂交育种相比,;与诱变育种相比,。
(3)基因工程成功的原因:①成功拼接的原因:②成功表达的原因:二.基本工具1、两种酶:(1) :作用特点:。
(2) :E·coli DNA连接酶与T4 DNA连接酶的区别:2、一种运载体(1)条件:①;②;③具有特殊的标记基因(作用:)(2)种类:最常用;其他动植物病毒、三、操作程序(1) :方法:①:不知道脱氧核苷酸序列②:已知目的基因两端一小段序列,便于③利用化学方法人工合成:知道全部序列,且基因比较小。
这种方法不需要模板。
(2) ——基因工程的核心基因表达载体的组成:(3)(4)①目的基因是否插入到转基因生物的染色体DNA上:②是否转录:③是否翻译:④个体水平鉴定:抗虫、抗病接种实验易错点说明:1、切割目的基因和运载体的要求:用限制酶。
目的是:。
同种的含义是:同一种或相同两种,即单酶切或双酶切。
选择双酶切的原因是。
2、工具≠工具酶;运载体≠质粒。
3、启动子≠起始密码子,终止子≠终止密码子起始密码子和终止密码子位于mRNA上,分别控制翻译过程的启动和终止。
启动子:。
终止子:一段有特殊结构的DNA短片段,位于基因的尾端,作用是使转录过程停止。
4、基因探针的要求:①单链②有③5、农杆菌转化法中的“2”次导入:第一次:将含有目的基因的T—DNA的质粒导入农杆菌;第二次(非人工操作):将含有目的基因的T—DNA导入受体细胞并整合到植物细胞的染色体DNA上。
6、转化:。
7、(1)乳腺生物反应器与化学反应器比较,优点是:质量稳定,成本低廉,无污染,经济效益显著。
(2)乳腺生物反应器与膀胱生物反应器比较,或者优点是:①收集产物更容易,不必对动物造成伤害;②从动物一出生就可以收集;③与性别无关。
8、将目的基因导入植物细胞采用最多的方法;导入单子叶植物最常用且成本较高的方法;我国科学家独创且简便经济的方法。
巩固练习1、下图中的图1是Eco RⅠ限制酶的作用示意图。

高中生物选修三专题一基因工程知识点专题一基因工程基因工程的概念基因工程就是指按照人们的心愿,展开严苛的设计,通过体外dna重组和转基因技术,剥夺生物以代莱遗传特性,缔造出以合乎人们须要的代莱生物类型和生物产品。
基因工程就是在dna分子水平上展开设计和施工的,又叫作dna重组技术。
(一)基因工程的基本工具1.“分子手术刀”——限制性核酸内乌酶(管制酶)(1)来源:主要是从原核生物中分离纯化出来的。
(2)功能:能辨识双链dna分子的某种特定的核苷酸序列,并且并使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
(3)结果:经管制酶研磨产生的dna片段末端通常存有两种形式:黏性末端和平末端。
黏性末端:当限制酶从识别序列的中心轴线两侧切开时,被限制酶切开的dna两条单链的切口,带有几个伸出的核苷酸,他们之间正好互补配对,这样的切口叫黏性末端。
平末端:当管制酶从辨识序列的中心轴线处剖开时,剖开的dna两条单链的切口,就是平坦的,这样的切口叫做元显恭末端。
2.“分子缝合针”——dna连接酶(1)两种dna连接酶(e·colidna连接酶和t4-dna连接酶)的比较:①相同点:都缝合磷酸二酯键。
②区别:e·colidna连接酶源于大肠杆菌,就可以将双链dna片段优势互补的黏性末端之间的磷酸二酯键连接起来;而t4dna连接酶能缝合两种末端,但连接平末端的之间的效率较低。
(2)与dna聚合酶促进作用的优劣:dna聚合酶只能将单个核苷酸加到已有的核苷酸片段的末端,形成磷酸二酯键。
dna连接酶是(1)载体具有的条件:①能够在受到体细胞中激活并平衡留存。
②具有一至多个限制酶切点,供外源dna片段插入。
③具备标记基因,可供重组dna的鉴别和挑选。
④对受体细胞无害。
(2)最常用的载体就是质粒,它就是一种外露的、结构直观的、单一制于细菌染色体之外,并具备自我复制能力的双链环状dna分子。


第一章基因工程概述1.什么是基因工程,基因工程的基本流程基因工程Genetic engineering原称遗传工程;从狭义上讲,基因工程是指将一种或多种生物体供体的基因与载体在体外进行拼接重组,然后转入另一种生物体受体内,使之按照人们的意愿遗传并表达出新的性状;因此,供体、受体和载体称为基因工程的三大要素;1.分离目的基因2.限制酶切目的基因与载体3.目的基因和载体DNA在体外连接4.将重组DNA分子转入合适的宿主细胞,进行扩增培养5.选择、筛选含目的基因的克隆6.培养、观察目的基因的表达第二章基因工程的载体和工具酶1. 基因工程载体必须满足哪些基本条件➢具有对受体细胞的可转移性或亲和性;➢具有与特定受体细胞相适应的复制位点或整合位点;➢具有多种单一的核酸内切酶识别切割位点;➢具有合适的筛选标记;➢分子量小,拷贝数多;➢具有安全性;2. 质粒载体有什么特征,有哪些主要类型1、自主复制性2、可扩增性3、可转移性4、不相容性主要类型有1.克隆质粒2.测序质粒3.整合质粒4.穿梭质粒5.探针质粒6.表达质粒3. 质粒的构建1删除不必要的 DNA 区域,尽量缩小质粒的分子量,以提高外源 DNA 片段的装载量;一般来说,大于20Kb 的质粒很难导入受体细胞,而且极不稳定;2灭活某些质粒的编码基因,如促进质粒在细菌种间转移的 mob 基因,杜绝重组质粒扩散污染环境,保证 DNA 重组实验的安全,同时灭活那些对质粒复制产生负调控效应的基因,提高质粒的拷贝数3加入易于识别的选择标记基因,最好是双重或多重标记,便于检测含有重组质粒的受体细胞;4在选择性标记基因内引入具有多种限制性内切酶识别及切割位点的 DNA序列,即多克隆接头Polylinker,便于多种外源基因的重组,同时删除重复的酶切位点,使其单一化,以便环状质粒分子经酶处理后,只在一处断裂,保证外源基因的准确插入;5根据外源基因克隆的不同要求,分别加装特殊的基因表达调控元件;4. 什么是人工染色体载体将细菌接合因子、酵母或人类染色体上的复制区、分配区、稳定区与质粒组装在一起,即可构成染色体载体5. 什么是穿梭载体人工构建的、具有两种不同复制起点和选择标记、可以在两种不同的寄主细胞中存活和复制的载体;6.入-噬菌体载体及构建-DNA为线状双链DNA分子,长度为,在分子两端各有12个碱基的单链互补粘性末端;➢1缩短长度提高外源 DNA 片段的有效装载量删除重复的酶切位点➢引入单一的多酶切位点接头序列,增加外源DNA片段克隆的可操作性➢灭活某些与裂解周期有关基因;➢使λ-DNA载体只能在特殊的实验条件下感染裂解宿主细菌,以避免可能出现的污染现象的发生;➢加装选择标记,便于重组体的检测单链噬菌体DNA载体➢过定点诱变技术封闭重复的重要限制性酶切口;➢引入合适的选择性标记基因,如含有启动子、操作子和半乳糖苷酶氨基端编码序列lacZ’的乳糖操纵子片段lac、组氨酸操纵子片段his以及抗生素抗性基因等;➢将人工合成的多克隆位点接头片段插在 lacZ’标记基因内部,使得含有重组子的噬菌斑呈白色,而只含有载体 DNA 的混浊噬菌斑呈蓝色;➢4在多克隆位点接头片段的两侧区域改为统一的 DNA 测序引物序列,使得重组 DNA 分子的单链形式经分离纯化后,可直接进行测序反应;8. II类限制性内切核酸酶的特点限制性核酸内切酶 Restriction endonucleases是一类能在特异位点上催化双链DNA 分子的断裂,产生相应的限制性片段的核酸水解酶;➢识别位点的特异性:每种酶都有其特定的DNA识别位点,通常是由4、5或6核苷酸组成的特定序列靶序列;➢识别序列的对称性:靶序列通常具有双重旋转对称的结构,即双链的核苷酸顺序呈回文结构;➢切割位点的规范性:双链DNA被酶切后,分布在两条链上的切割位点旋转对称可形成粘性末端或平末端的DNA分子;同位酶:一部分酶识别相同的序列,但切点不同,这些酶称为同位酶;同裂酶:识别位点与切割位点均相同的不同来源的酶称为同裂酶同尾酶Isocandamers:识别位点不同,但切出的 DNA 片段具有相同的末端序列,这些酶称为同尾酶;9.甲基化酶Ⅱ类限制性内切酶有相应甲基化酶伙伴,甲基化酶的识别位点与限制性内切酶相同,并在识别序列内使某位碱基甲基化,从而封闭该酶切口;甲基化酶在封闭一个限制性内切酶切口的同时,却产生出另一种酶的切口➢甲基化酶可修饰限制性核酸内切酶识别序列,从而使DNA免受相应的限制性核酸内切酶的切割;➢甲基化酶的用途就是在必要时可以封闭某一限制性核酸内切酶的酶切位点;连接酶连接作用的特点:①DNA连接酶需要一条DNA链的3’末端有一个游离的羟基-OH,另一条DNA链的5’末端有一个磷酸基-P的情况下,只有在这种情况下,才能发挥连接DNA分子的作用;②只有当3’-OH和5’-P彼此相邻,并且各自位于与互补链上的互补碱基配对的两个脱氧核苷酸末端时,DNA连接酶才能将它们连接成磷酸二酯键;③DNA连接酶不能连接两条单链的DNA分子或环化的单链DNA分子,被连接的DNA链必须是双螺旋DNA分子的一部分;④DNA连接酶只能封闭双螺旋DNA上失去一个磷酸二酯键所出现的单链缺口nick,而不能封闭双链DNA的某一条链上失去一个或数个核苷酸所形成的单链裂口gap;⑤由于在羟基和磷酸基团之间形成磷酸二酯键是一种吸能反应,因此,DNA连接酶在进行连接反应时,还需要提供一种能源分子NAD+或ATP11.大肠杆菌 DNA聚合酶和Klenow大片段各有什么作用DNA聚合酶作用的特点:➢要有底物4种dNTP为前体催化合成DNA;➢接受模板指导;➢需要有引物3’羟基的存在;➢不能起始合成新的DNA链;➢催化dNTP加到生长中的DNA链3’-OH末端;➢催化DNA的合成方向是5’→3’;Klenow酶的基本性质:➢大肠杆菌DNA聚合酶I经胰蛋白酶或枯草杆菌蛋白酶部分水解生成的C末端604个氨基酸残基片段,即Klenow酶;分子量为76kDa;➢Klenow酶仍拥有5’→3’的DNA聚合酶活性和5’→3’的核酸外切酶活性,但失去了5’→3’的核酸外切酶活性;Klenow酶的基本用途:➢修复由限制性核酸内切酶造成的 3’凹端,使之成为平头末端;➢以含有同位素的脱氧核苷酸为底物,对DNA片段进行标记;➢用于催化 cDNA 第二链的合成;➢用于双脱氧末端终止法测定 DNA 的序列;聚合酶T4-DNA聚合酶酶的基本特性:➢有3’→5’的核酸外切酶活性和5’→3’的DNA聚合酶活性;➢在无dNTP时,可以从任何3’-OH端外切;➢在只有一种dNTP时,外切至互补核苷酸;➢在四种dNTP均存在时,聚合活性占主导地位;T4-DNA聚合酶的基本用途:切平由核酸内切酶产生的3’粘性末端13. 影响连接效率的因素有:➢温度最主要的因素离子浓度➢ATP的浓度 10μM - 1μM➢连接酶浓度平末端较粘性末端要求高➢反应时间通常连接过夜➢插入片段和载体片段的摩尔比➢DNA末端性质➢DNA片段的大小14.如何将不同DNA分子末端进行连接1.相同粘性末端的连接如果外源DNA与载体DNA均用相同的限制性内切酶切割,则不管是单酶酶解还是双酶联合酶解,两种DNA分子均含有相同的粘性末端,因此混合后能顺利的连接成一个重组DNA分子 2.平头末端的连接T4-DNA连接酶在ATP和高浓度酶的条件下,能连接具有完全碱基配对的平末端DNA分子,但平末端连接效率不高,基因操作不经常采用;3.不用粘性末端的连接3’端的粘性末端用T4-DNA聚合酶切平5’端的粘性末端用klenow酶补平,或者用S1核酸酶切平最后用T4-DNA连接酶进行平末端连接15. 碱性磷酸酶有什么作用1.该酶用于载体 DNA的5’末端除磷操作,以提高重组效率;2.用于外源DNA片段的5’端除磷,则可有效防止外源 DNA 片段之间的连接;16. 末端脱氧核苷酸转移酶有哪些作用➢给载体或目的DNA加上互补的同聚物尾;➢DNA片段3’末端的同位素标记;17. 2、细菌转化的步骤:∙感受态的形成;感受态时细胞表面出现各种蛋白质和酶类,负责转化因子的结合、切割及加工;感受态细胞能分泌一种小分子量的激活蛋白或感受因子,其功能是与细胞表面受体结合,诱导某些与感受态有关的特征性蛋白质如细菌溶素的合成,使细菌胞壁部分溶解,局部暴露出细胞膜上的 DNA 结合蛋白和核酸酶等;∙转化因子的结合;受体菌细胞膜上的DNA结合蛋白可与转化因子的双链DNA结构特异性结合,单链DNA或RNA双链RNA以及DNA/RNA杂合双链都不能结合在膜上;∙转化因子的吸收;双链 DNA 分子与结合蛋白作用后,激活邻近的核酸酶,一条链被降解,而另一条链则被吸收到受体菌中;∙整合复合物前体的形成;进入受体细胞的单链 DNA 与另一种游离的蛋白因子结合,形成整合复合物前体结构,它能有效地保护单链DNA免受各种胞内核酸酶的降解,并将其引导至受体菌染色体DNA处;∙转化因子单链DNA的整合;供体单链DNA片段通过同源重组,置换受体染色体DNA的同源区域,形成异源杂合双链 DNA结构;+诱导转化原理:①在0℃的Cacl2低渗溶液中,细菌细胞发生膨胀,同时Cacl2使细胞膜磷脂层形成液晶结构促使细胞外膜与内膜间隙中的部分核酸酶解离开来,诱导大肠杆菌形成感受态;②Ca2+能与加入的DNA分子结合,形成抗DNA酶DNase的羟基-磷酸钙复合物,并黏附在细菌细胞膜的外表面上;当42℃热刺激短暂处理细菌细胞时,细胞膜的液晶结构发生剧烈扰动,并随之出现许多间隙,为DNA分子提供了进入细胞的通道;③Mg2+对DNA分子有很大的稳定性作用,因此利用Mgcl2与Cacl2共同处理大肠杆菌细胞,可以提高DNA的转化效率;∙但该法要求条件高,对外界污染物极为敏感,通常很少采用;介导细菌的原生质体转化∙PEG是乙二醇的多聚物, 存在不同分子量的多聚体,它可改变各类细胞的膜结构, 使两细胞相互接触部位的膜脂双层中脂类分子发生疏散和重组,此时相互接触的两细胞的胞质沟通成为可能,从而造成细胞之间发生融合;20.电穿孔法是指在细胞上施加短暂、高压的电流脉冲,在质膜上形成纳米大小的微孔,DNA直接通过这些微孔或者作为微孔闭合时所伴随发生的膜组分重新分布通过质膜进入细胞质中,这种方法称为电穿孔法;P52 接合转化,入噬菌体感染未归纳21.转化率的影响因素.载体及重组DNA方面载体本身的性质:不同的载体转化同一株受体细胞,其转化率不同;载体的空间构象:与受体细胞亲和性较强的质粒载体转化率要高于亲和性较弱的质粒载体; 插入片段大小:对质粒载体而言,插入片段越大,转化效率越低;重组DNA分子的浓度和纯度受体细胞方面:受体细胞必须与载体相匹配转化操作的影响22.转化细胞的扩增转化细胞的扩增操作:指转化完成之后细胞的短时间培养;在实验时,扩增操作往往与转化操作偶联在一起,如:∙Ca2+诱导转化后的37℃培养一个小时∙原生质体转化后的再生过程∙λ噬菌体转染后的30℃培养等,均属扩增操作扩增操作的目的∙增殖转化细胞,使得有足够数量的转化细胞用于筛选程序;∙扩增和表达载体分子上的标记基因,便于筛选;∙表达外源基因,便于筛选和鉴定;23.抗药性筛选法这是利用载体DNA分子上的抗药性选择标记进行的筛选方法;抗药性筛选法的基本原理:抗药性筛选法可区分转化子与非转化子、重组子与非重组子将外源DNA片段插在EcoRI位点:∙非重组子呈 Apr、Tcr∙重组子呈 Apr、Tcr将外源DNA片段插在BamHI位点:∙非重组子呈 Apr、Tcr∙重组子呈 Apr、Tcs抗药性筛选法的基本操作:先将转化液涂布含有Ap的平板再将Ap平板上的转化子影印至含有Tc的平板上在Ap平板上生长,但在Tc平板上不长的转化子即为重组子 P56抗药性标记插入失活选择法∙经过上述抗药性筛选获得的大量转化子中既包括需要的重组子,也含有不需要的非重组子;为了进一步筛选出重组子,可利用质粒载体的双抗药性进行再次筛选;如果外源基因插入在载体的抗药性基因中间使得该抗药性基因失活,这种抗药性标记就会消失,从而筛选出阳性重组子;24. 什么是蓝白斑筛选法这种方法是根据组织化学的原理来筛选重组体;主要是在λ载体的非必要区插入一个带有大肠杆菌β—半乳糖苷酶的基因片段,携带有lac基因片段的λ载体转入lac的宿主菌后,在含有5—溴—4—氯—3—引哚—β—D—半乳糖苷X-gal平板上形成浅蓝色的噬菌斑;外源基因插人lac或lac基因部分被取代后,重组的噬菌体将丧失分解X-gal的能力,转入lac-宿主菌后,在含有5—溴—4—氯—3—引哚—β—D—半乳糖苷 X-gal平板上形成白色的噬菌斑,非重组的噬菌体则为蓝色噬菌斑;筛选法利用合适的引物,以从初选出来的阳性克隆中提出的质粒为模板进行PCR,通过对PCR产物的电泳分析,确定目的基因是否插入到载体中;由于在载体DNA分子中,外源DNA插入位点的两侧序列多数是已知的,可以设计合成相应的PCR引物,以待鉴定的转化子或重组子的DNA为模板进行PCR反应,反应产物经琼脂糖凝胶电泳,若出现特异性扩增DNA带,并且其分子量同预期的一致,则可确定含此重组DNA分子的重组子是期待的重组子;第三章基因工程的常规技术1. 探针有哪些类型探针标记有哪些方法类型:同源或部分同源探针cDNA探针人工合成的寡核苷酸探针标记方法:①5’端标记法②反转录标记法③缺刻前移标记法④ABC标记法4.什么是ABC荧光显色酶标记法ABC 标记法;∙A为Avidin生物素抗性蛋白,每个Avidin分子可结合3 - 4个生物素分子;∙B为Biotin生物素,每个Biotin分子可结合2个Avidin分子;∙C为Complex,首先将Biotin共价结合在探针分子上,荧光胺标记在Avidin上,两者形成复合物,即可将荧光胺标记在探针上,发出的荧光也能使普通胶片感光;如果将某一生色酶接在Avidin上,并辅以合适底物,则杂交反应还可直接以颜色反应检测,这一技术称为酶标技术5.亚克隆法∙亚克隆:是将克隆片段进一步片段化后再次进行的克隆;∙一般是将重组DNA分别用几种限制性核酸内切酶切割后,将所得各片段分别重组到载体上再转化宿主细胞,然后通过转化细胞的表型鉴定或鉴定,获得含有目的基因的重组子;此时,该重组分子中的无关DNA区域以被大量删除;6. 菌落嗜菌斑原位杂交的基本原理、流程∙该项技术是直接把菌落印迹转移到硝酸纤维素滤膜上,经溶菌和变性处理后使DNA 暴露出来并与滤膜原位结合再与特异性DNA探针杂交,筛选出含有插入序列菌落;∙操作步骤:∙①菌落生长∙②转移到NC膜上∙③DNA释放和变性∙变成单链DNA:∙ 10%SDS NaOH∙④中和 Tris-HCl pH∙⑤固定 80 ℃ 120’∙⑥杂交包括预杂交,加探针DNA杂交∙⑦放射自显影∙⑧对照比较,选出重组克隆7.鸟枪法∙鸟枪法:将某种生物体的全基因组或单一染色体切成大小适宜的 DNA 片段,分别连接到载体 DNA上,转化受体细胞,形成一套重组克隆,从中筛选出含有目的基因的期望重组子;鸟枪法制备目的基因的主要步骤∙①目的基因组DNA片段的制备超声波处理:片段长度均一,大小可控,平头末端;原核生物的基因长度大都在2Kb以内,真核生物的基因长度变化很大,最大的基因可达100Kb以上;全酶切:片段长度不均一,粘性末端便于连接,但有可能使目的基因断开,大小不可控;部分酶切:片段长度可控,含有粘性末端,目的基因完整;∙②DNA片段与载体连接如果转化子采用菌落原位杂交法或限制性酶切图谱法筛选,则选择多拷贝克隆载体;如果转化子采用基因产物功能检测法筛选,则选择表达型载体;∙③重组DNA分子导入受体细胞如果转化子采用菌落原位杂交法或限制性酶切图谱法筛选,则选择大肠杆菌作为受体细胞;如果转化子采用基因产物功能检测法筛选,则选择能使目的基因表达的受体细胞;∙④筛选含有目的基因的目的重组子菌落原位杂交法、基因产物功能检测法筛选模型的建立;∙⑤目的基因的定位利用鸟枪法获得的期望重组子只是含有目的基因的 DNA 片段,必须通过次级克隆或插入灭活,在已克隆的 DNA 片段上准确定位目的基因,然后对目的基因进行序列分析,搜寻其编码序列以及可能存在的表达调控序列;法酶促逆转录主要用于合成分子质量较大,转录产物mRNA易分离的目的基因;这种方法以目的基因的mRNA为模板,在逆转录酶的作用下合成互补的DNA,即cDNA,然后在DNA聚合酶的催化下合成双链cDNA片段,与适当的载体重组后转入受体菌扩增,获得目的基因的cDNA克隆; 的分离纯化绝大多数的真核生物mRNA在其3’端都存在一个多聚腺苷酸的尾巴,利用它可以迅速的将mRNA从细胞总的混合物中分离出来,将寡聚脱氧胸腺嘧啶共价交联在纤维素分子上,制成亲和层析柱,然后将细胞总的RNA混合物上层析柱分离,mRNA会挂在层析住上,后洗脱即可分离10. 简述PCR技术的基本原理,PCR反应体系的主要成分与主要程序是怎样的PCR技术的基本原理:类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物;过程:PCR由变性--退火--延伸三个基本反应步骤构成:①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR 扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备;②模板DNA与引物的退火复性:模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;③引物的延伸:DNA模板--引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链;重复循环变性--退火--延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板;每完成一个循环需2~4分钟, 2~3小时就能将待扩目的基因扩增放大几百万倍;11. 什么是基因组文库其构建方法是怎样的是指将某种生物的全部基因组的遗传信息贮存在可以长期保存的稳定的重组体中,以备需要时能够随时应用它分离所需要的目的基因,这种保存基因遗传信息的材料,就称为基因文库又称DNA文库;基因组文库构建的一般步骤①载体的选择和制备;②高纯度、大分子量基因组 DNA 的提取;③基因组 DNA 的部分酶切与分级分离;④载体与DNA片段的连接;⑤转化或侵染宿主细胞;⑥筛选鉴定基因组及保存;12. 基因组DNA文库的质量标准除了尽可能高的完备性外,一个理想的基因组DNA文库应具备下列条件:∙重组克隆的总数不宜过大,以减轻筛选工作的压力∙载体的装载量最好大于基因的长度,避免基因被分隔克隆;∙克隆与克隆之间必须存在足够长度的重叠区域,以利于克隆排序;∙克隆片段易于从载体分子上完整卸下;∙重组克隆能稳定保存、扩增、筛选;基因文库的构建通常采用鸟枪法和cDNA法13.外源DNA片段的切割原则片段之间要有一定的重叠序列片段大小要均一文库构建的步骤∙细胞总RNA的提取和mRNA的分离∙第一链cDNA合成∙第二链cDNA合成∙双链cDNA的分级分离∙双链cDNA克隆进质粒或噬菌体载体并导入宿主中繁殖∙重组体的筛选与鉴定第四章基因在大肠杆菌、酵母的高效表达1. 启动子∙启动子:是DNA链上一段能与RNA聚合酶结合并能起始转录的序列,其大小在20~300个碱基,是控制基因转录的重要调控元件;在一定条件下mRNA的合成速率与启动子的强弱密切相关,而转录又在很大程度上影响基因的表达;∙启动子的特征:①序列特异性②方向性③位置特性④种属特异性2.启动子类型∙组成型启动子:是指在该类启动子控制下,结构基因的表达大体恒定在一定水平上,在不同组织、部位表达水平没有明显差异;∙组织特异启动子:又称器官特异性启动子;在这类启动子调控下,基因往往只在某些特定的器官或组织部位表达,并表现出发育调节的特性;∙诱导型启动子:是指在某些特定的物理或化学信号的刺激下,该种类型的启动子可以大幅度地提高基因的转录水平;目前已经分离了光诱导表达基因启动子、热诱导表达基因启动子、创伤诱导表达基因启动子、真菌诱导表达基因启动子和共生细菌诱导表达基因启动子等;3.终止子终止子:是位于结构基因下游的一段DNA序列,基因转录时,该序列被转录为mRNA的一部分,并形成特殊的二级结构,由此终止基因的转录;序列SD序列:mRNA中起始密码子上游8-13个核苷酸处有一段富含嘌呤核苷酸的顺序,它可以与30S亚基中的16S rRNA 3’端富含嘧啶的尾部互补,形成氢键结合,有助于mRNA的翻译从起始密码子处开始5.密码子不同生物对密码子的偏爱性1.生物体基因组中的碱基含量2.密码子与反密码子的相互作用的自由能3.细胞内tRNA的含量6. 密码子偏爱性对外源基因表达的影响∙由于原核生物和真核生物基因组中密码子的使用频率具有较大程大的差异性,因此外源基因尤其是高等哺乳动物基因在大肠杆菌中高效翻译的一个重要因素是密码子的正确选择;一般而言,有两种策略可以使外源基因上的密码子在大肠杆菌细胞中获得最佳表达:∙外源基因全合成∙同步表达相关tRNA编码基因7. 包涵体及其性质在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体8. 包涵体的形成机理∙①折叠状态的蛋白质集聚作用;∙②非折叠状态的蛋白质集聚作用∙③蛋白折叠中间体的集聚作用;9. 包涵体的分离检测∙包涵体的分离主要包括菌体破碎、离心收集以及清洗三大操作步骤;10. 分泌型目的蛋白表达系统的构建∙包括大肠杆菌在内的绝大多数革兰氏阴性菌不能将蛋白质直接分泌到胞外,但有些革兰氏阴性菌能将细菌的抗菌蛋白细菌素分泌到培养基中,这一过程严格依赖于细菌素释放蛋白,它激活定位于内膜上的磷酸酯酶A,导致细菌内外膜的通透性增大∙因此,只要将细菌素释放蛋白编码基因克隆在一个合适的质粒上即可构建完全分泌型的受体细胞;此时,用另一种携带大肠杆菌信号肽编码序列和目的基因的表达质粒转化上述完全分泌型受体细胞,并使用相同性质的启动子介导目的基因的转录,则可实现目的蛋白从重组大肠杆菌中的完全分泌;11融合蛋白表达质粒的构建原则:∙受体细胞的结构基因能高效表达,且其表达产物可以通过亲和层析进行特异性简单纯化;。

高中生物基因工程相关知识点1.“分子手术刀”——限制性核酸内切酶限制酶1来源:主要是从原核生物中分离纯化出来的。
2功能:能够识别双链DNA分子的某种特定的核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
3结果:经限制酶切割产生的DNA片段末端通常有两种形式:黏性末端和平末端。
2.“分子缝合针”——DNA连接酶1两种DNA连接酶E•coliDNA连接酶和T4-DNA连接酶的比较:①相同点:都缝合磷酸二酯键。
②区别:E•coliDNA连接酶来源于T4噬菌体,只能将双链DNA片段互补的黏性末端之间的磷酸二酯键连接起来;而T4DNA连接酶能缝合两种末端,但连接平末端的之间的效率较低。
2与DNA聚合酶作用的异同: DNA聚合酶只能将单个核苷酸加到已有的核苷酸片段的末端,形成磷酸二酯键。
DNA连接酶是连接两个DNA片段的末端,形成磷酸二酯键。
3.“分子运输车”——载体1载体具备的条件:①能在受体细胞中复制并稳定保存。
②具有一至多个限制酶切点,供外源DNA片段插入。
③具有标记基因,供重组DNA的鉴定和选择。
2最常用的载体是--质粒,它是一种裸露的、结构简单的、独立于细菌染色体之外,并具有自我复制能力的双链环状DNA分子。
3其它载体:噬菌体的衍生物、动植物病毒第一步:目的基因的获取1.目的基因是指:编码蛋白质的结构基因。
2.原核基因采取直接分离获得,真核基因是人工合成。
人工合成目的基因的常用方法有反转录法和化学合成法。
3.PCR技术扩增目的基因1原理:DNA双链复制2过程:第一步:加热至90~95 ℃DNA解链;第二步:冷却到55~60 ℃,引物结合到互补DNA链;第三步:加热至70~75 ℃,热稳定DNA聚合酶从引物起始互补链的合成。
第二步:基因表达载体的构建1.目的:使目的基因在受体细胞中稳定存在,并且可以遗传至下一代,使目的基因能够表达和发挥作用。
2.组成:目的基因+启动子+终止子+标记基因1启动子:是一段有特殊结构的DNA片段,位于基因的首端,是RNA聚合酶识别和结合的部位,能驱动基因转录出mRNA,最终获得所需的蛋白质。

生物基因工程知识点1. 基因工程定义基因工程,又称遗传工程,是指通过人工手段对生物体的基因进行改造,以实现对生物体性状的改变和新品种的培育。
它包括基因克隆、基因转移、基因编辑等多个技术环节。
2. 基因克隆基因克隆是指将特定的基因片段从供体生物体中提取出来,并在体外进行复制和扩增的过程。
这一过程通常涉及限制性内切酶、DNA连接酶和载体等分子生物学工具。
3. 基因转移基因转移是将克隆的基因片段导入到受体细胞中,使其成为受体细胞基因组的一部分,并能够表达出新的性状。
常用的基因转移方法包括质粒介导、病毒载体和基因枪等。
4. 基因编辑基因编辑是指对生物体基因组中的特定位点进行精确的添加、删除或替换。
CRISPR-Cas9是目前最流行的基因编辑技术,它允许科学家在细胞中进行特定DNA序列的编辑。
5. 转基因生物转基因生物是指通过基因工程技术改变了基因组的生物。
这些生物可能会展现出抗虫、抗病、抗旱等特性,或者提高营养价值。
6. 伦理和法律问题基因工程的发展引发了一系列伦理和法律问题,包括生物安全、生物多样性保护、知识产权和公众接受度等。
各国政府和国际组织都在制定相关法规以确保基因工程的安全和合理应用。
7. 基因工程的应用基因工程在农业、医学、工业生产和环境保护等多个领域都有广泛应用。
例如,在医学领域,基因工程被用于生产重组蛋白药物;在农业领域,用于培育抗病虫害的转基因作物。
8. 安全性评估由于基因工程可能对环境和人类健康产生影响,因此对转基因生物的安全性评估至关重要。
这包括对转基因生物的环境影响、长期食用安全性等进行系统的研究和评估。
9. 未来发展趋势基因工程的未来发展趋势包括提高基因编辑的精确性和效率、发展新的基因工程技术、加强跨学科研究以及推动基因工程在全球范围内的合理应用和监管。
10. 公众教育和沟通鉴于基因工程的复杂性和伦理问题,公众教育和沟通显得尤为重要。
科学家和政策制定者需要与公众进行有效沟通,提高公众对基因工程的理解,促进科学决策的制定。

高中生物基因工程知识点总结一、基因工程的概念基因工程,又称为重组 DNA 技术,是指按照人们的愿望,进行严格的设计,并通过体外 DNA 重组和转基因等技术,赋予生物以新的遗传特性,从而创造出更符合人们需要的新的生物类型和生物产品。
基因工程是在 DNA 分子水平上进行的操作,它打破了物种之间的界限,实现了不同物种之间基因的重新组合。
二、基因工程的工具1、限制性核酸内切酶(简称限制酶)限制酶能够识别双链 DNA 分子的某种特定核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开。
限制酶主要是从原核生物中分离纯化出来的。
2、 DNA 连接酶DNA 连接酶的作用是将两个具有相同末端的 DNA 片段连接起来,形成磷酸二酯键。
根据来源不同,DNA 连接酶可以分为两类:E·coli DNA 连接酶和 T4DNA 连接酶。
3、运载体常用的运载体有质粒、噬菌体和动植物病毒等。
运载体需要具备的条件有:能够在宿主细胞中复制并稳定保存;具有多个限制酶切点,以便与外源基因连接;具有标记基因,便于进行筛选。
三、基因工程的基本操作程序1、目的基因的获取目的基因是指人们所需要的编码蛋白质的结构基因。
获取目的基因的方法主要有:从基因文库中获取、利用 PCR 技术扩增目的基因以及通过化学方法人工合成。
2、基因表达载体的构建基因表达载体的构建是基因工程的核心步骤。
一个基因表达载体的组成包括目的基因、启动子、终止子、标记基因等。
启动子是一段有特殊结构的 DNA 片段,位于基因的首端,是 RNA 聚合酶识别和结合的部位,能驱动基因转录出 mRNA。
终止子位于基因的尾端,也是一段有特殊结构的 DNA 片段,能终止转录。
标记基因的作用是为了鉴别受体细胞中是否含有目的基因,从而将含有目的基因的细胞筛选出来。
3、将目的基因导入受体细胞将目的基因导入受体细胞是基因工程的关键步骤。
根据受体细胞的不同,导入的方法也有所不同。

第一章基因工程基因工程是狭义的遗传工程,遗传工程的核心是构建重组DNA分子。
基因工程也称为“重组DNA技术”。
第一节工具酶的发现和基因工程的诞生基因工程的理论基础:DNA是遗传物质,DNA的双螺旋结构,以及遗传信息的传递方式。
基因工程的技术保障:限制性核酸内切酶,DNA连接酶和质粒载体发现与应用。
一、限制性核酸内切酶:能够识别和切割DNA分子内一小段特殊核苷酸序列的酶。
(平末端和黏性末端)限制性核酸内切酶可作为切割DNA分子的手术刀,它的发现和应用,使DNA重组成为可能。
二、DNA连接酶:将具有末端碱基互补的2个DNA片段连接在一起,形成的DNA分子称为重组DNA分子。
DNA连接酶具有缝合DNA片段的作用。
三、质粒:能够自主复制的双链环状DNA分子,它们在细菌中以独立于大型DNA分子之外的方式存在,是一种特殊的遗传物质。
最常用的是大肠杆菌的质粒,其含有抗生素抗性基因。
标志基因工程诞生的试验:通过重组,使大肠杆菌同时具有四环素和卡那霉素的抗性。
四、基因工程的载体载体是运载外源DNA进入宿主细胞的车子,即运载工具。
除质粒外,基因工程载体还有入噬菌体、植物病毒和动物病毒。
入噬菌体:将外源基因载入大肠杆菌等宿主细胞。
植物病毒:将外源基因带入植物细胞。
动物病毒:将外源基因带入动物细胞。
第二节基因工程的原理和技术基因工程的基本原理是让人们感趣的基因(目的基因)在宿主细胞中稳定和高效表达。
基因工程的基本要素:工具酶、目的基因、载体和宿主细胞。
基因工程的基本操作步骤:A目的基因的获得;B重组DNA的形成;C重组DNA导入受体细胞(宿主细胞);D筛选含有目的基因的受体细胞;E目的基因的表达。
一、获得目的基因目的基因序列已知:化学合成方法合成目的基因,PCR扩增目的基因。
目的基因序列未知:构建基因文库。
二、形成重组DNA分子用相同的限制性核酸内切酶分别切割目的基因和载体,两者形成相同的黏性末端,然后用DNA连接酶将目的基因和载体连接在一起,形成重组DNA分子。
基因工程:诞生于20世纪70年代。
概念:实在分子水平上进行的操作,指将多种生物体(供体)的基因或基因组提取出来,或者人工合成基因,按照人们的愿望,严密的设计,经过体外加工重组,转移到另一种生物体(受体)细胞中,使之能在受体细胞遗传并获得新的遗传性状的技术。
三要素:供体受体载体。
基因工程的主要内容:1.目的基因的获取2.重组体的制备 3.重组体的转化4、克隆鉴定5、目的基因的表达限制性内切酶:是一种能够识别双链DNA分子中的某种特定核酸序列(4-8bp)并由此处切割双链的核酸内切酶。
1、来源:原核生物2、性质:在核酸分子链的内部制造切口3、功能:自身保护作用(R/M体系:保护自身的DNA不受限制,破坏外源的DNA使之迅速讲解)影响限制酶活性的主要因素:1、DNA的纯度2、DNA 的甲基化程度3、温度4、缓冲溶液5、DNA的分子结构Klenow片段:E.coli DNA聚合酶Ⅰ经胰蛋白酶或枯草杆菌蛋白酶部分水解生成的C末端605个氨基酸残基片段。
该片段保留了DNA聚合酶I的5ˊ-3ˊ聚合酶和3ˊ-5ˊ外切酶活性,但缺少完整酶的5ˊ-3ˊ外切酶活性。
功能:1、3ˊ断的补平;2、DNA 3ˊ末端标记;3、cDNA第二链的合成。
平齐末端DNA 的连接方法:1、同聚物加尾法2、衔接物法;3、接头连接发。
双酶切相对单酶切的优点:可保证插入外源片段的方向,防止载体自连,提高重组率。
星号活性:在非理想的条件下,内切酶切割与识别位点相似但不完全相同的序列,这一现象称星号活性。
部分酶切:指选用的核酸内切酶对其在DNA分子上的全部识别序列进行不完全的切割。
发生部分酶切的原因:底物DNA纯度低;识别序列甲基化;酶用量不足;反应缓冲液和温度不适宜。
碱性磷酸酶和S1磷酸酶的功能:碱性磷酸酶主要是脱磷酸作用,其产物具有5-OH末端,这种功能使它在DNA 分子克隆实验中发挥着重要作用,利用该酶可以有效防止粘性末端分子自连。
S1核酸酶:是一种高度单链特异的核酸内切酶,可降解单链DNA或RNA,不仅能催化RNA 和单链DNA分子降解成为5单核苷酸,而且它也能作用于双链核苷酸单链区。
高中基因工程总结的知识点
一、基因工程
1、什么是基因工程
基因工程是指将一种生物体的基因插入另一种生物体,从而改变另一种生物体的性状,利用它们来改造和改变生物物种的一种技术。
2、基因工程的意义
基因工程可以帮助人们改善现有的农作物品种,以便获得更高的产量;同时也能够生产药物,如胰岛素,以治疗糖尿病等疾病。
3、基因工程的基本步骤
(1)获取基因序列:科学家首先获取目标基因的结构特征,以
及基因的排列顺序;
(2)构建基因组:科学家将基因拆分为多个碱基对,构建基因组;
(3)转化:将基因注入受体生物体,使之获得新的基因;
(4)表达:把插入的基因转录成mRNA,再转录成蛋白质,从而在受体生物体内表达出新的基因。
二、遗传工程
1、什么是遗传工程
遗传工程是通过改变某一物种的基因组结构而获得意想不到的
新突变,并利用这些突变来改良物种的一种技术。
2、遗传工程的意义
遗传工程可以帮助人们改良农作物品种,提高农作物的生长效率;
同时也可以用于育种,改良家禽种类,以提高食品的品质。
3、遗传工程的基本步骤
(1)获取基因:科学家首先获取和研究目标物种中的基因;
(2)基因分离:将基因拆分为多个碱基对,构建基因组;
(3)基因转移:将基因转移到另一物种中,进行基因转换;
(4)效果评估:使用遗传分析和实验测试,评估遗传工程所产生的效果。
专题1基因工程1.1 DNA 重组技术的根本工具1.基因工程又叫 DNA 重组技术,是指依据人们的梦想,进行严格的设计,并经过体外 DNA 重组和转基因等技术,给予生物以新的遗传特征,从而创建出更切合人们需要的新的生物种类和生物产品。
操作水平是 DNA 分子水平,操作环境是在体外。
2.“分子手术刀〞──限制性核酸内切酶。
这种酶主假如从原核生物中分离纯化出来的。
迄今已从近 300 种微生物中分离出了约 4000 种限制酶。
能够辨别双链 DNA分子的某种特定核苷酸序列;切开两个两个核苷酸之间的磷酸二酯键,形成黏性尾端或平尾端。
3.“分子缝合针〞──DNA 连结酶。
将切下来的 DNA片段拼接成新的 DNA分子,恢复被限制酶切开的磷酸二酯键。
种类: 1〕E.coli DNA连结酶:只好将双链 DNA片段互补的粘性尾端之间连结起来 2〕T4 DNA连结酶:既能够“缝合〞双链 DNA片段互补的粘性尾端,又可以“缝合〞双链 DNA片段的平尾端,但连结平尾端之间的效率比较低4.“分子运输车〞──基因进入受体细胞的载体。
作为载体的必需条件:能自我复制、有切割位点、有遗传标志基因等。
载体的种类:细菌质粒、λ噬菌体的衍生物、动植物病毒1.2 基因工程的根本操作程序1.基因工程的根本操作步骤主要包含:目的基因的获得;基因表达载体的建立;将目的基因导入受体细胞;目的基因的检测与判定。
2. 目的基因的获得方法:从基因文库中获得、利用 PCR 提取目的基因、人工合成法。
是一项在生物体外复制特定 DNA 片段的核酸合成技术。
原理 DNA 双链复制。
条件:模板 DNA ;RNA 引物;四种脱氧核苷酸;热稳固 DNA 聚合酶〔 Taq 酶〕。
方法: DNA受热变性解旋为单链、冷却后 RNA引物与单链相应互补序列联合、DNA聚合酶作用下延长合成互补链。
4.基因表达载体的功能:使目的基因在受体细胞中稳固存在;能够遗传给下一代;使目的基因能够表达和发挥作用。
高中生物选修三《基因工程》知识点归纳1. 遗传工程:狭义:基因工程广义:把一种生物的遗传物质移到另一种生物的细胞中。
2. 基因工程的核心是构建重组DNA分子。
3. 基因工程诞生的理论基础:DNA是生物遗传物质的发现,DNA双螺旋结构的确立以及遗传信息传递方式的认定。
4. 实施基因工程的条件:工具酶(限制性内切酶、连接酶、聚合酶) 目的基因:基因载体:要求:①能自我复制。
②含限制性内切酶位点。
③含筛选标记(一般为抗性基因)。
④能启动外源目的基因的转录、翻译。
⑤在细菌中,质粒有较高的拷贝数与稳定性。
受体细胞:微生物、动植物细胞(用氯化钙处理大肠杆菌可增加其细胞壁通透性,方便重组质粒进入。
)5. 基因工程的工具:①限制性核算内切酶可作为切割DNA分子的手术刀,使DNA重组成为可能②DNA连接酶具有缝合DNA的作用,可以将外源基因和载体DNA连接在一起。
③载体:最常见的载体为大肠杆菌质粒,质粒常含抗生素抗性基因。
(质粒是能自主复制的双链环状DNA,在细菌中独立于染色体存在的特殊遗传物质)。
除常用细菌和酵母的质粒外,改造和修饰后的噬菌体和病毒DNA均可作为基因载体。
向双子叶植物导入基因时,常用土壤农杆菌的Ti质粒。
6. 基因工程的基本操作步骤:目的基因的获得、重组DNA的形成、重组DNA 导入受体细胞、筛选含有目的基因的受体细胞、目的基因的表达。
7. 获得目的基因的方法:若化学序列已知,则可用化学方法合成目的基因或用PCR扩增目的基因。
若序列未知,则应建立包含目的基因的基因文库后,从中寻找。
8. 转基因植物解决了传统育种中远缘亲本难以杂交的缺陷,并可以定向的改变植物的性状。
9. 基因工程在医药工业和医学领域的应用主要包括基因工程药物和基因治疗。
10. 基因工程药物有胰岛素,干扰素(病毒入侵细胞后产生的糖蛋白,有抗病毒,抗细胞分裂和免疫调节等多种生物学功能,是治疗病毒性肝炎和肿瘤的药物),乙型肝炎疫苗等。
11. 基因治疗是向目标细胞中引入正常功能的基因,以纠正或补偿基因的缺陷,达到治疗的目的。
质粒名称和大小、复制启动子、多克隆酶切位点MCS、选择标记基因16°C连接,37°C酶切凝胶电泳pH8.0带负电1.基因工程:又称遗传工程,是通指重组DNA技术的产业化设计和应用的流程。
强调基因克隆、载体构建、遗传转化、性状表达与产品提取及纯化等全部过程。
2.基因操作技术:利用遗传重组技术,在体外通过人工“剪切”和“拼接”等方法,将包含目的基因、特殊载体在内的各种必需元件的DNA分子经过改造和重组后,转入另一受体生物细胞内。
3.基因:DNA分子中含有特定遗传信息的一段核苷酸序列。
4.核酸:由许多核苷酸单位通过3,5-磷酸二酯键连接起来形成的不含侧链的具有方向性的长链状化合物。
5.顺反子(基因同义词):在反式构型中不能互补的各个突变型在染色体上所占的一个区域称为一个顺反子。
是一个必须保存完整才具有正常生理功能的遗传物质最小单位。
6.突变子(muton):突变单位,基因内部有许多突变位点,突变后产生变异的最小单位。
(最小的突变单位为1个碱基对bp)7.重组子(recon):重组单位,基因内部有多个重组单位,不能由重组分开的最小单位。
一个基因不是一个突变单位,也不是一个重组单位。
8.断裂基因(split gene):指基因内部被一个或更多不翻译的编码顺序即内含子所隔裂。
基因都可划分为转录区(转录起始点至转录终止子的区域)和调控区(位于转录起始点5’上游,包括核心启动子、上游启动元件及增强子等序列)结构基因并非都是连续的,原核生物基因是连续的,而真核生物的基因是断裂的9.内含子(intron):在成熟mRNA的片段中未反应出的DNA区段;10.外显子(extron/exon): DNA序列中被转录成为mRNA中的片段。
基因中能变成核苷酸序列的是外显子,内含子不能。
11.核小体(nucleosome):在真核生物中,双螺旋的DNA分子围绕一蛋白质八聚体进行盘绕,从而形成特殊的串珠状结构。
1.基因工程的概念(1)供体:提供目的基因。
(2)操作环境:体外。
(3)操作水平:分子水平。
(4)原理:基因重组。
(5)受体:表达目的基因。
(6)本质:性状在受体体内的表达。
(7)优点:克服远缘杂交不亲和的障碍,定向改造生物的遗传性状。
2.基础理论和技术的发展催生了基因工程(1)20世纪中叶,基础理论取得了重大突破①DNA是遗传物质的证明:1944年,艾弗里等人通过不同类型肺炎双球菌的转化实验,不仅证明了生物的遗传物质是DNA,还证明了DNA可以从一种生物个体转移到另一种生物个体。
艾弗里等人的工作可以说是基因工程的先导。
②DNA双螺旋结构和中心法则的确立:1953年,沃森和克里克建立了DNA双螺旋结构模型。
1958年,梅塞尔松和斯塔尔用实验证明DNA的半保留复制。
随后不久确立的中心法则,解开了DNA复制、转录和翻译过程之谜,阐明了遗传信息流动的方向。
③遗传密码的破译:1963年,尼伦伯格和马太破译编码氨基酸的遗传密码。
1966年,霍拉纳用实验证实了尼伦伯格提出的遗传密码的存在。
这些成果不仅使人们认识到,自然界中从微生物到人类共用一套遗传密码,而且为基因的分离和合成等提供了理论依据。
(2)技术发明使基因工程的实施成为可能①基因转移载体的发现:1967年,罗思和赫林斯基发现细菌拟核DNA之外的质粒有自我复制能力,并可以在细菌细胞间转移,这一发现为基因转移找到了一种运载工具。
②工具酶的发现:1970年,阿尔伯、内森斯、史密斯在细菌中发现了第一个限制性内切酶(简称限制酶)后,20世纪70年代初相继发现了多种限制酶和连接酶,以及逆转录酶,这些发现为DNA的切割、连接以及功能基因的获得创造了条件。
③DNA合成和测序技术的发明:自1965年,桑格发明氨基酸序列分析技术后,1977年,科学家又发明了DNA序列分析的方法,为基因序列图的绘制提供了可能,之后,DNA 合成仪的问世又为引物、探针和小分子量DNA基因的获得提供了方便。
基因工程各章知识点第一章绪论1.基因工程的首例操作实验三大理论基础:DNA是遗传物质、DNA的双螺旋结构和半保留复制、遗传密码的破译和遗传物质传递方式的确定三大技术基础:限制性核酸内切酶的发现与DNA的切割、DNA连接酶的发现与DNA片段的连接、基因工程载体的研究与应用基因工程的诞生:72年,P.Berg首次实现体外DNA重组:体外用EcoRI分别切割SV40和λDNA,并用T4 DNA连接酶连接成为重组的杂种DNA分子73年,S.Cohen 体外重组DNA并转化:具Kanr的E.Coli质粒R6-5和具Tetr的E.Coli质粒pSC101切割并连接转化的大肠杆菌具有双重抗性S.Cohen 和H.Boyer首次实现真核基因在原核中表达:将非洲爪蟾的DNA与E.Coli质粒(pSC101)体外切割并连接,转化大肠杆菌2.基因工程的基本概念基因工程是指将一种生物体(供体)的基因与载体在体外进行拼接重组,然后转入另一种新物体(受体)内,使之稳定遗传并表达出新产物或具有新性状的DNA体外操作技术,也称为分子克隆或重组DNA 技术。
供体、载体、受体是基因工程的三大基本元件。
3.基因工程的基本操作过程a分离目的DNA片段:酶切、PCR扩增、化学合成等。
b重组:体外连接的DNA和载体DNA,形成重组DNA分子。
c转化:将重组DNA分子导入受体细胞并与之一起增殖。
d筛选:鉴定出获得了重组DNA分子的受体细胞。
e对获得外源基因的细胞或生物体通过培养,获得所需的遗传性状或表达出所需要的产物。
第二章载体1.理解用PBR322和PUC18作载体的克隆外源基因的原理。
答案不确定PBR322作载体的克隆外源基因的原理:PBR322质粒具有12 种限制性内切酶的单一识别位点:Tet r 基因内有7个酶切位点:Bam HⅠ,SalⅠ:Amp r基因内有3 个酶切位点:PstⅠ。
Eco RⅠ和HindⅢ不在抗生素基因内,不导致插入失活。
如果在pBR322质粒的Tet r基因内位点插入外源DNA片断,将切断了tet r基因编码序列的连续性,使tet r 失去活性,产生出Amp r Tet s表型的重组pBR322质粒,转化入Amp s Tet s的大肠杆菌细胞。
先涂布在含氨苄青霉素的选择培养基上,筛选出具Amp r菌落,再将它们影印于含四环素的选择性培养基上。
插入外源片断的重组质粒不能在这种培养基上生长,这样就找出了含重组质粒的大肠杆菌。
如果在pBR322质粒的Amp r基因内位点插入外源DNA片断,则反之。
PUC18作载体的克隆外源基因的原理:在pBR322的基础上,在其5’-端带有一段多克隆位点的lacZ’基因,而发展的具有双功能检测特性的新型质粒载体系列。
典型的pUC系列的质粒载体包括如下4个组成部分:a、pBR322的复制起始点。
b、氨苄青霉素抗性基因但它的DNA核苷酸序列已经发生了变化,不再含有原来的核酸内切限制酶的识别位点。
c、大肠杆菌β-半乳糖苷酶基因(lacZ)的启动子及编码α-肽链的DNA序列,此结构称之为lacZ’基因。
d、位于lacZ’基因中的靠近5’-端的一段多克隆位点(MCS)区段。
但它并不破坏该基因的功能。
2.理想载体的必备条件(1)、较小的分子量和较高的拷贝数。
(2)、应最大限度的具有各种常用限制性内切酶的单一酶切位点。
(3)、具两种以上的选择标记基因。
(4)、重组质粒较易导入宿主细胞并复制和表达。
3.穿梭载体和a-互补A 穿梭质粒载体是指一类由人工构建的具有两种不同复制起点和选择标记,因而可在两种不同的宿主细胞中存活和复制的质粒载体。
常见的穿梭质粒有大肠杆菌-土壤农杆菌穿梭质粒载体、大肠杆菌-枯草芽孢杆菌穿梭质粒载体、大肠杆菌-酿酒酵母穿梭质粒载体。
B lacZ基因的突变体M15质粒(缺失氨基酸残基11到41)是没有野生型lacZ基因产物那种分解X-gal 能力的。
但如果在M15突变体的抽取物中加入β-半乳糖苷酶的第3至第92氨基酸残基的肽段(α肽)则能恢复M15分解X-gal,而显示蓝色的能力。
这样一种基因内互补现象称做α互补。
第三章核酸操作的基本技术1.碱解法提取质粒DNA的原理?提取DNA时常用试剂的作用原理碱裂解法是基于DNA的变性与复性差异而达到分离目的的。
碱性使质粒DNA变性,再将pH值调至中性使其复性,复性的为质粒DNA,而染色体DNA不会复性,缠结成网状物质,通过离心除去。
碱裂解法是一种应用最为广泛的制备质粒DNA的方法,碱变性抽提质粒DNA是基于染色体DNA与质粒DNA的变性与复性的差异而达到分离目的。
在pH值高达12.6的碱性条件下,染色体DNA的氢键断裂,双螺旋结构解开而变性。
质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链不会完全分离,当以pH4.8的NaAc/KAc高盐缓冲液去调节其pH值至中性时,变性的质粒DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。
常用试剂的作用溶菌酶:溶解菌体细胞壁的β-1,4糖苷键,即具溶菌作用。
葡萄糖:增加溶液粘度,防止DNA受机械切力作用而降解EDTA:金属离子螯合剂,抑制脱氧核糖核酸酶(Dnase)对DNA的降解作用SDS:阴离子表面活性剂,①可破坏细胞膜,使DNA释放出来,②结合蛋白质,使蛋白质沉淀下来③抑制脱氧核糖核酸酶(RNase)的活性。
酚、氯仿:蛋白质变性剂。
使蛋白质失水变性,;离心后与水相(含DNA)分离。
异戊醇:降低分子表面张力,可减少气泡的产生;有助于分相。
无水乙醇:DNA的沉淀剂。
夺取DNA周围的水分,使DNA失水而易于聚合。
NaOH:核酸在pH=5~9的溶液中稳定,pH>12或pH<3时会引起氢键断裂。
KAc:KAc-HAc,pH=4.8缓冲液,变性的质粒DNA在此溶液中发生复性。
2.RNA分离的关键因素。
(RNA酶是一种蛋白质,所以提取时利用氯仿抽提可以很好去除,得到高质量的RNA。
)RNA分离的关键因素是尽量减少RNA酶(RNase)的污染,因此在RNA制备过程中,必须注意控制RNase 酶的活性,并设法抑制其活性。
造成RNase酶污染源有:所用的器皿、所用的溶液、实验人员的手及飞沫。
玻璃器皿:烘箱中(180 ℃)烘烤8h以上。
塑料器皿:0.1%DEPC(diethylpyrocarbonate,二乙基焦碳酸盐)浸泡或用氯仿洗涤。
配置的溶液应尽可能用0.1% DEPC在37℃处理12h以上,然后高压灭菌。
全部实验过程均需戴手套操作, 并经常更换。
RNA电泳槽常用去污剂洗涤,0.1%DEPC处理。
提取中出现RNA降解原因:操作过程中温度太高、操作时有RNA酶的污染或RNase抑制剂量不足等都有可能使RNA降解。
解决方法:做好使用器皿的RNase去除工作;在整个操作过程中最好在低温(4℃)或是冰上进行;操作者自始至终戴手套。
3.电泳法和紫外分光光度法都能检测DNA的浓度和纯度,哪种方法更好。
A、紫外光度法原理:核酸中含有嘌呤和嘧啶环,在256~265nm处显示出特征吸收峰,在230 nm 处吸收最小。
DNA或RNA分子在260 nm处有特异吸收峰,吸收强度与系统中DNA或RNA的浓度成正比。
方法:首先用TE或ddH2O稀释待测DNA样品;用TE或ddH2O为空白对照,在260 nm及280 nm处调节紫外分光光度计读数为0;加入DNA稀释液与上述两波长处读取OD 值;A260值为1时相当于50ug/mL 的dsDNA,40ug/mL的ssDNA或RNA;通过计算公式计算浓度及纯度。
双链DNA(ds DNA)浓度(μg /ml)=50×OD260×稀释倍数单链DNA 或RNA (ssDNA ssRNA )浓度(μg /ml)=40×OD260×稀释倍数DNA 纯度可通过OD260/ OD280来衡量:纯的DNA的OD260/OD280为1.8~2.0;OD260/ OD280>2.0为RNA污染,<1.8为蛋白质污染;OD260/OD280<0.9时适当稀释样品,可再进行一次抽提;OD260/OD280>2时则RNA过高,要除去RNA。
B、水平式琼脂糖凝胶电泳法检测DNA在生理条件下,核酸分子是多聚阴离子当核酸分子被放置在电场当中时,它们就会向正电极的方向迁移。
在一定的电场强度下,DNA分子的电泳迁移率,取决于核酸分子本身的大小和构型。
原理:在琼脂糖凝胶中加入EB,当与DNA混合时EB可插入到DNA分子中形成荧光络合物。
而EB在紫外光照射下能发射荧光,荧光的强度与DNA的含量成正比。
便可十分敏感而方便地检测出凝胶介质中DNA的存在、强度和谱带的位置。
在适当的染色条件下,荧光的强度同DNA数量成正比,据此,人们可以估计DNA的浓度。
不同大小的DNA片段在凝胶中的迁移速度不同,据此,科研工作者们便能判断DNA 的分子质量,其有无降解;同时,通过同已知分子质量的标准DNA片段之间的比较,还可测定出随迁移的DNA片段的分子质量。
4.为什么核酸保存在TE溶液(Tris-HCl 和EDTA)中比较稳定在基因操作实验中,选择缓冲液的主要原则是考虑DNA的稳定性及缓冲液成分不产生干扰作用。
磷酸盐缓冲系统(pKa=7.2)和硼酸系统(pKa=9.24)等虽然也都符合细胞内环境的生理范围,可作DNA的保存液,但在转化实验时,磷酸根离子的种类及数量将与Ca2+产生Ca3(PO4)2沉淀;在DNA反应时,不同的酶对辅助因子的种类及数量要求不同,有的要求高离子浓度,有的则要求低盐浓度,采用Tris-Hcl(pKa=8.0)的缓冲系统,由于缓冲液是TrisH /Tris,不存在金属离子的干扰作用,故在提取或保存DNA时,大都采用Tris-HCL系统,而TE缓冲液中的EDTA更能稳定DNA的活性。
第四章限制性内切酶1.寄主的限制与修饰的作用R/M中的限制作用(restriction)是指一定类型的细菌可以通过限制酶的作用,破坏入侵的噬菌体DNA(外源DNA)导致噬菌体寄主幅度受到限制的现象。
限制酶来完成R/M中的修饰作用(modification)是指寄主本身的DNA由于合成后通过甲基化作用得以甲基化,使DNA获得修饰,从而避免遭自身限制酶的破坏。
寄主的限制与修饰有两个方面的作用:保护自身的DNA不受限制;破坏外源DNA使之迅速降解。
细菌正是利用限制与修饰系统来区分自身DNA与外源DNA的。
3.同裂酶同尾酶完全消化不完全消化星号活性同裂酶(isoschizomers):来自不同有机体,识别切割相同序列的一组酶。