元素周期律
学习目标
了解元素原子核外电子排布、元素最高化合价 和最低化合价、原子半径、元素的金属性、非金属 性等随元素核电荷数递增而呈周期性变化的规律。
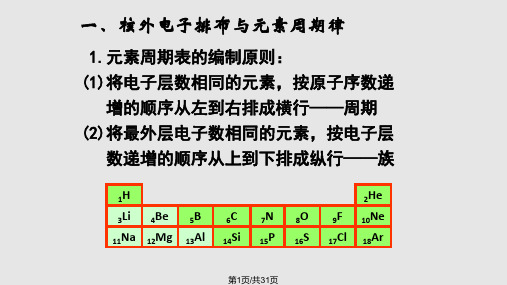
元素周期律
观察1~18的元素的原子结构示意图,原子核外电子排布有何规律? 1、核外电子排布的周期性
(1) 同行自左到右,电子层数不变,最外层电子数(由1→8周期性)增加; (2) 同列自上而下,最外层电子数不变,电子层数增加。
元素周期律
(1) 元素金属性变化规律的探究
Na
Mg
Al
与水 冷水,剧烈红色 沸水,迅速浅红色 沸水,缓慢难变红
与酸
剧烈,发烫
迅速,发烫
碱性 金属性
NaOH强碱 强
Mg(OH)2中强碱
Al(OH)3弱碱 弱
元素周期律
(2) 元素非金属性变化规律的探究
Si
单质与H2的反应
高温
气态氢化物的热 稳定性
不稳定(自燃)
最高价氧化物 对应水化物
H3PO4 NaOH Mg(OH)2 Al(OH)3 H2SiO3 HPO3
H2SO4
HClO4
元素周期律
原子序数 元素符号
主要化合价
11
12
13
Na Mg
Al
+1 +2 +3
14
15
16
17
Si
P
S
Cl
+4 +5 +6 +7 ‒4 ‒ 3 ‒ 2 ‒ 1
最高价氧化物
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
元素周期律
观察1~18的元素的原子半径变化,能发现什么规律?