化工原理 第五章 气体吸收
- 格式:ppt
- 大小:3.60 MB
- 文档页数:119

化工原理之气体吸收气体吸收是化工过程中常用的一种物理操作,它指的是将气体从气相吸收到液相中。
气体吸收广泛应用于环境工程、化工工艺、能源工程等领域,例如废气处理、石油炼制、烟气脱硫等。
一、气体吸收的基本原理气体吸收的基本原理是气体和液体之间的质量传递过程。
气体吸收的过程中,气体溶质分子通过气相和液相之间的传质界面传递到溶液中,从而实现气体从气相到液相的转移。
气体吸收的速度由以下几个因素决定:1.液相溶剂的性质:液相溶剂的挥发性、表面张力、黏度和溶解度等性质都会影响气体吸收的速度。
通常情况下,挥发性较强的溶剂对气体的吸收速率较快。
2.溶剂和气体溶质之间的亲和力:溶剂和气体溶质之间的亲和力越强,气体吸收速度越快。
3.传质界面的面积和传质界面的厚度:传质界面的面积越大,气体吸收速度越快;传质界面的厚度越薄,气体吸收速度越快。
4.溶解度:气体的溶解度越高,气体吸收速度越快。
5.气体浓度梯度:气体浓度梯度越大,气体吸收速度越快。
二、气体吸收的设备常见的气体吸收设备包括吸收塔、吸收柱和吸附塔等。
1.吸收塔:吸收塔是最常用的气体吸收设备之一,它主要由一个塔体和填料层组成。
气体通过底部进入吸收塔,液体从塔顶滴入塔体中。
在填料层的作用下,气体和液体之间的接触面积增加,从而促进气体的传质。
通过提供充分的接触时间和表面积,吸收塔可以实现高效的气体吸收。
2.吸收柱:吸收柱通常用于含有反应过程的气体吸收。
与吸收塔类似,吸收柱也包含一个塔体和填料层。
区别在于,吸收柱还包括一个液相反应器,用于在吸收气体的同时进行反应。
3.吸附塔:吸附塔是另一种常用的气体吸收设备,主要用于吸附分离等工艺中。
吸附过程通过吸附剂将目标气体吸附在其表面上实现。
吸附塔通常由多个吸附层和吸附剂床组成,气体从底部进入吸附塔,经过吸附剂床后,被吸附物质从气相转移到固相中,从而实现气体吸附。
三、气体吸收的应用气体吸收在化工工艺中有着广泛的应用。
1.废气处理:气体吸收是一种有效的废气处理方法,可用于去除废气中的有害污染物,如二氧化硫、氮氧化物等。



第五章 吸收 相组成的换算【5-1】 空气和2的混合气体中,2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解3, 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982skg m ρ=代替。
溶液中3的量为 /311017n kmol -=⨯溶液的体积 /.33101109982 V m -=⨯溶液中3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ 3与水的摩尔比的计算//1170010610018X ==. 或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,3的体积分数为10%,吸收率为90%,求离开吸收器时3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为122111Y Y Y Y Y η-===-被吸收的溶质量原料气中溶质量解 原料气中3的摩尔分数0.1y = 摩尔比 (11)10101111101y Yy ===-- 吸收器出口混合气中3的摩尔比为 () (2)11109011100111Y Y η=-=-⨯=()摩尔分数 (22)200111=0010981100111Y yY ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3NH ,查得20℃时溶液上方3NH 的平衡分压为798。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。

第五章气体吸收第一节概述§5.1.1概述一、传质过程从本章起,讨论化工生产中的传质过程及其典型设备。
传质过程是指物质通过相界面从一相迁移至另一相的过程,以下图示意:>,则A物质就会从相迁移至相。
迁移的结果使得相的A、B据热力学知识,两物质得以一定程度或完全分离,而相形成了A、B两物质的混合物。
因此相内进行的是A、B的分离过程,相内进行的是A、C的混合过程。
研究传质过程就是研究物质通过相界面的迁移过程的基本规律以及主要受这些基本规律支配的若干单元操作。
混合物系的分离对我们来说并不陌生,在上册中我们已经学习掌握了非均相物系的分离方法,相应单元操作如沉降、过滤等,从这一章起要来讨论均相物系的分离。
用下表来比较说明非均相、均相物系的分离情况:本学期的任务就是要掌握气体、液体蒸馏、液液萃取和固体干燥这四个单元操作的基本原理及其典型设备的设计。
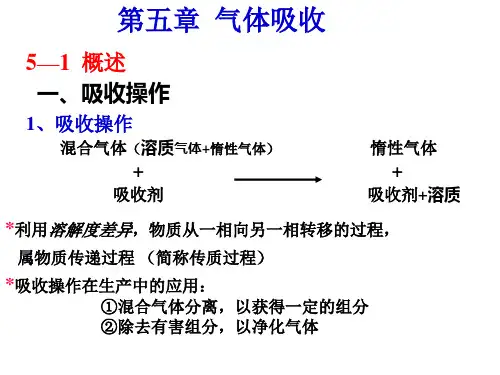
二、气体吸收吸收操作是分离气体混合物的方法之一。
吸收操作的分离依据是混合物各组分在某种溶剂(吸收剂)中溶解度的差异,从而达到的目的。
例如:将含的空气通入水中,因、空气在水中溶解度差异很大,NH3很容易溶解于水中,形成氨水溶液,而空气几乎不溶于水中。
所以用水吸收混合气体中的能使、空气加以分离,并回收。
一般地,混合气体中能溶解的组份称为溶质或吸收质,用A表示();混合气体中不能溶解的组份称为惰性成分或载体,用B表示(空气);吸收操作中所用的溶剂称为吸收剂或溶剂,用S表示(水);吸收操作中所得的溶液称为吸收液,用S+A表示;吸收操作中排除的气体称为吸收尾气,用(A)+B表示;吸收的目的有三个:1.分离混合气体以获得一定的组分。
(例子:硫酸吸收焦炉气中的,洗油吸收焦炉气中的苯、甲苯蒸汽。
)2.除去有害组分以净化气体。
(例子:用水或钾碱液吸收合成氨原料气中的二氧化碳。
)3.制备某种气体的溶液。
(例子:用水吸收氯化氢、三氧化硫、二氧化氮制得酸。
)实际过程往往同时兼有净化和回收双重目的。


化⼯原理第五章吸收题说课讲解化⼯原理第五章吸收题六吸收浓度换算2.1甲醇15%(质量)的⽔溶液, 其密度为970Kg/m3, 试计算该溶液中甲醇的:(1)摩尔分率; (2)摩尔⽐; (3)质量⽐; (4)质量浓度; (5)摩尔浓度。
分⼦扩散2.2 估算1atm及293K下氯化氢⽓体(HCl)在(1)空⽓,(2)⽔(极稀盐酸)中的扩散系数。
2.3⼀⼩管充以丙酮,液⾯距管⼝1.1cm,20℃空⽓以⼀定速度吹过管⼝,经5 ⼩时后液⾯下降到离管⼝2.05cm,⼤⽓压为750[mmHg],丙酮的蒸汽压为180[mmHg] , 丙酮液密度为7900[kg/m3],计算丙酮蒸汽在空⽓中的扩散系数。
2.4 浅盘内盛⽔。
⽔深5mm,在1atm⼜298K下靠分⼦扩散逐渐蒸发到⼤⽓中。
假定传质阻⼒相当于3mm厚的静⽌⽓层,⽓层外的⽔蒸压可忽略,求蒸发完所需的时间。
2.5 ⼀填料塔在常压和295K下操作,⽤⽔除去含氨混合⽓体中的氨。
在塔内某处,氨在⽓相中的组成y a=5%(摩尔百分率)。
液相氨的平衡分压P=660Pa,物质通量N A= 10 - 4[kmol/m2·S],⽓相扩散系数D G=0.24[cm2/s],求⽓膜的当量厚度。
相平衡与亨利定律2.6 温度为10℃的常压空⽓与⽔接触,氧在空⽓中的体积百分率为21%,求达到平衡时氧在⽔中的最⼤浓度, (以[g/m3]、摩尔分率表⽰)及溶解度系数。
以[g/m3·atm]及[kmol/m3·Pa]表⽰。
2.7 当系统服从亨利定律时,对同⼀温度和液相浓度,如果总压增⼤⼀倍则与之平衡的⽓相浓度(或分压) (A)Y增⼤⼀倍; (B)P增⼤⼀倍;(C)Y减⼩⼀倍; (D)P减⼩⼀倍。
2.8 25℃及1atm下,含CO220%,空⽓80%(体积%)的⽓体1m3,与1m3的清⽔在容积2m3的密闭容器中接触进⾏传质,试问⽓液达到平衡后,(1)CO2在⽔中的最终浓度及剩余⽓体的总压为多少?(2)刚开始接触时的总传质推动⼒ΔP,Δx各为多少?⽓液达到平衡时的总传质推动⼒⼜为多少?仅供学习与交流,如有侵权请联系⽹站删除谢谢1362.9 在填料塔中⽤清⽔吸收⽓体中所含的丙酮蒸⽓,操作温度20℃,压⼒1atm。

第五章:吸收 概述气液相平衡吸收过程的传质速率吸收塔的计算填料塔第一节:概述一、吸收吸收的定义:吸收是利用气态均相混合物中各组分在吸收剂中溶解度的差异来实现分离的单元操作。
吸收的目的:I.回收或捕获气体混合物中的有用物质,以制取产品II.除去工艺气体中的有害成分,使气体净化,以便进一步加工处理III.除去工业放空尾气中的有害气体,以免环境污染。
二、工业吸收了解工业生产中吸收及解吸过程、所需条件和典型设备例子工业上从合成氨原料混合气体中回收CO2乙醇胺脱硫法•需要解决的问题1.选择合适的溶剂2.提供适当的传质设备3.溶剂的再生三、溶剂的选择1.对溶质较大的溶解度;2.良好的选择性;3.温度变化的敏感性;4.蒸汽压要低;5.良好的化学稳定性;6.较低的黏度且不易生泡;7.廉价、无毒、易得、不易燃烧等经济和安全条件。
四、吸收的分类按有无化学反应:物理吸收和化学吸收按溶质气体的浓度:低浓度和高浓度吸收按溶质气体组分的数目:单组分和多组分吸收按有无热效应:等温和非等温吸收本章只讨论低浓度、单组分、等温的物理吸收过程。
五、吸收操作的经济性(费用)气液两相流经设备的能量损耗;溶剂的挥发及变质损失;溶剂的再生费用。
√六、吸收设备第二节:气液相平衡一、平衡溶解度恒温、恒压下,相互接触的气液两相的浓度不变时,气液两相之间的浓度关系。
气液两相组成的浓度分别用物质的摩尔分数来表示,即y= n i /Σn y 、x= n i /Σn x:气液两相中惰性组分的量不变,溶质与惰性组分摩尔比。
yy Y −=1xx X −=11.气体的溶解度气体在溶液中的溶解平衡是一个动态平衡,该平衡的存在是有条件的;平衡时气相中溶质的分压——平衡分压(或饱和分压),液相中溶质的浓度——平衡浓度(或饱和浓度),也即是气体在溶液中的溶解度;气体的溶解度是一定条件下吸收进行的极限程度;温度和压力对吸收操作有重要的影响;加压和降温对吸收有利;升温和降压对解吸有利。


第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n k m ol -=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算 或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为解 原料气中NH 3的摩尔分数0.1y = 摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为 摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
总压为100kPa 。
解 液相中3NH 的摩尔分数/.//1170010511710018x ==+气相中3NH 的平衡分压 *.0798 P k P a = 亨利系数 *./.0798*******E p x ===/ 液相中3NH 的浓度 /./.333110170581 101109982n c kmol m V --⨯===⨯/ 溶解度系数 /*./../(3058107980728H c p k m o l m kP a ===⋅液相中3NH 的摩尔分数 //1170010511710018x ==+./气相的平衡摩尔分数 **.0798100y p p ==// 相平衡常数 * (079807610000105)y m x ===⨯ 或 //.76100076m E p === 【5-5】空气中氧的体积分数为21%,试求总压为.101325kPa ,温度为10℃时,31m 水中最大可能溶解多少克氧?已知10℃时氧在水中的溶解度表达式为*.6331310p x =⨯,式中*p 为氧在气相中的平衡分压,单位为kPa x ;为溶液中氧的摩尔分数。
《化工原理》第五章“吸收”复习题一、填空题1。
质量传递包括有___________________等过程。
***答案***吸收、蒸馏、萃取、吸附、干燥。
2. 吸收是指_______的过程,解吸是指_____的过程。
***答案***用液体吸收剂吸收气体,液相中的吸收质向气相扩散.3. 对接近常压的低浓度溶质的气液平衡系统,当总压增加时,亨利系数E____,相平衡常数m____,溶解度系数H____。
***答案*** 不变; 减少; 不变4. 指出下列组分,哪个是吸收质,哪个是吸收剂。
(1) 用水吸收HCl生产盐酸,H2O是____,HCl是_____.(2)用98。
3%H2SO4吸收SO3生产H2SO4,SO3,是___;H2SO4是___。
(3)用水吸收甲醛生产福尔马林,H2O是____;甲醛是___。
***答案***(1)吸收剂,吸收质。
(2)吸收质,吸收剂.(3)吸收剂,吸收质。
5. 吸收一般按有无化学反应分为_____,其吸收方法分为_______。
***答案***物理吸收和化学吸收;喷淋吸收、鼓泡吸收、膜式吸收。
6。
传质的基本方式有:__________和_________.***答案*** 分子扩散,涡流扩散。
7。
吸收速度取决于_______,因此,要提高气-液两流体相对运动速率,可以____来增大吸收速率。
**答案***双膜的扩散速率,减少气膜、液膜厚度。
8。
由于吸收过程气相中的溶质分压总____液相中溶质的平衡分压,所以吸收操作线总是在平衡线的____。
增加吸收剂用量,操作线的斜率____,则操作线向____平衡线的方向偏移,吸收过程推动力(y-y*)____。
***答案***大于上方增大远离增大9。
在气体流量,气相进出口组成和液相进口组成不变时,若减少吸收剂用量,则传质推动力将____,操作线将___平衡线。
***答案*** 减少; 靠近;10。
对一定操作条件下的填料吸收塔,如将塔料层增高一些,则塔的H OG将_____,N OG将_____(增加,减少,不变)。
第五章 气体吸收气体吸收操作的主要目的是分离气体混合物的组分。
气体吸收是气体溶解于液体的过程。
解吸操作中溶质气体的转移方向是自液相至气相。
吸收↔解吸对一定的气、液体系,温度升高,气体溶解度减小。
↓↑t p 有利于吸收↑↓t p 有利于解吸五、溶剂的选择p229吸收操作对吸收剂的要求是对欲吸收的溶质气体的溶解度大,选择性好,溶解度随温度改变的变化大,挥发度小,无毒,价廉易得。
5.2气液相平衡亨利定律稀溶液p *=Exp *=c/Hy *=mxm=E/P如总压1atm (绝压),20℃的空气与水长期接触,则水中O 2的摩尔分数x=5.24×10-6,E=4.01×104atm ,空气中O 2的摩尔分数y= 0.21如含有79%(体积)N 2的空气与水接触,温度为25℃,总压为100kP a ,查得亨利系数E =8.76×105kP a ,则液相中N 2的平衡浓度C *=5.01×10-4 kmol/m 3。
5.2.2 相平衡与吸收过程的关系(y -y *)以气相浓度差表示的吸收推动力;若相平衡常数为m ,塔内某截面的气液相含易溶组分的摩尔分数为y 及x ,当以y-y*表示总推动力,y*= mx 。
(x *-x )以液相浓度差表示的吸收推动力。
对塔内任一气液浓度分别为y,x 的截面,相际传质推动力为(x*-x),x*=y/m5.3 分子扩散费克定律T 、P 一定的一维定态:dZdC D J A AB A -= 对于二元物系,设A 为溶质气体,B 为惰气,二者摩尔浓度之和为常量,C A +C B =恒值,则分子扩散系数D AB 与D BA 的关系是D AB =D BA ,由费克定律算出A 与B 的分子扩散速率J A 与J B 。
二者关系是A J = BJ 。
非电解质稀溶液,液相分子扩散系数DAB 与绝对温度的1次方成正比对非电解质稀溶液,液相分子扩散系数D 与黏度μ的1次方成反比。
化工原理气体吸收气体吸收是化学工程中一种常用的分离和纯化技术,用于从气体混合物中去除其中一种特定成分。
它广泛应用于石油、化工、环保等领域。
本文将介绍气体吸收的原理、装置和操作条件等方面的内容。
气体吸收的原理是利用溶剂与气体中的组分之间的化学或物理作用力,使目标组分从气相转移到液相中。
根据吸收剂的性质和反应过程的特点,气体吸收可分为物理吸收和化学吸收两种方式。
物理吸收是指目标组分在吸收剂中主要通过物理作用力,如分子间的范德华力、表面张力等,从气相吸附到液相中。
在物理吸收过程中,吸收剂的选择非常关键,常用的吸收剂包括水、有机溶剂(如乙醇、丙酮等)和离子液体等。
化学吸收是指目标组分在吸收剂中通过与吸收剂发生化学反应,形成溶解物而从气相吸附到液相中。
化学吸收通常需要在一定的温度、压力和pH值条件下进行。
化学吸收常用的吸收剂包括氨水、碱性溶液(如氢氧化钠溶液、氯化钠溶液等)和有机酸等。
气体吸收的装置主要由吸收器、进料装置、排气装置和再生装置等组成。
吸收器一般为塔状或柱状,内部设置填料或栅板,以增加气液接触的表面积,提高吸收效果。
进料装置用于将待吸收的气体引入吸收器,通常采用喷射装置或静态混合器。
排气装置用于将除去目标组分的废气排放到大气中。
再生装置用于将吸收剂中的目标组分进行回收或处理。
操作条件对气体吸收的效果有重要影响。
温度是其中的一个关键参数,一般情况下,吸收效果随着温度的升高而降低。
温度控制有利于提高吸收剂中目标组分的溶解度。
另外,压力、气体和液体的流动速度、吸收剂浓度和比表面积等,也会对气体吸收过程产生影响。
气体吸收在化工工艺中有着广泛的应用。
例如,气体吸收可用于去除工业废气中的有机物、硫化物、酸性气体等污染物。
此外,在炼油、气体处理和化学合成等过程中,气体吸收还常用于分离和提纯有机化合物、气体燃料的净化和升级等。
综上所述,气体吸收作为一种常见的分离和纯化技术,通过吸收剂与目标组分之间的化学或物理作用力,将气体中的特定成分从气相吸附到液相中。
一、实验名称气体吸收实验二、实验目的(1)观察气、液在填料塔内的操作状态,掌握吸收操作方法。
(2)测定在不同喷淋量下,气体通过填料层的压降与气速的关系曲线。
(3)测定在填料塔内用水吸收CO2的液相体积传质系数X K α。
(4) 对不同填料的填料塔进行性能测试比较。
三、实验原理液体吸收是运用混合气体中各组分在同一溶剂的溶解度差异,通过气液充分接触,溶解度较大的气体组分较多地进入液相而与其他组分分离的操作。
填料塔的流体力学特性是吸收设备的重要参数,可计算填料塔所需动力消耗和确定最佳操作气速。
流体力学特性用气体通过填料层产生的压降表示,在填料因子、填料层高度、液体喷淋密度一定时随气体速度的变化而变。
本实验采用水吸收CO2-空气混合气中的CO2,常压下CO2在水中溶解度较小,用水吸收CO2的操作为液膜控制,在低浓度吸收时填料层高度12a X X X LdXZ K X X*=Ω-⎰即12a X X X L dXK Z X X*=Ω-⎰; 气液平衡关系符合亨利定律,则12aX m X X L K Z X -=•Ω∆,121122111222()()ln ln m X X X X X X X X X X X X X ****∆-∆---∆==∆-∆-; 由亨利定律得Y X m*=,其中,1E ym Y P y ==-;由测定物性参数水温、大气压确定亨利常数。
同时测定CO2-空气混合气体进、出填料塔CO2含量(摩尔分率),即可获得X *。
通过气相色谱仪或CO2分析仪测塔底、塔顶气相中CO2摩尔分率,转子流量计测混合气体用量,涡轮流量计测吸收剂水用量,即可测定液体体积传质系数a X K 。
四、实验装置图及主要设备(包括名称、型号、规格)(1)吸收实验流程图如下图所示:1-气体调节阀;2-孔板流量计;3-闸阀;;4,12,13-空气切换阀;5-CO2流量计;6-混合气体流量计;7-涡轮流量计;8,10-水流量调节阀;9-拉西环填料塔;11-θ环填料塔;14-塔底液位调节阀(2)设备及仪表。