第五章 气体吸收(化工原理王志魁版)
- 格式:ppt
- 大小:3.70 MB
- 文档页数:119

第二章 流体输送机械2-1 流体输送机械有何作用?答:提高流体的位能、静压能、流速,克服管路阻力。
2-2 离心泵在启动前,为什么泵壳内要灌满液体?启动后,液体在泵内是怎样提高压力的?泵入口的压力处于什么状体?答:离心泵在启动前未充满液体,则泵壳内存在空气。
由于空气的密度很小,所产生的离心力也很小。
此时,在吸入口处所形成的真空不足以将液体吸入泵内。
虽启动离心泵,但不能输送液体(气缚);启动后泵轴带动叶轮旋转,叶片之间的液体随叶轮一起旋转,在离心力的作用下,液体沿着叶片间的通道从叶轮中心进口位置处被甩到叶轮外围,以很高的速度流入泵壳,液体流到蜗形通道后,由于截面逐渐扩大,大部分动能转变为静压能。
泵入口处于一定的真空状态(或负压)2-3 离心泵的主要特性参数有哪些?其定义与单位是什么?1、流量q v : 单位时间内泵所输送到液体体积,m 3/s, m 3/min, m 3/h.。
2、扬程H :单位重量液体流经泵所获得的能量,J/N ,m3、功率与效率:轴功率P :泵轴所需的功率。
或电动机传给泵轴的功率。
有效功率P e :gH q v ρ=e P效率η:pP e =η 2-4 离心泵的特性曲线有几条?其曲线的形状是什么样子?离心泵启动时,为什么要关闭出口阀门? 答:1、离心泵的H 、P 、η与q v 之间的关系曲线称为特性曲线。
共三条;2、离心泵的压头H 一般随流量加大而下降离心泵的轴功率P 在流量为零时为最小,随流量的增大而上升。
η与q v 先增大,后减小。
额定流量下泵的效率最高。
该最高效率点称为泵的设计点,对应的值称为最佳工况参数。
3、关闭出口阀,使电动机的启动电流减至最小,以保护电动机。
2-5 什么是液体输送机械的扬程?离心泵的扬程与流量的关系是怎样测定的?液体的流量、泵的转速、液体的粘度对扬程有何影响?答:1、单位重量液体流经泵所获得的能量2、在泵的进、出口管路处分别安装真空表和压力表,在这两处管路截面1、2间列伯努利方程得:f V M H gu u g P P h H ∑+-+-+=221220ρ 3、离心泵的流量、压头均与液体密度无关,效率也不随液体密度而改变,因而当被输送液体密度发生变化时,H-Q 与η-Q 曲线基本不变,但泵的轴功率与液体密度成正比。



第五章 吸收气液相平衡【5-5】空气中氧的体积分数为21%,试求总压为.101325kPa ,温度为10℃时,31m 水中最大可能溶解多少克氧?已知10℃时氧在水中的溶解度表达式为*.6331310p x =⨯,式中*p 为氧在气相中的平衡分压,单位为kPa x ;为溶液中氧的摩尔分数。
解 总压.101325 p kPa =空气中2O 的压力分数 .021A p p ==/体积分数空气中2O 的分压 *..021101325 A p kPa =⨯亨利系数 .6331310E kPa =⨯(1) 利用亨利定律*A p Ex =计算与气相分压..021101325A p kPa =⨯相平衡的液相组成为 *. ..A p x kmol O kmol E ⨯===⨯⨯-6260.2110132564210 /331310溶液 此为1kmol 水溶液中最大可能溶解.6264210kmol O -⨯因为溶液很稀,其中溶质很少1kmol 水溶液≈1kmol 水=18 kg 水10℃,水的密度 .39997kg m ρ=/故 1kmol 水溶液≈.3189997m /水即 .3189997m 水中最大可能溶解.664210kmol -⨯氧 故 31m 水中最大可能溶解的氧量为 (6426421099973571018)kmol O --⨯⨯=⨯ ...4222357103211410O 114O kg g --⨯⨯=⨯=(2) 利用亨利定律*A A c p H =计算 ()...5369997== 167610/33131018ss H kmol m kPa EM ρ-≈⨯⋅⨯⨯ 31m 水中最大可能溶解的氧量为*(..)(.).5432021101325 16761035710A A c p H kmol O m --==⨯⨯=⨯/ 溶液 ...4222357103211410114kg O g O --⨯⨯=⨯=【5-9】CO 2分压力为50kPa 的混合气体,分别与CO 2浓度为./3001kmol m 的水溶液和CO 2浓度为.3005kmol m /的水溶液接触。

第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n kmol -=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算 //1170010610018X ==.或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为122111Y Y Y Y Y η-===-被吸收的溶质量原料气中溶质量解 原料气中NH 3的摩尔分数0.1y = 摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为 ()...211109011100111Y Y η=-=-⨯=()摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。





第五章吸收气液相平衡【5-5】空气中氧的体积分数为21%,试求总压为.101325kPa ,温度为10℃时,31m 水中最大可能溶解多少克氧?已知10℃时氧在水中的溶解度表达式为*.6331310p x =⨯,式中*p 为氧在气相中的平衡分压,单位为kPa x ;为溶液中氧的摩尔分数。
解总压.101325 p kPa=空气中2O 的压力分数.021A p p ==/体积分数空气中2O 的分压*..021101325 A p kPa =⨯亨利系数 .6331310E kPa=⨯(1)利用亨利定律*A p Ex =计算与气相分压..021101325A p kPa =⨯相平衡的液相组成为*. ..A p x kmol O kmol E ⨯===⨯⨯-6260.2110132564210 /331310溶液此为1kmol 水溶液中最大可能溶解.6264210kmol O -⨯因为溶液很稀,其中溶质很少1kmol 水溶液≈1kmol 水=18kg 水10℃,水的密度.39997kg m ρ=/故1kmol 水溶液≈.3189997m /水即.3189997m 水中最大可能溶解.664210kmol -⨯氧故31m 水中最大可能溶解的氧量为 (6426421099973571018)kmol O --⨯⨯=⨯ (4222)357103211410O 114O kg g --⨯⨯=⨯=(2)利用亨利定律*A A c p H =计算()...5369997== 167610/33131018s s H kmol m kPa EM ρ-≈⨯⋅⨯⨯31m 水中最大可能溶解的氧量为*(..)(.).5432021101325 16761035710A A c p H kmol O m --==⨯⨯=⨯/溶液 (4222)357103211410114kg O g O --⨯⨯=⨯=【5-9】CO 2分压力为50kPa 的混合气体,分别与CO 2浓度为./3001kmol m 的水溶液和CO 2浓度为.3005kmol m /的水溶液接触。
化⼯原理第五章吸收第五章吸收第⼀节概述当⽓体混合物与适当的液体接触,⽓体中的⼀个或⼏个组分溶解于液体中,⽽不能溶解的组分仍留在⽓体中,使⽓体混合物得到了分离,吸收( absorption)操作就是利⽤⽓体混合物中各组分在液体中的溶解度不同束分离⽓体混合物的。
吸收操作所⽤的液体称为吸收剂或溶剂( solvcnt);混合⽓中,被溶解的组分称为溶质( solute)或吸收质;不被溶解的组分称为惰性⽓体(inert gas)或载体;所得到的溶液称为吸收液,其成分⾜溶剂与溶质;排出的⽓体称为吸收尾⽓,如果吸收剂的挥发度很⼩,则其中主要成分为惰性⽓体以及残留的溶质。
⼀、吸收操作的应⽤吸收操作在⼯业⽣产中得到⼴泛应⽤,其⽬的有下列⼏项。
①制取液体产品。
例如⽤⽔吸收⼆氧化氮,制取硝酸;⽤硫酸吸收SO3,制取发烟硫酸等。
②回收混合⽓中有⽤组分。
例如⽤液态烃吸收⽯油裂解⽓中的⼄烯和丙烯;⽤硫酸吸收焦炉⽓中的氨。
③除去⼯艺⽓体中有害组分,以净化⽓体。
例如⽤⽔或⼄醇胺除去合成氨原料⽓中的C02。
④除去⼯业放卒尾⽓rti的有害组分。
例如除去尾⽓中的H2S、SO2等,以免⼤⽓污染。
随着⼯业的发展,要求⼯业尾⽓中有害组分的含量越来越少。
⼆、吸收设备吸收设备有多种类型,最常⽤的有填料塔与板式塔,如图5-1所⽰。
填料塔中装有诸如瓷环之类的填料,⽓液接触在填料中进⾏。
板式塔中安装有筛孔塔板,⽓液两相在塔板⼀E⿎泡进⾏接触。
混合⽓体从塔底引⼊吸收塔,向1流动;吸收剂从塔顶引⼊,向下流动。
吸收液从塔底引⼩,吸收尾⽓从塔顶引出。
填料塔与板式塔的计算⽅法不同,本章将介绍填料塔的计算。
板式塔的计算⽅法将在下⼀章介绍。
三、吸收过程的分类(1)物理吸收与化学吸收若溶质与吸收剂之间没有化学反应,⽽只靠溶质在吸收剂中的物理溶解度,则被吸收时称为物理吸收。
若溶质靠化学反应与吸收剂相结合,则被吸收时称为化学吸收。
物理吸收时,溶质在溶液上⽅的分压⼒较⼤,⽽且吸收过程最后只能进⾏到溶质在⽓相的分压,⼒略⾼于溶质在溶液上⽅的平衡分压为⽌化学吸收时,若为不可逆反腑,溶液上⽅的溶质平衡分压⼒极⼩,可以充分吸收;若为可逆反应⼀溶液上⽅存在明挂的溶质平衡分压⼒,但⽐物理吸收时⼩很多。
化工原理王志魁第五版答案
《化工原理》王志魁第五版习题答案列表如下:
一、第一章
1.1 什么是化学工程
化学工程是一门研究化学过程及其工艺的学科,主要涉及化学反应、
传热、传质、流动等方面。
1.2 化学反应基础
化学反应是化学工程中最重要的环节之一,包括化学平衡、反应速率、反应热等方面。
1.3 能量和能量平衡
能量是化学工程中最基本的物理量之一,能量平衡是化学工程设计和
运行的基础。
二、第二章
2.1 流体静力学基础
流体静力学是研究静止流体力学性质和流体中的压力分布的学科。
2.2 流体动力学基础
流体动力学是研究流体在运动中的力学性质、运动规律及其应用的学科。
2.3 流体动力学基本方程
流体动力学的基本方程包括质量守恒方程、动量守恒方程和能量守恒方程。
三、第三章
3.1 质量传递基础
质量传递是化工过程中必不可少的环节之一,包括传递过程和传递速率等方面。
3.2 质量传递基本方程
质量传递的基本方程包括扩散方程、对流方程和总质量守恒方程。
3.3 物料平衡
物料平衡是化工过程中必不可少的环节之一,包括原料的进出量、反
应产物的生成量和回收量等方面。
四、第四章
4.1 常见的化工反应
常见的化工反应包括酸碱中和、氧化还原、脱水、加氢等方面。
4.2 燃烧反应
燃烧反应是一种氧化还原反应,是化工过程中常发生的一种反应类型。
4.3 催化剂的应用
催化剂在化学工程中的应用广泛,能够提高反应速率和选择性,降低
反应温度和压力等。
以上是《化工原理》王志魁第五版习题答案列表。
化工原理(第五版)王志魁课后习题答案第一章介绍1.1 化工原理的定义化工原理是研究化学工程中基本原理和基本法律的学科。
它是化学工程学科体系中最基础、最重要的一门课程,是化学工程专业的核心课程之一。
1.2 化工原理的研究内容化工原理研究内容包括: - 物质的组成与结构 - 物质的性质和化学反应 - 物质的传质与传热 - 化工过程的基本原理与基本法律 - 化工过程的分析与设计方法1.3 化工原理的学习目标通过学习化工原理,学生应该能够: - 理解物质的组成与结构,掌握化学元素周期表及化学键类型 - 理解物质的性质和化学反应,包括溶解度、反应速率、平衡等 - 掌握物质的传质与传热的基本原理与计算方法 - 理解化工过程的基本原理与基本法律,包括质量守恒、能量守恒、流体流动等 - 掌握化工过程的分析与设计方法,包括物质平衡、能量平衡、流程图分析等第二章物质的组成与结构2.1 化学元素周期表化学元素周期表是一种显示化学元素基本信息的表格。
它按照元素的原子序数、原子量、电子结构等特征进行排列,方便了对元素性质的研究和应用。
2.2 化学键的类型化学键是指由电子共享或电子转移形成的连接两个或多个原子的化学键。
根据电子的共享和转移情况,化学键可分为离子键、共价键和金属键。
2.3 共价键的形成共价键是由电子的共享形成的化学键。
共价键的形成需要原子之间存在有效的电子交互作用,通常需要原子之间能够形成稳定的分子轨道。
第三章物质的性质和化学反应3.1 溶解度溶解度是指单位温度下,在一定量的溶剂中溶解度最多的溶质的质量。
溶解度受到溶剂性质、溶质性质和温度的影响。
3.2 反应速率反应速率是指化学反应中物质转化的快慢程度。
反应速率受到反应物浓度、反应温度、催化剂等因素的影响。
3.3 平衡平衡是指化学反应中反应物与生成物浓度达到一定比例后,反应停止。
平衡的存在使得反应进行到一定程度后,反应物和生成物的浓度保持稳定。
第四章物质的传质与传热4.1 传质传质是指物质在不同相之间由高浓度区向低浓度区传递的过程。
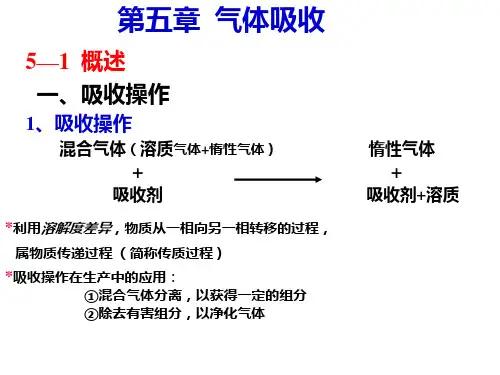
第五章气体吸收第一节概述§5.1.1概述一、传质过程从本章起,讨论化工生产中的传质过程及其典型设备。
传质过程是指物质通过相界面从一相迁移至另一相的过程,以下图示意:>,则A物质就会从相迁移至相。
迁移的结果使得相的A、B据热力学知识,两物质得以一定程度或完全分离,而相形成了A、B两物质的混合物。
因此相内进行的是A、B的分离过程,相内进行的是A、C的混合过程。
研究传质过程就是研究物质通过相界面的迁移过程的基本规律以及主要受这些基本规律支配的若干单元操作。
混合物系的分离对我们来说并不陌生,在上册中我们已经学习掌握了非均相物系的分离方法,相应单元操作如沉降、过滤等,从这一章起要来讨论均相物系的分离。
用下表来比较说明非均相、均相物系的分离情况:本学期的任务就是要掌握气体、液体蒸馏、液液萃取和固体干燥这四个单元操作的基本原理及其典型设备的设计。
二、气体吸收吸收操作是分离气体混合物的方法之一。
吸收操作的分离依据是混合物各组分在某种溶剂(吸收剂)中溶解度的差异,从而达到的目的。
例如:将含的空气通入水中,因、空气在水中溶解度差异很大,NH3很容易溶解于水中,形成氨水溶液,而空气几乎不溶于水中。
所以用水吸收混合气体中的能使、空气加以分离,并回收。
一般地,混合气体中能溶解的组份称为溶质或吸收质,用A表示();混合气体中不能溶解的组份称为惰性成分或载体,用B表示(空气);吸收操作中所用的溶剂称为吸收剂或溶剂,用S表示(水);吸收操作中所得的溶液称为吸收液,用S+A表示;吸收操作中排除的气体称为吸收尾气,用(A)+B表示;吸收的目的有三个:1.分离混合气体以获得一定的组分。
(例子:硫酸吸收焦炉气中的,洗油吸收焦炉气中的苯、甲苯蒸汽。
)2.除去有害组分以净化气体。
(例子:用水或钾碱液吸收合成氨原料气中的二氧化碳。
)3.制备某种气体的溶液。
(例子:用水吸收氯化氢、三氧化硫、二氧化氮制得酸。
)实际过程往往同时兼有净化和回收双重目的。