常见反应的现象
- 格式:doc
- 大小:111.50 KB
- 文档页数:7

常见的化学反应及现象综合1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2.镁带在空气中燃烧(化合反应)2Mg + O2 = 2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)2H2O = 2H2↑ + O2↑现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4.生石灰和水反应(化合反应)CaO + H2O = Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。
(4)发出大量的热5.实验室制取氧气①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)2KClO3MnO2催化2KCl + 3O2↑相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4 = K2MnO4 + MnO2 + O2↑相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。

各种常见物质反应现象1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。

常见的化学反应及现象综合1、澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2、镁带在空气中燃烧(化合反应)2Mg + O2 = 2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃 ;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3、水通电分解(分解反应)2H2O = 2H2↑ + O2↑现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气与氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4、生石灰与水反应(化合反应)CaO + H2O = Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰就是氧化钙,熟石灰就是氢氧化钙。
(4)发出大量的热5、实验室制取氧气①加热氯酸钾与二氧化锰的混合物制氧气(分解反应)2KClO3MnO2催化2KCl + 3O2↑相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量与化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体就是氯化钾与二氧化锰的混合物,进行分离的方法就是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4 = K2MnO4 + MnO2 + O2↑相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。

高中常见化学反应及现象化学是一门研究物质变化及性质的科学,它涉及各种化学反应和现象。
在高中化学研究中,我们经常会遇到一些常见的化学反应和现象。
以下是一些常见的高中化学反应和现象的简要介绍:化学反应1. 酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的过程。
在这种反应中,酸的氢离子和碱的氢氧根离子结合形成水,并释放出热量。
2. 氧化还原反应氧化还原反应涉及物质的电子转移。
氧化指的是失去电子,还原指的是得到电子。
在氧化还原反应中,氧化剂接受电子,而还原剂失去电子。
3. 气体生成反应气体生成反应是指两种或更多物质反应产生气体的过程。
常见的气体生成反应包括酸和金属反应产生氢气,碳酸氢盐分解产生二氧化碳等。
4. 沉淀反应沉淀反应是指溶液中两种物质发生化学反应后,生成不溶于溶液的固体沉淀物。
这种反应通常涉及离子的交换或结合。
化学现象1. 蒸发蒸发是指液体变为气体的过程,发生在液体表面而不需要加热。
蒸发是由分子在液体表面能量较高而逸出形成气体分子的过程。
2. 溶解溶解是指固体、液体或气体溶于溶剂中形成溶液的过程。
在溶解过程中,溶质的分子或离子与溶剂的分子相互作用,形成一个均匀混合的溶液。
3. 氧气燃烧氧气燃烧是指氧气与可燃物质反应产生热和光的过程。
这种反应需要氧气、可燃物质和足够的活化能。
4. 金属的反应金属的反应包括与酸反应产生氢气,与非金属元素反应产生氧化物等。
金属还可以发生腐蚀、氧化和还原等各种化学反应。
以上是高中常见的化学反应和现象的简要介绍。
通过学习和理解这些反应和现象,我们可以更好地理解化学的基本原理和应用。

常见化学反应及现象
酸性溶液遇紫色石蕊试液变红、遇无色酚酞不变色
硫酸或盐酸与铁反应:现象:固体溶解,溶液变为浅绿色
化学方程式:2HCl+Fe=FeCl2+H2↑
硫酸或盐酸与氧化铁反应:现象:红棕色固体逐渐溶解,溶液变为黄色
化学方程式:6HCl+Fe2O3=2FeCl3+3H2O
硫酸与氧化铜反应:现象:黑色固体逐渐溶解,溶液变为蓝色
化学方程式:H2SO4+CuO=CuSO4+H2O
盐酸与碳酸钠反应:现象:有气泡冒出,能使澄清石灰水变浑浊
化学方程式:2HCl+Na2CO3=2NaCl+H2O+CO2↑
盐酸与硝酸银反应:现象:出现白色沉淀(不溶于水和酸)
化学方程式:HCl+AgNO3=AgCl↓+HNO3
硫酸与氯化钡反应:现象:出现白色沉淀(不溶于水和酸)
化学方程式:H2SO4+BaCl2=BaSO4↓+2HCl
碱性溶液遇紫色石蕊试液变蓝、遇无色酚酞变红(若是碱,为可溶或微溶性碱)
氢氧化钙与二氧化碳反应:现象:澄清石灰水变浑浊
化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O
氢氧化钠与硫酸铜反应:现象:溶液颜色变浅,生成蓝色絮状沉淀(可溶或微溶性碱)化学方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
氢氧化钠与氯化铁反应:现象:溶液颜色变浅,生成红褐色沉淀(可溶或微溶性碱)化学方程式:3NaOH+ FeCl3= Fe(OH)3↓+3NaCl。

常见的化学反应及现象综合1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2.镁带在空气中燃烧(化合反应)2Mg + O2 = 2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)2H2O = 2H2↑ + O2↑现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4.生石灰和水反应(化合反应)CaO + H2O = Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。
(4)发出大量的热5.实验室制取氧气①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)2KClO3MnO2催化2KCl + 3O2↑相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4 = K2MnO4 + MnO2 + O2↑相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。
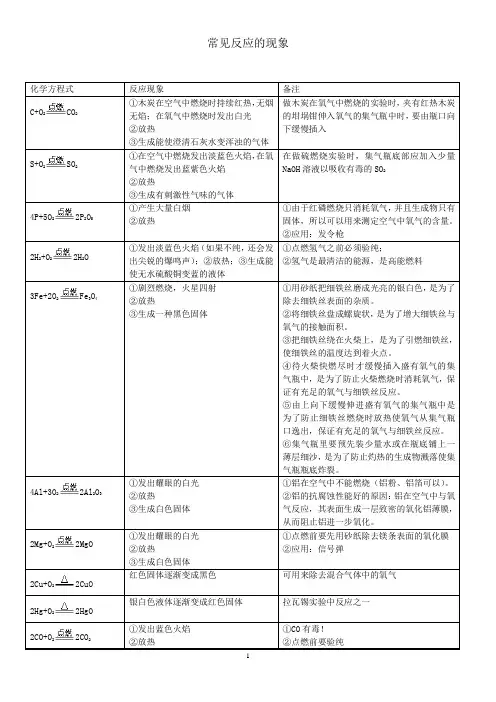

常用反应的反应现象及表达式1、 加热碳酸氢铵实验现象:加热时产生刺激性气味的气体,试管口有水珠,产生能使澄清石灰水变浑浊的气体。
文字表达式达: 符号表达式: 2、加热铜绿实验现象:绿色粉末变为黑色,试管内壁有小水珠,澄清石灰水变浑浊。
文字表达式达:碱式碳酸铜 氧化铜+水+二氧化碳符号表达式:Cu 2(OH)2CO 3 CuO+H 2O+CO 23、镁条燃烧实验现象:发出耀眼白光,放出热量,生成白色固体。
文字表达式:镁+氧气 氧化镁符号表达式:Mg+O 2 MgO4、红磷燃烧实验现象:产生大量白烟、放出热量、生成白色固体。
文字表达式达:红磷+氧气五氧化二磷 符号表达式:P+ O 2 P 2O 55、 蜡烛燃烧实验现象:在氧气中燃烧,火焰明亮,发出白光,放出热量,瓶壁有水雾,生成能使澄清石灰水变浑浊的气体文字表达式达:石蜡+氧气 二氧化碳+水 符号表达式: 6、铁丝在氧气中燃烧实验现象:剧烈燃烧、火星四射、放出热量、生成黑色固体。
文字表达式达:铁+氧气四氧化三铁 符号表达式:Fe+ O 2 Fe 3O 47、木炭燃烧 实验现象:木炭在空气中燃烧,持续红热,放出热量,生成能使澄清石灰水变浑浊的气体。
NH 3+H 2O+CO 2氨气+水+二氧化碳 碳酸氢铵 点燃 点燃 加热 加热 点燃 点燃 △ NH 4HCO 3 △ 点燃 点燃 点燃木炭在氧气中能够剧烈地燃烧,发出白光,放出热量,生成使澄清石灰水变浑浊的气体。
文字表达式:碳+氧气 二氧化碳符号表达式:C+O 2 CO 28、硫燃烧 实验现象:硫在空气中燃烧,发出淡蓝色火焰,放出热量,生成有刺激性气味的气体。
硫在氧气中燃烧,发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体。
文字表达式达:硫+氧气二氧化硫 符号表达式:S+O 2SO 29、氢气燃烧实验现象:产生淡蓝色火焰,放出热量,有水雾出现。
文字表达式达:氢气+氧气水 符号表达式:H 2+O 2 H 2O10、铜绿与稀盐酸反应实验现象:绿色粉末逐渐溶解,产生大量气泡,液体由无色变为蓝色文字表达式达:碱式碳酸铜+盐酸 氯化铜+二氧化碳+水 符号表达式:Cu 2(OH)2CO 3 +HCl CuCl 2+CO 2+H 2O 11、镁带与稀盐酸反应实验现象:镁带逐渐溶解,在固体表面产生大量气泡,得到无色溶液, 文字表达式达:镁+盐酸 氯化镁+氢气 符号表达式:Mg+HCl MgCl 2+H 212、二氧化碳的检验实验现象:澄清石灰水变浑浊文字表达式达:二氧化碳+氢氧化钙 碳酸钙+水符号表达式:CO 2+Ca(OH)2CaCO 3+H 2O13、加热高锰酸钾制氧气文字表达式达:高锰酸钾 锰酸钾+二氧化锰+氧气 符号表达式:KMnO 4K 2MnO 4+MnO 2+O 214、加热氯酸钾和二氧化锰制氧气点燃 点燃 点燃 加热 点燃点燃点燃△文字表达式达:氯酸钾氯化钾+氧气符号表达式:KClO3KCl+O215、双氧水制氧气文字表达式达:过氧化氢水+氧气符号表达式:H2O2H2O+O216、电解水文字表达式达:水氢气+氧气符号表达式:H2O H2+O217、二氧化碳与水反应文字表达式达:二氧化碳+水碳酸符号表达式:CO2+H2O H2CO318、碳酸受热分解文字表达式达:碳酸二氧化碳+水符号表达式:H2CO3CO2+H2O19、实验室制取二氧化碳文字表达式达:碳酸钙+盐酸氯化钙+二氧化碳+水符号表达式:CaCO3+HCl CaCl2+CO2+H2O20、植物的光合作用文字表达式达:二氧化碳+水葡萄糖+氧气符号表达式:CO2+H2O C6H12O6+O2二氧化锰通电加热叶绿体光照MnO2△MnO2通电△叶绿体光照二氧化锰加热。

生活中的化学反应现象化学反应是指物质在发生变化过程中,产生了新的物质,并伴随着能量的释放或吸收。
在我们日常的生活中,有许多化学反应现象,下面就为大家介绍几个常见的例子。
第一个例子是蜡烛燃烧。
当我们点燃蜡烛时,蜡烛会燃烧产生火焰,同时释放出光和热。
这是因为蜡烛中的石蜡和棕榈蜡在与空气中的氧气发生化学反应后,生成二氧化碳和水。
这个反应过程释放出的热量使得蜡烛能够持续燃烧。
第二个例子是苹果氧化变色。
当我们将苹果切开一段时间后,会发现苹果的表面逐渐变黄或褐色。
这是因为苹果中的物质与空气中的氧气发生化学反应,产生了一种称为多酚氧化酶的酶类物质。
这个酶类物质会催化苹果中的多酚类物质与氧气发生反应,形成了氧化产物,导致了苹果表面的颜色变化。
第三个例子是牛奶变酸变质。
当牛奶存放时间过长或受到污染时,会发生酸败现象,即牛奶变酸变质。
这是因为牛奶中的乳糖与牛奶中的乳酸菌发生化学反应,产生了乳酸。
乳酸的积累导致了牛奶味道酸酸的。
第四个例子是金属生锈。
当金属长时间暴露在潮湿的环境中,会发生金属生锈的现象。
这是因为金属表面的铁与空气中的水和氧气发生化学反应,生成了一种称为铁锈的物质。
铁锈不仅会影响金属的外观,还会导致金属的腐蚀。
以上只是生活中化学反应现象的一些例子,实际上,化学反应无处不在,我们每天都能见到和感受到它们的存在。
通过了解这些化学反应现象,我们能够更好地理解和掌握化学知识,并且更好地应用于我们的生活中。
总的来说,生活中的化学反应现象多种多样,它们以各种形式出现在我们的日常生活中。
通过对这些现象的观察和理解,我们不仅可以加深对化学的认识,还能更好地保护和利用我们的环境和资源。

化学实验中的常见反应现象与观察方法化学实验是学习化学知识和理论的重要环节,在实验过程中,我们常常会遇到各种各样的反应现象。
观察并理解这些反应现象不仅可以帮助我们加深对化学理论的理解,还能提高我们实验操作的技巧和实验分析的能力。
本文将介绍一些常见的化学实验中的反应现象及观察方法。
1. 气体生成反应气体生成反应是常见的实验现象之一。
在实验室中,常用酸与碱反应或碳酸盐与酸反应进行气体的制备。
气体生成反应的观察方法可以通过气泡的产生、气体体积的增加以及气体颜色的变化等来判断。
例如,当盛有稀盐酸的试管与加入碱溶液的试管相接触时,可以观察到气泡的产生,并且可以通过通入通明的饱和石灰水来检验生成的气体是否为二氧化碳。
2. 沉淀生成反应沉淀生成反应在实验室中也非常常见,常常用于确定物质之间的化学反应。
观察沉淀反应主要通过观察是否有沉淀物的生成,以及沉淀物的颜色和形态等来判断反应是否发生。
例如,在铁离子溶液与硫酸盐溶液反应的实验中,可以观察到产生黑色的沉淀物,这是一种典型的沉淀生成反应。
3. 颜色变化反应一些化学实验中的反应会伴随着颜色的变化,这种观察方法可以帮助我们判断反应的进行和反应物的消耗程度。
例如,在电解铜(II)硫酸溶液的实验中,铜离子的颜色会逐渐变浅并最终消失,而同时在电极上会生成铜金属。
这种颜色变化反应不仅可以帮助我们验证电解反应的进行,还能帮助我们判断电解质的浓度变化。
4. 温度变化反应某些化学反应伴随着温度的变化,观察反应的温度变化可以帮助我们判断反应是放热反应还是吸热反应。
在实验中,可以使用温度计来测量反应液体的温度变化,或者直接用手触摸容器的表面来判断温度的变化。
例如,溶解氨气的实验中可以观察到容器表面的降温,这是因为溶解氨气是一个吸热反应。
5. 发光反应某些物质或化合物在受到特定激发条件下会发出光,这种现象被称为化学发光。
观察化学发光反应通常需要保持实验室的暗环境,并在适当的条件下使反应发生。

1. 镁带燃烧 ↑+2O 2M g 2M g O 点燃 现象:剧烈燃烧,发出耀眼白光,生成白色粉末.放热.2. 铜绿受热分解 ↑++22322CO O H 2CuO ΔCO (OH)Cu 现象:绿色粉末变黑,试管壁出现小水珠,产生气体使澄清石灰水变混浊.放热.3. 木炭燃烧 22CO O C 点燃+(氧气充足) 2CO O 2C 点燃2+(氧气不足) 现象:空气中,红光;氧气中,白光;生成气体使澄清石灰水变混浊.放热.4. 硫燃烧 22SO O S 点燃+ 现象:空气中微弱的淡蓝色火焰,氧气中,明亮的蓝紫色火焰,有刺激性气味气体生成.放热.5. 磷燃烧 522O 2P 5O 4P 点燃+ 现象:产生白烟,放热.6. 铁丝在氧气中燃烧 432O Fe 2O 3Fe 点燃+ 现象:剧烈燃烧,火星四射,生成黑色固体.放热.7. 实验室制氧气↑+2233O 2KCl ΔMnO 2KCL0 ↑++22424O MnO MnO K Δ2KMnO 8. 通电分解水 ↑↑+222O H O 2H 2通电 现象:①正氧负氢 ②V 正:V 负=1:29. 实验室制氢气 ↑++2442H Z n S O SO H Zn10. 锌和盐酸 ↑++22H Z n C l 2HC l Zn11. 铁和盐酸 / 硫酸 ↑++22H F e C l 2HC l Fe ↑++2442H FeSO SO H Fe现象:铁片上有气泡,铁片逐渐减少,溶液由无色变为浅绿色.12. 镁和盐酸 / 硫酸 ↑++22H M g C l 2HC l Mg ↑++2442H MgSO SO H Mg13. 氢气在空气中燃烧 O H O 2H 2222点燃+ 现象:淡蓝色火焰,放热,罩在火焰上方的烧杯壁上出现小水珠.14. 氢气还原氧化铜 O H Cu ΔCuO H 22++ 现象:黑色粉末变红,试管壁出现小水珠.15. 氢氧化钠和硫酸铜反应 ↓++2424C u (O H)SO Na CuSO 2NaOH 现象:生成蓝色沉淀16. 氧化汞受热分解 ↑+2O 2Hg Δ2HgO17. 木炭还原氧化铜 ↑++2CO Cu 2CuOC 2高温 现象:黑色粉末变红,产生气体使澄清石灰水变混浊.18..一氧化碳燃烧222CO O 2CO 点燃+现象:产生蓝色火焰,放热, 产生气体使澄清石灰水变混浊.19. 一氧化碳还原氧化铜 2CO Cu ΔCuOCO ++ 现象: 黑色粉末变红,产生气体能使澄清石灰水变混浊.20. 一氧化碳还原氧化铁(工业炼铁) 2323CO 2Fe O Fe 3CO 高温++ 21. 二氧化碳欲灼热的炭反应 2C O CO C 高温2+22. 二氧化碳通入紫色石蕊试液中 3222CO H O H CO + 现象:紫色石蕊试液变红23. 碳酸分解 O H CO CO H 2232+↑24. 二氧化碳通入澄清石灰水中O H CaCO Ca(OH)CO 2322+↓+ 现象:澄清石灰水变混浊.25. 煅烧石灰石 ↑+23CO CaO CaCO 高温26. 生石灰制熟石灰 22Ca (OH)O H Ca O =+27. 实验室制二氧化碳 ↑+++2223CO O H CaCl 2HCl CaCO28. 灭火器原理 ↑+++2232CO O H 2NaCl 2HCl CO Na29. 甲烷燃烧 O 2H CO 2O CH 2224点燃++ 现象:产生蓝色火焰,放出热量.30. 酒精燃烧 O 3H 2CO 3O OH H C 22252点燃++31. 甲醇燃烧 O 4H 2CO 3O OH 2CH 2223点燃++ 32. 曾青得铁则化为铜 Cu FeSO CuSO Fe 44++ 现象:铁表面有红色物质析出,溶液由蓝色变为浅绿色.33. 一氧化碳还原四氧化三铁 2434CO 3Fe 4CO O Fe 高温++34. 盐酸除铁锈 O 3H 2FeCl 6HCl O Fe 2332+=+ 现象:铁锈消失,形成黄色溶液.35. 盐酸跟氧化铜反应 O H Cu Cl Cu O 2HCl 22+=+ 现象:黑色粉末溶解,形成蓝色溶液.36. 盐酸跟氢氧化钠 O H Na Cl Na OHHCl 2+=+ 无明显现象 37. 盐酸跟氢氧化铜 O H 2CuCl Cu(OH)2HCl 222+=+ 现象:蓝色固体溶解,形成蓝色溶液38. 盐酸跟硝酸银溶液 33HNO AgCl AgNO HCl +↓=+ 现象:生成白色沉淀,沉淀不溶于稀硝酸.39. 硫酸除铁锈 O 3H )(SO Fe SO 3H O Fe 23424232+=+ 现象:铁锈消失,形成黄色溶液.40. 硫酸跟氧化铜 O H Cu S O Cu O SO H 2442+=+ 现象:黑色粉末溶解,形成蓝色溶液.41. 硫酸跟氢氧化钠 O 2H SO Na 2NaOH SO H 24242+=+ 无明显现象42. 硫酸跟氢氧化铜O 2H CuSO Cu(OH)SO H 24242+=+现象:蓝色固体溶解,形成蓝色溶液43. 硫酸跟氯化钡溶液 2HCl BaSO BaCl SO H 4242+↓=+ 现象:生成白色沉淀,沉淀不溶于稀硝酸.44. 硝酸跟氧化锌 O H )Z n (NO Z n O 2HNO 2233+=+45. 硝酸跟氧化铁 O 3H )2Fe(NO O Fe 6HNO 233323+=+46. 硝酸跟氧化钙 O H )Ca (NO Ca O 2HNO 2233+=+47. 硝酸跟氢氧化镁 O 2H )Mg(NO Mg(OH)2HNO 22323+=+ 现象:白色固体溶解48. 硝酸跟碳酸钡 ↑++=+22333CO O H BaCO BaCO HNO49. 氢氧化钠溶液跟二氧化碳 O H CO Na CO 2NaOH 2322+=+50. 氢氧化钠溶液跟二氧化硫 O H SO Na SO 2NaOH 2322+=+ (Na 2SO 3为亚硫酸钠)51. 氢氧化钠溶液跟三氧化硫 O H SO Na SO 2NaOH 2423+=+52. 氢氧化钠溶液跟氯化铁溶液3NaCl Fe(OH)FeCl 3NaOH 33+↓=+现象:生成红褐色沉淀53. 氢氧化钠溶液跟氯化铜溶液2NaCl Cu(OH)CuCl 2NaOH 22+↓=+现象:生成蓝色沉淀54. 氢氧化钙溶液跟碳酸钠溶液(工业制氢氧化钠) ↓+=+3322CaCO 2NaOH CO Na Ca(OH) 现象:生成白色沉淀55. 氢氧化铁跟硫酸溶液 O 6H )(SO Fe 2Fe(OH)SO 3H 2342342+=+ 现象:红褐色固体溶解,溶液由无色变成黄色.56. 碳酸钠晶体风化 O 10H CO Na O 10H CO Na 232232+=⋅57. 胆矾受热分解 O 5H CuSO ΔO 5H CuSO 2424+⋅。
常见化学反应类型及主要反应现象一、化合反应1.红、白磷在空气中燃烧,放热,产生大量的白烟,生成白色固体:4P+5O 22P2O52.木炭黑色固体燃烧:C+O 2CO2;氧气充分时的反应现象:①木炭在空气中燃烧时持续红热,无烟无焰;在氧气中燃烧时发出白光;②放热;③生成能使澄清石灰水变浑浊的无色气体;3.木炭黑色固体燃烧:2C+O 22CO;氧气不充分时的反应现象:①木炭在空气中燃烧时持续红热,无烟无焰;②放热;③生成一种无色、有毒气体;4.硫在空气氧气中燃烧:S+O 2SO2;反应现象:①在空气中燃烧发出微弱的淡蓝色火焰,在氧气中燃烧发出明亮的蓝紫色火焰;②放热;③生成有刺激性气味的无色气体;5.铁丝在氧气中燃烧:3Fe+2O 2Fe3O4;反应现象:①剧烈燃烧,火星四射;②放热;③生成一种黑色固体;6.铝在氧气中燃烧:4Al+3O 22Al2O37.铝不易生锈的原因:4Al+3O2=2Al2O38.镁在空气中燃烧:2Mg+O 22MgO;反应现象:①发出耀眼的强白光;②放热;③生成白色固体;9.铜在空气中加热:2Cu+O 22CuO;反应现象:红色固体逐渐变成黑色固体;10.氢气在氧气中燃烧:2H2+O 22H2O;反应现象:①发出淡蓝色火焰如果不纯,还会发出尖锐的爆鸣声;②放热;③生成能使无水硫酸铜变蓝的液体;11.将CO2变成CO:C+CO 22CO;12.二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3;反应现象:生成的酸性物质能使紫色石蕊试液变红色;13.用生石灰制取熟石灰:CaO+H2O=CaOH2反应现象:白色块状固体变成白色粉末状固体,同时放出大量的热;14.一氧化碳燃烧:2CO+O 22CO2 ;反应现象:①发出蓝色火焰如果不纯,还会发出爆鸣声;②放热;③生成能使澄清石灰水变浑浊的无色气体;15.向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:CaCO3+CO2+H2O=CaHCO3216.氢气在氯气中燃烧:H2+Cl 22HCl17.钠在氯气中燃烧:2Na+Cl 22NaCl18.镁在氮气中燃烧:3Mg+N 2Mg3N2注意氮元素的化合价19.上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与;二、分解反应1.汞在空气中加热:2Hg+O 22HgO;反应现象:银白色液体变成红色粉末;2.氧化汞加强热:2HgO2Hg+O2↑;反应现象:红色粉末变成银白色液体,生成的无色气体能使带火星的木条复燃;3.①分解过氧化氢制取氧气实验室制取氧气的反应原理之一:2H2O 22H2O+O2↑;反应现象:产生大量的气泡,生成的无色气体能使带火星的木条复燃;②加热高锰酸钾制取氧气实验室制取氧气的反应原理之二:2KMnO 4K2MnO4+MnO2+O2↑;反应现象:紫黑色色固体质量减少,生成的无色气体能使带火星的木条复燃;③加热氯酸钾制取氧气实验室制取氧气的反应原理之三:2KClO 32KCl+3O2↑;反应现象:白色固体质量减少,生成的无色气体能使带火星的木条复燃;上面三种制取氧气的方法中给我们的启示是:分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种;4.电解水生成氢气和氧气:2H2O2H2↑+O2↑反应现象:①通电后,电极上有气泡产生;通电一段时间后,两个试管内汇集了一些气体,与正、负极相连的试管内的气体体积比约为1:2,质量比约为8:1;②与正极相连的试管内的气体可以使带火星的木条复燃;与负极相连的试管内的气体移近火焰时,气体能够燃烧,火焰呈淡蓝色;5.工业制取生石灰和CO2的反应原理:CaCO 3CaO+CO2↑;反应现象:白色固体质量减少,同时生成白色固体和能使澄清石灰水变浑浊的无色气体;6.干粉灭火器的反应原理碳酸氢钠受热分解:2NaHCO 3Na2CO3+H2O+CO2↑;反应现象:白色固体质量减少,同时生成白色固体和能使澄清石灰水变浑浊的无色气体;7.碱式碳酸铜受热分解:Cu2OH2CO 32CuO+H2O+CO2↑;反应现象:绿色固体质量减少,同时生成黑色固体和能使澄清石灰水变浑浊的无色气体;8.过氧化氢溶液不稳定,发生分解:2H2O 22H2O+O2↑9.碳酸不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2↑10.碳铵碳酸氢铵“消失”并发出刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O三、置换反应1.氢气还原氧化铜:H2+CuO Cu+H2O;反应现象:黑色固体变成红色固体,同时有水珠产生;2.木炭还原氧化铜:C+2CuO2Cu+CO2↑;反应现象:黑色固体变成红色固体,同时生成能使澄清石灰水变浑浊的无色气体;3.木炭还原氧化铁:3C+2Fe2O 34Fe+3CO2↑反应现象:红色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;4.水煤气的形成:C+H2O H2+CO注意没有气体生成符号↑5.实验室制取氢气的反应原理:Zn+H2SO4=ZnSO4+H2↑;反应现象:锌粒表面有大量气泡产生,生成的气体能够燃烧,火焰呈淡蓝色;四、复分解反应1.实验室制取CO2的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;反应现象:大理石或石灰石的表面有大量气泡产生,生成的无色气体能使澄清石灰水变浑浊;2.盐酸与水垢中的主要成分发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑;反应现象:水垢的表面有大量气泡产生,生成的无色气体能使澄清石灰水变浑浊;3.实验室不用大理石和稀硫酸制取CO2的原因:CaCO3+H2SO4=CaSO4+H2O+CO2↑;反应现象:大理石或石灰石的表面先有大量气泡产生,然后逐渐减少,最后反应停止,是因为反应中生成的微溶于水的物质覆盖在大理石或石灰石的表面,阻止了反应的进行,但反应开始时生成的无色气体能使澄清石灰水变浑浊;4.泡沫灭火器的反应原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑;反应现象:碳酸钠迅速溶解,瞬间产生大量的无色气体,该无色气体能使澄清石灰水变浑浊;五、非基本类型1.一氧化碳还原氧化铜检验一氧化碳的反应原理:CO+CuO Cu+CO2反应现象:黑色固体变成红色固体,同时生成能使澄清石灰水变浑浊的无色气体;2.一氧化碳还原氧化铁用赤铁矿炼铁、高炉炼铁的反应原理:3CO+Fe2O 32Fe+3CO2反应现象:红色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;3.一氧化碳还原氧化亚铁:i.CO+FeO Fe+CO2ii.反应现象:黑色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;4.一氧化碳还原四氧化三铁用磁铁矿炼铁:4CO+Fe3O 43Fe+4CO2;反应现象:黑色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;5.黑火药点燃爆炸:S+2KNO3+3C K2S+N2↑+3CO2↑6.甲烷燃烧:CH4+2O 2CO2+2H2O7.乙醇燃烧:C2H5OH+3O 22CO2+3H2O8.二氧化碳使澄清的石灰水变浑浊CaOH2固体变质的原因:CaOH2+CO2=CaCO3↓+H2O9.用NaOH溶液吸收CO2NaOH固体变质的原因:2NaOH+CO2=Na2CO3+H2O10.用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O11.NaOH溶液与SO3反应:2NaOH+SO3=Na2SO4+H2O12.葡萄糖的缓慢氧化:C6H12O6+6O 26CO2+6H2O常见物质的颜色、气味固体1.红色:红磷P、铜Cu、氧化铁Fe2O32.黄色:金Au、硫S3.紫黑色:高锰酸钾晶体KMnO44.淡蓝色:固态氧O25.黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO6.深灰色:石墨C7.无色:金刚石C、干冰CO2、冰H2O8.白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的;9.有刺激性气味的固体:碳酸氢铵NH4HCO3 ;液体1.淡蓝色:液态氧O22.蓝色:含有Cu2+的溶液3.浅绿色:含有Fe2+的溶液4.黄色:含有Fe3+的溶液5.银白色:汞Hg6.我们学过的大多数液体都是无色的;7.有特殊气味的液体:乙醇C2H5OH8.有刺激性气味的液体:醋酸CH3COOH气体1.红棕色气体:二氧化氮NO2 ;2.有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等;3.有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等;4.我们学过的大多数气体都是无色无味的;5.计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等;6.能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等;。
反应现象的概念反应现象是指化学反应中物质之间发生的转化和变化的过程和现象。
在化学反应中,参与反应的化学物质(即反应物)会经过一系列变化和转化,形成新的物质(即生成物)。
反应现象可以通过观察物质的物理和化学性质的变化来判断。
一、反应现象的表现形式1. 气体的产生或消失:在许多反应中,气体的产生或消失是很常见的反应现象。
例如,酸与金属反应时,会生成氢气。
气体的产生或消失通常通过气泡的产生、气体的散发或气体的收集等方式观察。
2. 溶液的颜色变化:反应物和生成物的颜色通常会有所不同,某些反应的过程中,溶液的颜色会发生明显的变化。
例如,酸碱中和反应中,酸性溶液逐渐变为中性溶液,其颜色从红色或黄色变为中性的绿色。
3. 沉淀的生成:当两种溶液混合时,有些物质会反应生成难溶于溶液中的沉淀。
这种现象被称为沉淀反应。
沉淀的生成通常通过一种浑浊的溶液变为清澈的溶液或沉淀的形成来观察。
4. 温度的变化:许多化学反应伴随着热量的吸收或释放,因此反应过程中温度的变化也是反应现象之一。
例如,酸与碱反应时,会伴随着热量的释放。
5. 反应速率的变化:反应物与生成物之间的转化速率不同,因此反应速率的变化也是反应现象之一。
有些反应会迅速进行,产生较大的反应速率,而其他反应则较为缓慢。
二、反应现象的解释反应现象可以通过化学方程式来解释。
化学方程式是描述化学反应的一种方式,它由反应物和生成物的化学式以及反应的物质量之间的关系组成。
化学方程式示例:2H2 + O2 -> 2H2O上述方程式表示了氢气和氧气反应生成水的反应。
反应物的化学式(2H2和O2)表示参与反应的物质,箭头(->)表示反应方向,生成物的化学式(2H2O)表示反应完成后生成的物质。
化学方程式还可以表示反应物和生成物的摩尔比例关系。
上述方程式中,2H2和O2的摩尔比例为1:1,2H2和2H2O的摩尔比例也为1:1。
三、反应现象与化学反应机理的关系反应现象是描述化学反应的结果,而化学反应机理则是描述化学反应过程中发生的具体步骤和反应中间体的生成与消失。
CO222Fe22Al2MgO 22CO2Hg+O 氧气22HCu+H C+2CuO2Cu+CO常见物质的颜色、气味固体红色:红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO红褐色:氢氧化铁Fe(OH)3黄色:金Au、硫S绿色:碱式碳酸铜Cu2(OH)2CO3紫黑色:高锰酸钾晶体KMnO4淡蓝色:固态氧O2蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……)黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO等深灰色:石墨C灰白色:大多数磷肥无色:金刚石C、干冰CO2、冰H2O有刺激性气味的固体:碳酸氢铵NH4HCO3液体淡蓝色:液态氧O2蓝色:含有Cu2+的溶液浅绿色:含有Fe2+的溶液黄色:含有Fe3+的溶液银白色:汞Hg有特殊气味的液体:乙醇C2H5OH有刺激性气味的液体:醋酸CH3COOH气体红棕色气体:二氧化氮NO2有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等除杂除杂的原则:①主要成分的质量不能减少(可以增多);②除杂时不能引进新的杂质。
除去CuO中的C:在氧气流中灼烧(C+O2CO2)。
2(Ca(OH)2+CO2=CaCO3↓+H2O和2NaOH+CO2=Na2CO3+H2O)。
除去CO2中的CO:使混合气体通过灼热的氧化铜(CO+CuO Cu+CO2)。
除去CaO中的CaCO3:高温煅烧(CaCO3CaO+CO2↑)【注意】不能加稀盐酸,因为CaO能与稀盐酸中的水反应生成Ca(OH)2。
除去大理石中的杂质:①高温煅烧大理石或石灰石(CaCO3CaO+CO2↑);②将反应后的固体放入足量的水中,使其充分溶解,过滤(CaO+H2O=Ca(OH)2);③通入过量的二氧化碳(Ca(OH)2+CO2=CaCO3↓+H2O);④过滤。
常见的化学反应及现象综合1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2.镁带在空气中燃烧(化合反应)2Mg + O2 = 2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)2H2O = 2H2↑ + O2↑现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4.生石灰和水反应(化合反应)CaO + H2O = Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。
(4)发出大量的热5.实验室制取氧气①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)2KClO3MnO2催化2KCl + 3O2↑相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4 = K2MnO4 + MnO2 + O2↑相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。
一、火焰的颜色1. 淡蓝色火焰:(1)氢气燃烧(2)硫在空气中燃烧2. 蓝色火焰:(1)一氧化碳燃烧(2)甲烷燃烧3. 明亮的蓝紫色火焰:硫在氧气中燃烧4. 黄色火焰:(1)磷燃烧(2)蜡烛燃烧二、火星四射:铁在氧气中燃烧三、白光1.木炭在氧气中燃烧2.镁燃烧四、白烟1.磷燃烧2.镁带燃烧五、温度变化1.升高:燃烧、生石灰和水、氢前金属和酸、中和反应、浓硫酸和水、氢氧化钠和水2.降低:碳和二氧化碳、硝酸铵和水六、在溶液中产生气体:碳酸盐和酸1.生成CO22.生成O:过氧化氢和二氧化锰2:氢前金属和酸3.生成H2七、产生沉淀1.白色:二氧化碳和石灰水、碳酸钠溶液和氢氧化钙溶液、稀硫酸和氢氧化钡溶液、稀盐酸和硝酸银溶液2.蓝色:氢氧化钠溶液和酸酸铜溶液3.红褐色:氢氧化钠溶液和氯化铁溶液八、变色1.紫色溶液变红:石蕊和酸2.紫色溶液变蓝:石蕊和碱性溶液3.无色溶液变红:酚酞和碱性溶液4.无色溶液变黄:酸除铁锈5.无色溶液变蓝:酸和氧化铜6.蓝色溶液变浅绿:铁丝和硫酸铜溶液7.黑色固体变红:氢气还原氧化铜、一氧化碳还原氧化铜、碳还原氧化铜8.红色固体变黑:氢气还原氧化铁、一氧化碳还原氧化铁、碳还原氧化铁、铜和硝酸银溶液、铜和氧气9.红色固体变银白:铜丝和硝酸银溶液10.银白色固体变红:铁丝和硫酸铜溶液11.银白色固体变黑:铁丝燃烧九、挥发产生白雾:浓盐酸十、有特殊气味:浓盐酸、浓氨水、酒精、汽油、二氧化硫一、火焰的颜色1. 淡蓝色火焰:(1)(2)2. 蓝色火焰:(1)(2)3. 明亮的蓝紫色火焰:4. 黄色火焰:(1)(2)二、火星四射三、白光1.2.四、白烟五、温度变化1.升温:、、、2.降温:、六、在溶液中产生气体:1.生成CO22.生成O:2:3.生成H2七、产生沉淀1.白色:、、、2.蓝色:3.红褐色:八、变色1.紫色溶液变红:2.紫色溶液变蓝:3.无色溶液变红:4.无色溶液变黄:5.无色溶液变蓝:6.蓝色溶液变浅绿:7.黑色固体变红:、、8.红色固体变黑:、、9.红色固体变银白:10.银白色固体变红:11.银白色固体变黑:九、挥发产生白雾十、有特殊气味、、、、。
常见反应的现象CO2SO22P22H2Fe22Al222CuO2222HgOCO22H2H23+CuOC+2CuOCO+CuO描述实验现象时要注意不能说出生成物的名称,但可以根据生成物的化学性质来描述生成物。
常见物质的颜色、气味固体●红色:红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO●红褐色:氢氧化铁Fe(OH)3●黄色:金Au、硫S●绿色:碱式碳酸铜Cu2(OH)2CO3●紫黑色:高锰酸钾晶体KMnO4●淡蓝色:固态氧O2●蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O●银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……)●黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO等●深灰色:石墨C●灰白色:大多数磷肥●无色:金刚石C、干冰CO2、冰H2O●白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。
●有刺激性气味的固体:碳酸氢铵NH4HCO3液体●淡蓝色:液态氧O2●蓝色:含有Cu2+的溶液●浅绿色:含有Fe2+的溶液●黄色:含有Fe3+的溶液●银白色:汞Hg●我们学过的大多数液体都是无色的。
●有特殊气味的液体:乙醇C2H5OH●有刺激性气味的液体:醋酸CH3COOH气体●红棕色气体:二氧化氮NO2●有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等●有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等●我们学过的大多数气体都是无色无味的。
●计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等●能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等多功能瓶下面是多功能瓶的常见用途:一、洗气瓶(图①)多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。
洗气瓶一般用来检验气体(如二氧化碳)、干燥气体(如混有水蒸气的气体)、吸收气体(如二氧化硫)或除去气体中的杂质(如HCl气体等)●检验气体:检验二氧化碳的试剂是澄清的石灰水。
●干燥气体:试剂一般是浓硫酸。
需要注意的是,浓硫酸不能干燥NH3等碱性气体。
●吸收气体或除去气体中的杂质:①对于SO2、CO2等气体,可以使用NaOH溶液吸收(最好不用Ca(OH)2溶液,因为Ca(OH)2微溶于水)②对于混在CO2中的HCl气体,不可以使用NaOH溶液吸收,但可以使用NaHCO3溶液来吸收。
③Cl2可以用NaOH溶液吸收。
二、向上排空气取气瓶(图②)使用条件:收集的气体的密度大于空气密度(组成气体的分子的相对分子质量大于29),并且气体不与空气中的成分反应。
规则:长管进,短管出。
常见实例:O2、CO2、Cl2、NO2利用多功能瓶收集有毒或者有污染气体,可以方便地进行尾气处理,以免气体逸出污染空气。
如Cl2可以用②装置收集,再用①装置进行尾气处理。
三、向下排空气取气瓶使用条件:收集的气体的密度小于空气密度(组成气体的分子的相对分子质量小于29),并且气体不与空气中的成分反应。
规则:短管进,长管出。
常见实例:H2、NH3四、排水集气瓶使用条件:①气体不溶或难溶于水;②气体不与水反应;(③对于部分气体来说,密度与空气密度接近,无法用排空气法收集。
)规则:短管进,长管出。
常见实例:O2、H2、NO五、排水量气瓶使用条件:同“四”规则:短管进,长管出。
如果忽略导管内的水,量筒内水的体积就是进入集气瓶中气体的体积。
除杂●除杂的原则:①主要成分的质量不能减少(可以增多);②除杂时不能引进新的杂质。
●除去CuO中的C:在氧气流中灼烧(C+O2CO2)。
●除去CO中的CO2:使混合气体通过澄清的石灰水或氢氧化钠溶液(Ca(OH)2+CO2=CaCO3↓+H2O和2NaOH+CO2=Na2CO3+H2O)。
●除去CO2中的CO:使混合气体通过灼热的氧化铜(CO+CuO Cu+CO2)。
●除去CaO中的CaCO3:高温煅烧(CaCO3CaO+CO2↑)【注意】不能加稀盐酸,因为CaO能与稀盐酸中的水反应生成Ca(OH)2。
●除去大理石中的杂质:①高温煅烧大理石或石灰石(CaCO3CaO+CO2↑);②将反应后的固体放入足量的水中,使其充分溶解,过滤(CaO+H2O=Ca(OH)2);③通入过量的二氧化碳(Ca(OH)2+CO2=CaCO3↓+H2O);④过滤。
【注意】如果杂质很难用一般方法除去,可以将主要成分从混合物中分离出来,然后通过反应再变回来。
●除去Cu中少量的Fe:物理方法——用磁铁反复吸引。
化学方法——滴加稀盐酸或稀硫酸,然后过滤。
【注意】不能加硫酸铜溶液,否则容易导致除杂不彻底。
●除去FeSO4溶液中的CuSO4:①加入铁粉(铁丝);②过滤。
●除去可溶物中的不溶物:①溶解;②过滤;③蒸发结晶。
●除去不溶物中的可溶物:①溶解;②过滤。
●将两种可溶物分离:见“溶液”单元的冷却热饱和溶液法和蒸发溶剂结晶法。
●在溶液中,杂质有盐的时候,可以考虑把盐变成水、气体沉淀。
鉴定●氧气的鉴定方法:把一根带火星的木条伸入集气瓶中,如果带火星的木条复燃,证明是氧气。
●氢气:点燃,气体会发出淡蓝色火焰。
如果气体较纯,气体将会安静地燃烧,并发出“噗”声;如果气体不纯,会发出尖锐爆鸣声。
●二氧化碳:把气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,就证明收集的气体是CO2。
●三大可燃性气体的鉴定:点燃,通过无水硫酸铜CuSO4,再通过澄清的石灰水(顺序不能颠倒!)H2:生成物能使无水硫酸铜变蓝,但不能使澄清石灰水变浑浊。
CO:生成物不能使无水硫酸铜变蓝,但能使澄清的石灰水变浑浊。
CH4:生成物既能使无水硫酸铜变蓝,又能使澄清石灰水变浑浊。
【注意】不可以根据气体燃烧时的火焰颜色来鉴别气体。
●水的鉴定:如果液体能使无水硫酸铜变蓝,说明液体中含有水。
●碳酸根的鉴定:加盐酸,然后将产生的气体通入澄清石灰水。
如果澄清的石灰水变浑浊,说明有碳酸根离子。
●鉴定CaO是否含CaCO3也加盐酸。
●鉴定Cl-:先加入AgNO3溶液,再加入稀硝酸。
如果有沉淀生成,说明含有Cl-。
●鉴定SO42-:先加入Ba(NO3)2溶液,再加入稀硝酸。
如果有沉淀生成,说明含有SO42-。
●鉴定CO32-:加入稀盐酸,将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有CO32-。
●鉴定HCO3-:同上。
●鉴定Cu2+:加入NaOH溶液,如果有蓝色沉淀,说明含有Cu2+。
●鉴定Fe3+:加入NaOH溶液,如果有红褐色沉淀,说明含有Fe3+。
●鉴定H+:①借助石蕊或pH试纸。
如果石蕊变红或用pH试纸测出的pH值小于7,说明含有H+。
②加入碳酸盐(如CaCO3),将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有H+。
③加入活泼金属,如果金属表面产生气泡,并且产生一种可燃性气体(点燃之后安静燃烧,发出淡蓝色火焰。
如果气体不纯,会发出尖锐的爆鸣声),说明含有H+。
④加入Fe2O3(铁锈),如果铁锈逐渐溶解消失,溶液由无色变成黄色,说明含有H+。
⑤加入弱碱,如果弱碱逐渐溶解消失(如果加入Fe(OH)2、Fe(OH)3、Cu(OH)2,溶液的颜色还会发生变化),说明含有H+。
●鉴定OH-:①借助石蕊、酚酞或pH试纸。
如果石蕊变蓝、酚酞变红或用pH试纸测出的pH值大于7,说明含有OH-。
②加入CuSO4,如果出现蓝色沉淀,说明含有OH-。
③加入Fe2(SO4)3,如果出现红褐色沉淀,说明含有OH-。
④可以参考“碱的通性”中的第四条,使溶液中有气体或沉淀生成。
●鉴定水:通过白色的硫酸铜,如果硫酸铜变蓝,说明有水(CuSO4 + 5H2O = CuSO4·5H2O)如果要鉴定多种物质,必须把鉴定水放在第一步。
如果除水,必须放在最后一步。
●鉴定二氧化碳:通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明气体是CO2。
●鉴定一氧化碳:通过灼热的氧化铜,如果黑色粉末逐渐变成红色,并且产生的气体能使澄清的石灰水变浑浊,说明气体是CO。
●鉴定NH4+:以氯化铵(NH4Cl)为例,方法一NH4Cl + NaOH = NaCl + NH3↑+ H2O;方法二把NH4Cl和Ca(OH)2混在一起研磨。
如果闻到刺激性的氨味,或者能使红色的石蕊试纸变蓝,说明是铵态氮肥。
●蛋白质的鉴定:点燃,如果有烧焦羽毛的气味,就说明有蛋白质。
●鉴别聚乙烯塑料和聚氯烯塑料(聚氯烯塑料袋有毒,不能装食品):点燃后闻气味,有刺激性气味的为聚氯烯塑料。
●鉴别羊毛线和合成纤维线:物理方法:用力拉,易断的为羊毛线,不易断的为合成纤维线;化学方法:点燃,产生焦羽毛气味,不易结球的为羊毛线;无气味,易结球的为合成纤维线。
区分与鉴定的区别在于,鉴定是要确定一种物质,而区分只需把物质分辨开。
区分的要求是无论用什么试剂,采取什么方法,现象必须明显。