常见的化学反应及其现象
- 格式:doc
- 大小:150.50 KB
- 文档页数:9

常见的化学反应及现象综合1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2 + CO2 = CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2.镁带在空气中燃烧(化合反应)2Mg + O2 = 2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)2H2O = 2H2↑ + O2↑现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4.生石灰和水反应(化合反应)CaO + H2O = Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。
(4)发出大量的热5.实验室制取氧气①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)2KClO3MnO2催化2KCl + 3O2↑相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4 = K2MnO4 + MnO2 + O2↑相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。

化学反应一、燃烧反应1、镁条燃烧:+O2点燃2MgO2Mg现象:剧烈燃烧,发出耀眼白光,放出大量的热。
2、铜丝的燃烧:+O22Cu2CuO点燃现象: 红色金属变成黑色固体,放热。
3、铁丝的燃烧:3Fe+2O2Fe3O4点燃现象:剧烈燃烧、火星四射、生成黑色固体、放热。
4、碳的燃烧:C O2+点燃CO2现象:剧烈燃烧、发出白光、放热、生成使石灰水变浑浊的气体。
5、硫的燃烧:S+O2SO2点燃现象:剧烈燃烧、放热、有刺激味气体生成。
6、氢气的燃烧:O2+2H2O2H2点燃现象:空气中呈淡蓝色火焰,氧气中呈蓝紫色火焰,放热,生成使无水CuSO4变蓝的液体(水)7、红磷的燃烧:4P+5O22P2O5点燃现象:剧烈燃烧、大量白烟、放热、生成白色固体。
8、2Mg++CO2点燃2MgO C(特殊的燃烧反应)二、制气体1、制O 2 :加热MnO 22KClO 32KCl +3O22KMnO 4加热K 2MnO 4+MnO 2+O 2(实验室制O 2)H 2O 2H 2O +O 2MnO22H 2O 通电2H 2+O22、制CO 2CaCO 32HCl +CaCl 2++H 2O CO2(实验室制CO 2) 泡沫灭火器的原理:2HCl +++H 2O CO2Na 2CO 32NaCl石灰水变浑浊:Ca(OH)2++CO 2CaCO 3H 2O三、常见的分解反应1、碳酸的分解:H 2CO 3加热H 2O +CO22、碱式碳酸铜的分解:Cu 2(OH)2CO 3加热2CuO+H 2O+CO 2↑ 现象:绿色固体变成黑色、试管壁有液体、有使石灰水变浑浊的气体产生。
3、碳酸氢铵的分解:NH4HCO3加热NH3↑+ H2O +CO2↑现象:白色固体消失、管壁有液体、有使石灰水变浑浊的气体产生,有刺鼻的臭味。
4、碳酸氢钙的分解(石头的风化):Ca(HCO3)2加热CaCO3↓+H2O+CO2↑现象:白色沉淀生成、产生使澄清石灰水变浑浊的气体。
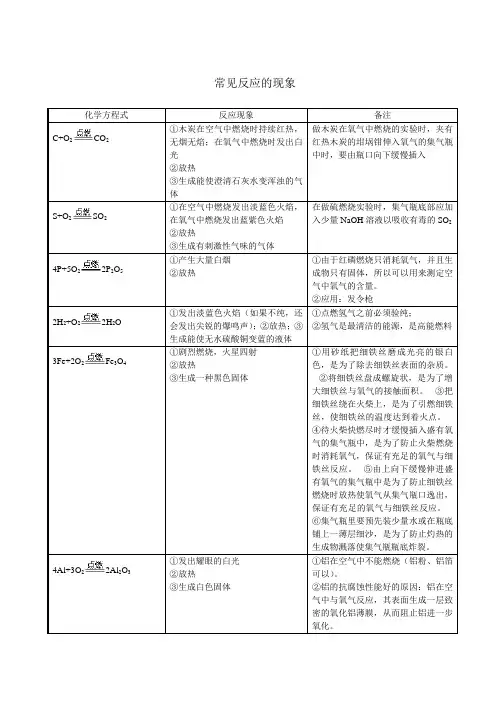
常见反应的现象化学方程式反应现象备注C+O2CO2①木炭在空气中燃烧时持续红热,无烟无焰;在氧气中燃烧时发出白光②放热③生成能使澄清石灰水变浑浊的气体做木炭在氧气中燃烧的实验时,夹有红热木炭的坩埚钳伸入氧气的集气瓶中时,要由瓶口向下缓慢插入S+O2SO2①在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰②放热③生成有刺激性气味的气体在做硫燃烧实验时,集气瓶底部应加入少量NaOH溶液以吸收有毒的SO24P+5O22P2O5①产生大量白烟②放热①由于红磷燃烧只消耗氧气,并且生成物只有固体,所以可以用来测定空气中氧气的含量。
②应用:发令枪2H2+O22H2O ①发出淡蓝色火焰(如果不纯,还会发出尖锐的爆鸣声);②放热;③生成能使无水硫酸铜变蓝的液体①点燃氢气之前必须验纯;②氢气是最清洁的能源,是高能燃料3Fe+2O2Fe3O4①剧烈燃烧,火星四射②放热③生成一种黑色固体①用砂纸把细铁丝磨成光亮的银白色,是为了除去细铁丝表面的杂质。
②将细铁丝盘成螺旋状,是为了增大细铁丝与氧气的接触面积。
③把细铁丝绕在火柴上,是为了引燃细铁丝,使细铁丝的温度达到着火点。
④待火柴快燃尽时才缓慢插入盛有氧气的集气瓶中,是为了防止火柴燃烧时消耗氧气,保证有充足的氧气与细铁丝反应。
⑤由上向下缓慢伸进盛有氧气的集气瓶中是为了防止细铁丝燃烧时放热使氧气从集气瓶口逸出,保证有充足的氧气与细铁丝反应。
⑥集气瓶里要预先装少量水或在瓶底铺上一薄层细沙,是为了防止灼热的生成物溅落使集气瓶瓶底炸裂。
4Al+3O22Al2O3①发出耀眼的白光②放热③生成白色固体①铝在空气中不能燃烧(铝粉、铝箔可以)。
②铝的抗腐蚀性能好的原因:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
2Mg+O22MgO ①发出耀眼的白光②放热③生成白色固体①点燃前要先用砂纸除去镁条表面的氧化膜②应用:信号弹2Cu+O22CuO红色固体逐渐变成黑色可用来除去混合气体中的氧气2Hg+O22HgO银白色液体逐渐变成红色固体拉瓦锡实验中反应之一2CO+O22CO2①发出蓝色火焰②放热③生成能使澄清石灰水变浑浊的气体①CO有毒!②点燃前要验纯③应用:煤气2HgO2Hg+O2↑红色固体逐渐变成银白色液体,并生成能使带火星的木条复燃的气体拉瓦锡实验中反应之一石蜡+氧气二氧化碳+水①火焰发出白光;②放热;③生成能使澄清石灰水变浑浊的气体;④生成能使无水硫酸铜变蓝的液体CH4+2O2CO2+2H2O ①发出明亮的蓝色火焰;②放热;③生成能使澄清石灰水变浑浊的气体;④生成能使无水硫酸铜变蓝的液体①点燃前要验纯②应用:天然气Ca(OH)2+CO2=CaCO3↓+H2O 澄清的石灰水变浑浊应用:检验二氧化碳、吸收少量二氧化碳2H2O2H2↑+O2↑①通电后,电极上有气泡产生。

初中常见的化学方程式一、化合反应(反应物可以有多个,生成物一定只有一个的为化合反应)1、红(白)磷在空气中燃烧:4P + 5O2点燃2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4、硫粉在空气中燃烧:S + O2点燃SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
6、碳在氧气中充分燃烧:C + O2点燃CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊7、氢气中空气中燃烧:2H2 + O2点燃2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
8、镁在空气中燃烧:2Mg + O2点燃2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末9、铜在空气中受热:2Cu + O2△2CuO现象:铜丝变黑。
10、铝在空气中燃烧:4Al + 3O2点燃2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
11、碳在氧气中不充分燃烧:2C + O2点燃2CO12、二氧化碳通过灼热碳层:C + CO2高温2CO(是吸热的反应)13、一氧化碳在氧气中燃烧:2CO + O2点燃2CO2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
14、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3SO3 + H2O === H2SO415、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH氧化钾溶于水:K2O + H2O=2KOH氧化钡溶于水:BaO + H2O ==== Ba(OH)216、钠在氯气中燃烧:2Na + Cl点燃2NaCl17、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O二、分解反应:(反应物有且只能有一个,生成物可以有多个)17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑现象:(1)电极上有气泡产生。

1 镁在空气中燃烧发出耀眼白光放出大量热生成白色固体2 铁丝在氧气中燃烧铁丝剧烈燃烧火星四射放出大量热生成黑色固体3 氢气在空气中燃烧发出蓝色火焰放热(生成无色液体→这要在火焰上方罩一个干冷的烧杯,不然看不到这个现象)4 红磷在空气中燃烧生成大量白烟放出大量热5 硫粉在空气中燃烧发出淡蓝色火焰放热生成有刺激性气味气体6 硫粉在氧气中燃烧发出明亮的蓝紫色火焰放热生成有刺激性气味气体7 生石灰溶于水(发生化学反应)固体消失,放出大量的热8 无水硫酸铜遇水白色固体变蓝9 碳和二氧化碳反应黑色固体消失,生成一种可以点燃的无色气体10 过氧化氢制氧气(催化剂:MnO2)冒气泡放热11 高锰酸钾制氧气紫红色固体变为黑色固体减少吸热12 铁和硫酸铜溶液铁表面生成红色固体溶液由蓝色变为浅绿色13 锌/镁和稀硫酸固体溶解无色气泡放热14 氢气还原氧化铜黑色固体变红管口有无色液体生成放热15 木炭还原氧化铜固体由黑变红固体减少放热16 氢氧化钠与硫酸铜生成蓝色沉淀溶液由蓝色变为五色放热复分解反应都放热17 二氧化碳和澄清石灰水石灰水变浑浊继续通入变澄清18 石灰石与稀盐酸固体溶解冒气泡放热19 稀盐酸与镁(氢前金属)反应固体逐渐消失,冒出气泡总结1,燃烧反应一般是放热2,加热反应一般是吸热3,高温反应一般是吸热,例如高温煅烧石灰石(CaCO3 ==高温== CaO +CO2 )物质溶于水的温度变化:溶于水放热的浓硫酸氢氧化固体碱性氧化物吸热的铵盐初中只要记硝酸铵就好了物质溶于水时容器内压强的变化;1,二氧化碳溶于水时,压强变小2,氨气溶于水时,压强变小初三只记住这两种气体就行,归纳:气体溶于水时,压强变小1,浓硫酸溶于水时,放出大量热,装置内压强变大(原因:放热温度升高,气体膨胀,压强变大2,氢氧化钠溶于水,同上归纳:物质溶于水时放热,则装置内的压强变大。


常见化学反应及化学方程式
以下是常见的化学反应及其相应的化学方程式
碳在氧气中充分燃烧:C + O2点燃CO2。
现象:生成能够让澄清石灰水浑浊的气体。
碳在氧气中不充分燃烧:2C + O2点燃2CO。
现象:生成可燃烧气体。
酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2+ 3H2O。
加热氯酸钾:2KClO3MnO22KCl + 3O2↑。
现象:同上。
过氧化氢分解:H2O2MnO22H2O + O2↑。
现象:溶液里冒出大量的气泡。
电解水:2H2O通电2H2↑+ O2↑。
生石灰溶于水:CaO + H2O = Ca(OH)2。
现象:放出大量的热。
二氧化碳可溶于水:H2O + CO2= H2CO3。
氢气还原氧化铜:H2+ CuO△Cu + H2O。
现象:由黑色的固体变成红色的,同时有水珠生成。
氢气还原氧化铁:2Fe2O3+ 3H2高温2Fe + 3H2O。
现象:有水珠生成,固体颜色由红色变成银白色。

日常生活中的化学现象50个1. 燃烧燃烧是一种常见的化学反应,如燃烧木材、燃烧煤炭等。
2. 酸碱反应当酸和碱混合时,会产生化学反应,如酸中和碱生成盐和水。
3. 腐败生物体或食物长时间暴露在空气中,会发生腐败的化学变化。
4. 发酵发酵是一种常见的化学过程,如发酵面包、发酵酒精等。
5. 电解电解是一种将化学物质分解为更简单的物质的过程,常见于电池、电解槽等。
6. 霉变食物长时间存放会发霉,这是由于霉菌的生长引起的化学现象。
7. 氧化许多物质在与氧气接触时会发生氧化反应,如生锈、土豆暴露在空气中变黑等。
8. 染色染色是一种化学反应,如衣物染色、头发染色等。
9. 水的溶解水是一种优秀的溶剂,可以溶解许多物质,如盐、糖等。
10. 气体的扩散气体在空气中会扩散,如香水在房间里弥漫、气球漏气等。
11. 金属的腐蚀金属长时间暴露在潮湿环境中会发生腐蚀,如铁生锈。
12. 食物烹饪食物在烹饪过程中会发生化学变化,如高温烹饪、化学反应产生新的风味。
13. 呼吸作用我们的身体在呼吸过程中会进行氧气和二氧化碳的交换。
14. 植物光合作用光合作用是植物通过阳光合成有机物质的化学过程。
15. 发光现象发光现象在日常生活中很常见,如蓝色火焰、荧光笔等。
16. 发热现象许多化学反应会产生热能,如发光二极管、燃烧等。
17. 饮食消化食物在消化过程中会发生化学反应,如胃液分解食物。
18. 原子核衰变放射性元素的原子核会发生衰变反应,释放出辐射能量。
19. 洗衣洗衣过程中使用的洗衣粉或洗涤剂会与污渍发生化学反应,使衣物清洁。
20. 漂白漂白是除去物体表面污渍的化学过程,如漂白剂可以除去衣物上的污渍。
21. 化妆化妆品中的成分会与皮肤发生化学反应,改变肤色、遮盖缺陷等。
22. 香味释放香水、香料等会通过与空气中的分子发生化学反应,释放出香味。
23. 腐蚀性分解某些化学物质具有腐蚀性,可以分解其他物质,如酸腐蚀金属。
24. 燃料燃烧燃料在氧气的存在下燃烧,产生热能,如汽车燃油的燃烧。

化学实验中的常见反应现象与观察方法化学实验是学习化学知识和理论的重要环节,在实验过程中,我们常常会遇到各种各样的反应现象。
观察并理解这些反应现象不仅可以帮助我们加深对化学理论的理解,还能提高我们实验操作的技巧和实验分析的能力。
本文将介绍一些常见的化学实验中的反应现象及观察方法。
1. 气体生成反应气体生成反应是常见的实验现象之一。
在实验室中,常用酸与碱反应或碳酸盐与酸反应进行气体的制备。
气体生成反应的观察方法可以通过气泡的产生、气体体积的增加以及气体颜色的变化等来判断。
例如,当盛有稀盐酸的试管与加入碱溶液的试管相接触时,可以观察到气泡的产生,并且可以通过通入通明的饱和石灰水来检验生成的气体是否为二氧化碳。
2. 沉淀生成反应沉淀生成反应在实验室中也非常常见,常常用于确定物质之间的化学反应。
观察沉淀反应主要通过观察是否有沉淀物的生成,以及沉淀物的颜色和形态等来判断反应是否发生。
例如,在铁离子溶液与硫酸盐溶液反应的实验中,可以观察到产生黑色的沉淀物,这是一种典型的沉淀生成反应。
3. 颜色变化反应一些化学实验中的反应会伴随着颜色的变化,这种观察方法可以帮助我们判断反应的进行和反应物的消耗程度。
例如,在电解铜(II)硫酸溶液的实验中,铜离子的颜色会逐渐变浅并最终消失,而同时在电极上会生成铜金属。
这种颜色变化反应不仅可以帮助我们验证电解反应的进行,还能帮助我们判断电解质的浓度变化。
4. 温度变化反应某些化学反应伴随着温度的变化,观察反应的温度变化可以帮助我们判断反应是放热反应还是吸热反应。
在实验中,可以使用温度计来测量反应液体的温度变化,或者直接用手触摸容器的表面来判断温度的变化。
例如,溶解氨气的实验中可以观察到容器表面的降温,这是因为溶解氨气是一个吸热反应。
5. 发光反应某些物质或化合物在受到特定激发条件下会发出光,这种现象被称为化学发光。
观察化学发光反应通常需要保持实验室的暗环境,并在适当的条件下使反应发生。

1. 镁带燃烧 ↑+2O 2M g 2M g O 点燃 现象:剧烈燃烧,发出耀眼白光,生成白色粉末.放热.2. 铜绿受热分解 ↑++22322CO O H 2CuO ΔCO (OH)Cu 现象:绿色粉末变黑,试管壁出现小水珠,产生气体使澄清石灰水变混浊.放热.3. 木炭燃烧 22CO O C 点燃+(氧气充足) 2CO O 2C 点燃2+(氧气不足) 现象:空气中,红光;氧气中,白光;生成气体使澄清石灰水变混浊.放热.4. 硫燃烧 22SO O S 点燃+ 现象:空气中微弱的淡蓝色火焰,氧气中,明亮的蓝紫色火焰,有刺激性气味气体生成.放热.5. 磷燃烧 522O 2P 5O 4P 点燃+ 现象:产生白烟,放热.6. 铁丝在氧气中燃烧 432O Fe 2O 3Fe 点燃+ 现象:剧烈燃烧,火星四射,生成黑色固体.放热.7. 实验室制氧气↑+2233O 2KCl ΔMnO 2KCL0 ↑++22424O MnO MnO K Δ2KMnO 8. 通电分解水 ↑↑+222O H O 2H 2通电 现象:①正氧负氢 ②V 正:V 负=1:29. 实验室制氢气 ↑++2442H Z n S O SO H Zn10. 锌和盐酸 ↑++22H Z n C l 2HC l Zn11. 铁和盐酸 / 硫酸 ↑++22H F e C l 2HC l Fe ↑++2442H FeSO SO H Fe现象:铁片上有气泡,铁片逐渐减少,溶液由无色变为浅绿色.12. 镁和盐酸 / 硫酸 ↑++22H M g C l 2HC l Mg ↑++2442H MgSO SO H Mg13. 氢气在空气中燃烧 O H O 2H 2222点燃+ 现象:淡蓝色火焰,放热,罩在火焰上方的烧杯壁上出现小水珠.14. 氢气还原氧化铜 O H Cu ΔCuO H 22++ 现象:黑色粉末变红,试管壁出现小水珠.15. 氢氧化钠和硫酸铜反应 ↓++2424C u (O H)SO Na CuSO 2NaOH 现象:生成蓝色沉淀16. 氧化汞受热分解 ↑+2O 2Hg Δ2HgO17. 木炭还原氧化铜 ↑++2CO Cu 2CuOC 2高温 现象:黑色粉末变红,产生气体使澄清石灰水变混浊.18..一氧化碳燃烧222CO O 2CO 点燃+现象:产生蓝色火焰,放热, 产生气体使澄清石灰水变混浊.19. 一氧化碳还原氧化铜 2CO Cu ΔCuOCO ++ 现象: 黑色粉末变红,产生气体能使澄清石灰水变混浊.20. 一氧化碳还原氧化铁(工业炼铁) 2323CO 2Fe O Fe 3CO 高温++ 21. 二氧化碳欲灼热的炭反应 2C O CO C 高温2+22. 二氧化碳通入紫色石蕊试液中 3222CO H O H CO + 现象:紫色石蕊试液变红23. 碳酸分解 O H CO CO H 2232+↑24. 二氧化碳通入澄清石灰水中O H CaCO Ca(OH)CO 2322+↓+ 现象:澄清石灰水变混浊.25. 煅烧石灰石 ↑+23CO CaO CaCO 高温26. 生石灰制熟石灰 22Ca (OH)O H Ca O =+27. 实验室制二氧化碳 ↑+++2223CO O H CaCl 2HCl CaCO28. 灭火器原理 ↑+++2232CO O H 2NaCl 2HCl CO Na29. 甲烷燃烧 O 2H CO 2O CH 2224点燃++ 现象:产生蓝色火焰,放出热量.30. 酒精燃烧 O 3H 2CO 3O OH H C 22252点燃++31. 甲醇燃烧 O 4H 2CO 3O OH 2CH 2223点燃++ 32. 曾青得铁则化为铜 Cu FeSO CuSO Fe 44++ 现象:铁表面有红色物质析出,溶液由蓝色变为浅绿色.33. 一氧化碳还原四氧化三铁 2434CO 3Fe 4CO O Fe 高温++34. 盐酸除铁锈 O 3H 2FeCl 6HCl O Fe 2332+=+ 现象:铁锈消失,形成黄色溶液.35. 盐酸跟氧化铜反应 O H Cu Cl Cu O 2HCl 22+=+ 现象:黑色粉末溶解,形成蓝色溶液.36. 盐酸跟氢氧化钠 O H Na Cl Na OHHCl 2+=+ 无明显现象 37. 盐酸跟氢氧化铜 O H 2CuCl Cu(OH)2HCl 222+=+ 现象:蓝色固体溶解,形成蓝色溶液38. 盐酸跟硝酸银溶液 33HNO AgCl AgNO HCl +↓=+ 现象:生成白色沉淀,沉淀不溶于稀硝酸.39. 硫酸除铁锈 O 3H )(SO Fe SO 3H O Fe 23424232+=+ 现象:铁锈消失,形成黄色溶液.40. 硫酸跟氧化铜 O H Cu S O Cu O SO H 2442+=+ 现象:黑色粉末溶解,形成蓝色溶液.41. 硫酸跟氢氧化钠 O 2H SO Na 2NaOH SO H 24242+=+ 无明显现象42. 硫酸跟氢氧化铜O 2H CuSO Cu(OH)SO H 24242+=+现象:蓝色固体溶解,形成蓝色溶液43. 硫酸跟氯化钡溶液 2HCl BaSO BaCl SO H 4242+↓=+ 现象:生成白色沉淀,沉淀不溶于稀硝酸.44. 硝酸跟氧化锌 O H )Z n (NO Z n O 2HNO 2233+=+45. 硝酸跟氧化铁 O 3H )2Fe(NO O Fe 6HNO 233323+=+46. 硝酸跟氧化钙 O H )Ca (NO Ca O 2HNO 2233+=+47. 硝酸跟氢氧化镁 O 2H )Mg(NO Mg(OH)2HNO 22323+=+ 现象:白色固体溶解48. 硝酸跟碳酸钡 ↑++=+22333CO O H BaCO BaCO HNO49. 氢氧化钠溶液跟二氧化碳 O H CO Na CO 2NaOH 2322+=+50. 氢氧化钠溶液跟二氧化硫 O H SO Na SO 2NaOH 2322+=+ (Na 2SO 3为亚硫酸钠)51. 氢氧化钠溶液跟三氧化硫 O H SO Na SO 2NaOH 2423+=+52. 氢氧化钠溶液跟氯化铁溶液3NaCl Fe(OH)FeCl 3NaOH 33+↓=+现象:生成红褐色沉淀53. 氢氧化钠溶液跟氯化铜溶液2NaCl Cu(OH)CuCl 2NaOH 22+↓=+现象:生成蓝色沉淀54. 氢氧化钙溶液跟碳酸钠溶液(工业制氢氧化钠) ↓+=+3322CaCO 2NaOH CO Na Ca(OH) 现象:生成白色沉淀55. 氢氧化铁跟硫酸溶液 O 6H )(SO Fe 2Fe(OH)SO 3H 2342342+=+ 现象:红褐色固体溶解,溶液由无色变成黄色.56. 碳酸钠晶体风化 O 10H CO Na O 10H CO Na 232232+=⋅57. 胆矾受热分解 O 5H CuSO ΔO 5H CuSO 2424+⋅。

初中化学常见化学方程式及反应现象与氧有关的反应:条件点燃2Mg+O2 点燃====2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2点燃====2SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
C+O2 点燃====CO2 现象:生成能够让纯净的石灰水浑浊的气体2C+O2 点燃====2CO 现象:燃烧现象外,其他现象不明显4P+5O2 点燃====2P2O5 现象::生成白烟3Fe+2O2点燃====Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体2H2+O2 点燃====2H2O 现象:淡蓝色的火焰2H2O2 MnO2====2H2O+O2↑现象:溶液里冒出大量的气泡2HgO 2Hg+O2↑现象:生成银白色的液体金属2KClO3 MnO2====2KCl+3O2↑现象:生成能让带火星的木条复燃的气体条件点燃和催化剂。
2KMnO4△====K2MnO4+MnO2+O2↑现象:同上,加热跟氢有关的反应:2H2+O2 点燃====2H2O 现象:淡蓝色的火焰Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成Mg+H2SO4==MgSO4+H2↑现象:同上Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+H2SO4 ==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成△H2+CuO====Cu+H2O 现象:由黑色的固体变成红色的,同时有水珠生成高温2Fe2O3+3H2 =====2Fe+3H2O 现象:有水珠生成,固体颜色由红色变成银白色碳及碳的化合物相关反应:C+O2CO2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体2C+O22CO(氧气不充足的情况下) 现象:不明显C+2CuO=====(高温)2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成3C+2Fe2O3=====(高温)4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的气体生成CO2+C2CO 现象:黑色固体逐渐减少3C+2H2O=CH4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体C+ Fe CO2 现象:生成能使纯净的石灰水变浑浊的气体Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca(HCO3)2 现象:白色固体逐渐溶解Ca(HCO3)CaCO3↓+CO2↑+H2O 现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成Cu2(OH)2CO32CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO2===Na2CO3+H2O(也可为KOH)现象:不明显CaCO3CaO+CO2↑现象:有能使纯净石灰水变浑浊的气体生成跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe3O4+4CO====(高温)3Fe+4CO2 现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成FeO+CO===(高温)Fe+CO2现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成Fe2O3+3CO====(高温)2Fe+3CO2 现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成CuO+CO====(高温)Cu+CO2 现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成酸碱盐之间的反应NaOH(也可为KOH)+HCl==NaCl+H2O 现象:不明显HCl+AgNO3==AgCl↓+HNO3 现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体Fe2O3+6HCl==2FeCl3+3H2O 现象:红色固体逐渐溶解,形成黄色的溶液Fe(OH)3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液CuO+2HCl==CuCl2+H2O 现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成2NaOH(或KOH)+H2SO4==Na2SO4+2H2O 现象:不明显Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液H2SO4+BaCl2==BaSO4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O 现象:酸碱中和反应,现象不明显CaO+H2O==Ca(OH)2现象:放出大量的热NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+NaCl 现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl 现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl 现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了NH4Cl(NH4NO3、(NH4)2SO4)+NaOH(KOH)==NH3↑+H2O+NaCl 现象:有可以使石蕊试纸变蓝的气体生成MgCl2(Mg(NO3)2、MgSO4)+NaOH(KOH)==Mg(OH)2↓+NaCl 现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了NaHCO3+NaOH==Na2CO3+H2O 现象:不明显此反应的Na换成K是一样的Ca(HCO3)2+2NaOH==CaCO3↓+Na2CO3+2H2O 现象:生成白色沉淀,此反应把Na换成K是一样的。
初中化学方程式大全及现象
以下是一些初中化学中常见的化学反应方程式及其现象:
1. 镁在氧气中燃烧:2Mg + O2点燃2MgO,现象是发出耀眼的白光,放
出大量的热,同时生成白色固体。
2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4,现象是剧烈燃烧,火星四射,生成黑色的固体。
3. 铜在氧气中受热:2Cu + O2加热2CuO,现象是铜表面逐渐变黑。
4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O3。
5. 氢气在氧气中燃烧:2H2+ O2点燃2H2O,现象是淡蓝色的火焰。
6. 红磷在空气中燃烧:4P + 5O2点燃2P2O5,现象是生成白烟。
7. 硫粉在氧气中燃烧:S + O2点燃SO2,现象是空气中是淡蓝色的火焰,纯氧中是蓝紫色的火焰,同时生成有刺激性气味的气体。
8. 碳在氧气中充分燃烧:C + O2点燃CO2,现象是生成能够让纯净的石灰水浑浊的气体。
9. 碳在氧气中不充分燃烧:2C + O2点燃2CO,现象是燃烧现象外,其他
现象不明显。
以上化学反应方程式及其现象仅供参考,请注意安全,如需了解更多初中化学反应方程式及其现象,建议查阅初中化学教材或咨询专业化学教师。
九年级化学1-2章常见化学反应现象、表达式1、碳酸氢铵(化学式NH 4HCO 3)受热分解现象:白色固体逐渐减少,生成有刺激性气味的气体。
文字表达式: 符号表达式 :NH 4HCO 3NH 3 + CO 2 + H 2O2、铜绿 (碱式碳酸铜)加热实验现象:绿色粉末变成黑色,试管口出现小水滴产生。
文字表达式:3、碱式碳酸铜(俗称铜绿)与盐酸反应现象:绿色粉末溶解,溶液由无色变成蓝色溶液,并产生大量气泡。
文字表达式:4、木炭(黑色固体)在氧气中燃烧实验现象:发出白光,放出热量。
反应文字表达式:碳+氧气二氧化碳 符号表达式: C + O 2CO 2 5、蜡烛在氧气中燃烧实验现象:燃烧剧烈,发出白光,放出热量,集气瓶内壁出现水珠。
反应文字表达式:石蜡+氧气 二氧化碳 + 水6、铁丝(银白色固体)在氧气中燃烧实验现象:剧烈燃烧,火星四射,放出热量,生成一种黑色固体。
文字表达式:铁+氧气四氧化三铁 符号表达式: Fe +O 2 Fe 3O 47、镁带(银白色固体)在空气中燃烧实验现象:发出耀眼的白光,放出热量,生成白色粉末状固体。
反应文字表达式:镁+氧气氧化镁 符号表达式: Mg + O 2 MgO8、红磷(暗红色固体)在空气中的燃烧实验现象:剧烈燃烧,放出热量,生成大量白烟反应文字表达式:磷+氧气五氧化二磷 符号表达式: P + O 2P 2O 59、加热高锰酸钾制取氧气 文字表达式:+ 二氧化锰 +氧气符号表达式:KMnO 44+MnO 2 + O 210、双氧水(过氧化氢溶液)在二氧化锰作用下制取氧气。
反应文字表达式: 水+氧气符号表达式: H 2O 2O + O 211反应文字表达式:氯酸钾 氯化钾+氧气符号表达式:KClO 3 KCl + O 212、二氧化碳与水反应反应文字表达式: 二氧化碳+水碳酸 符号表达式:CO 2 + H 2OH 2CO 3 13、碳酸受热分解反应文字表达式: 碳酸二氧化碳+水 符号表达式: H 2CO 3 CO 2 + H 2O14、实验室里常用稀盐酸与大理石反应来制取少量二氧化碳气体。
常见的化学反应及现象综合1.澄清石灰水中通入二氧化碳气体(复分解反应)Ca(OH)2+CO2=CaCOj+H2O现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
2.镁带在空气中燃烧(化合反应)2Mg+O2=2MgO现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)2H2O=2HJ+Oj现象:通电后,电极上出现气泡,气体体积比约为1:2相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电4.生石灰和水反应(化合反应)CaO+H2O=Ca(OH)2现象:白色粉末溶解相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。
(4)发出大量的热5.实验室制取氧气①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)2KClO3N/ThC?倘仍,2KCl+3OJ相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)2KMnO4=K2MnO4+MnO2+Oj相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。
③过氧化氢和二氧化锰制氧气(分解反应)2H2O2…倘仍2H2O+OJ共同知识点:(1)向上排空气法收集时导管要伸到集气瓶下方,收集好后要正放在桌面上;(2)实验结束要先撤导管,后撤酒精灯,避免水槽中水倒流炸裂试管;(3)加热时试管要略向下倾斜,避免冷凝水回流炸裂试管;(4)用排水集气法收集氧气要等到气泡连续均匀地冒出再收集;(5)用带火星的小木条放在瓶口验满,伸入瓶中检验是否是氧气。
4.特征反应(中学)5.置换反应的类型6.分步氧化的几种情况O2O2⑴⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⑵铵盐:O H NH NH 234+↑−→−+碱8.化合价变化变价元素结合氧化还原反应是推断题的命题角度之一,常考到的元素有:Cl、S、N、C、Fe等。
9.物质组成的特殊配比能形成原子个数比为2:1或1:1的特殊化合物有:Na2O、Na2O2类,H2O、H2O2类,CaC2、C2H4、C2H2、C6H6类。
10.物质间的一些特殊转化关系物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外,还要了解一些特殊的转化关系,例如:二、常见的突破口:抓住题目的突破口,是解决无机推断题的关键。
题目中的突破口可能是显性的,也可能是隐性的。
显性的突破口通常是指物质特殊的物理、化学性质、用途以及一些特征的反应现象;而隐性的突破口则往往是一些特殊的反应类型或者物质之间的转化关系。
2、物质状态液态单质:Br2、Hg;液态化合物:H2O、H2O2、H2SO4、HNO3等;气态单质:H2、N2、O2、F2、Cl2等;气态化合物:氧化物:CO CO2 NO NO2 SO2氢化物:C2H2 NH3 H2S HX(并从特殊颜色﹑气味﹑相互反应等方面总结)3、反应现象或化学性质(1)焰色反应:黄色-Na;紫色(钴玻璃)-K。
(2)与燃烧有关的现象:火焰颜色:苍白色:H2在Cl2中燃烧; (淡)蓝色:H2、CH4、CO 等在空气中燃烧;黄色:Na在Cl2或空气中燃烧;烟、雾现象:棕(黄)色的烟:Cu或Fe在Cl2中燃烧;白烟:Na在Cl2或P在空气中燃烧;白雾:有HX等极易溶于水的气体产生;白色烟雾:P在Cl2中燃烧。
(3)沉淀特殊的颜色变化:白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3;白色沉淀迅速变棕褐色:AgOH→Ag2O。
常见化学反应类型及主要反应现象一、化合反应1.红、白磷在空气中燃烧,放热,产生大量的白烟,生成白色固体:4P+5O 22P2O52.木炭黑色固体燃烧:C+O 2CO2;氧气充分时的反应现象:①木炭在空气中燃烧时持续红热,无烟无焰;在氧气中燃烧时发出白光;②放热;③生成能使澄清石灰水变浑浊的无色气体;3.木炭黑色固体燃烧:2C+O 22CO;氧气不充分时的反应现象:①木炭在空气中燃烧时持续红热,无烟无焰;②放热;③生成一种无色、有毒气体;4.硫在空气氧气中燃烧:S+O 2SO2;反应现象:①在空气中燃烧发出微弱的淡蓝色火焰,在氧气中燃烧发出明亮的蓝紫色火焰;②放热;③生成有刺激性气味的无色气体;5.铁丝在氧气中燃烧:3Fe+2O 2Fe3O4;反应现象:①剧烈燃烧,火星四射;②放热;③生成一种黑色固体;6.铝在氧气中燃烧:4Al+3O 22Al2O37.铝不易生锈的原因:4Al+3O2=2Al2O38.镁在空气中燃烧:2Mg+O 22MgO;反应现象:①发出耀眼的强白光;②放热;③生成白色固体;9.铜在空气中加热:2Cu+O 22CuO;反应现象:红色固体逐渐变成黑色固体;10.氢气在氧气中燃烧:2H2+O 22H2O;反应现象:①发出淡蓝色火焰如果不纯,还会发出尖锐的爆鸣声;②放热;③生成能使无水硫酸铜变蓝的液体;11.将CO2变成CO:C+CO 22CO;12.二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3;反应现象:生成的酸性物质能使紫色石蕊试液变红色;13.用生石灰制取熟石灰:CaO+H2O=CaOH2反应现象:白色块状固体变成白色粉末状固体,同时放出大量的热;14.一氧化碳燃烧:2CO+O 22CO2 ;反应现象:①发出蓝色火焰如果不纯,还会发出爆鸣声;②放热;③生成能使澄清石灰水变浑浊的无色气体;15.向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:CaCO3+CO2+H2O=CaHCO3216.氢气在氯气中燃烧:H2+Cl 22HCl17.钠在氯气中燃烧:2Na+Cl 22NaCl18.镁在氮气中燃烧:3Mg+N 2Mg3N2注意氮元素的化合价19.上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与;二、分解反应1.汞在空气中加热:2Hg+O 22HgO;反应现象:银白色液体变成红色粉末;2.氧化汞加强热:2HgO2Hg+O2↑;反应现象:红色粉末变成银白色液体,生成的无色气体能使带火星的木条复燃;3.①分解过氧化氢制取氧气实验室制取氧气的反应原理之一:2H2O 22H2O+O2↑;反应现象:产生大量的气泡,生成的无色气体能使带火星的木条复燃;②加热高锰酸钾制取氧气实验室制取氧气的反应原理之二:2KMnO 4K2MnO4+MnO2+O2↑;反应现象:紫黑色色固体质量减少,生成的无色气体能使带火星的木条复燃;③加热氯酸钾制取氧气实验室制取氧气的反应原理之三:2KClO 32KCl+3O2↑;反应现象:白色固体质量减少,生成的无色气体能使带火星的木条复燃;上面三种制取氧气的方法中给我们的启示是:分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种;4.电解水生成氢气和氧气:2H2O2H2↑+O2↑反应现象:①通电后,电极上有气泡产生;通电一段时间后,两个试管内汇集了一些气体,与正、负极相连的试管内的气体体积比约为1:2,质量比约为8:1;②与正极相连的试管内的气体可以使带火星的木条复燃;与负极相连的试管内的气体移近火焰时,气体能够燃烧,火焰呈淡蓝色;5.工业制取生石灰和CO2的反应原理:CaCO 3CaO+CO2↑;反应现象:白色固体质量减少,同时生成白色固体和能使澄清石灰水变浑浊的无色气体;6.干粉灭火器的反应原理碳酸氢钠受热分解:2NaHCO 3Na2CO3+H2O+CO2↑;反应现象:白色固体质量减少,同时生成白色固体和能使澄清石灰水变浑浊的无色气体;7.碱式碳酸铜受热分解:Cu2OH2CO 32CuO+H2O+CO2↑;反应现象:绿色固体质量减少,同时生成黑色固体和能使澄清石灰水变浑浊的无色气体;8.过氧化氢溶液不稳定,发生分解:2H2O 22H2O+O2↑9.碳酸不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2↑10.碳铵碳酸氢铵“消失”并发出刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O三、置换反应1.氢气还原氧化铜:H2+CuO Cu+H2O;反应现象:黑色固体变成红色固体,同时有水珠产生;2.木炭还原氧化铜:C+2CuO2Cu+CO2↑;反应现象:黑色固体变成红色固体,同时生成能使澄清石灰水变浑浊的无色气体;3.木炭还原氧化铁:3C+2Fe2O 34Fe+3CO2↑反应现象:红色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;4.水煤气的形成:C+H2O H2+CO注意没有气体生成符号↑5.实验室制取氢气的反应原理:Zn+H2SO4=ZnSO4+H2↑;反应现象:锌粒表面有大量气泡产生,生成的气体能够燃烧,火焰呈淡蓝色;四、复分解反应1.实验室制取CO2的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;反应现象:大理石或石灰石的表面有大量气泡产生,生成的无色气体能使澄清石灰水变浑浊;2.盐酸与水垢中的主要成分发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑;反应现象:水垢的表面有大量气泡产生,生成的无色气体能使澄清石灰水变浑浊;3.实验室不用大理石和稀硫酸制取CO2的原因:CaCO3+H2SO4=CaSO4+H2O+CO2↑;反应现象:大理石或石灰石的表面先有大量气泡产生,然后逐渐减少,最后反应停止,是因为反应中生成的微溶于水的物质覆盖在大理石或石灰石的表面,阻止了反应的进行,但反应开始时生成的无色气体能使澄清石灰水变浑浊;4.泡沫灭火器的反应原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑;反应现象:碳酸钠迅速溶解,瞬间产生大量的无色气体,该无色气体能使澄清石灰水变浑浊;五、非基本类型1.一氧化碳还原氧化铜检验一氧化碳的反应原理:CO+CuO Cu+CO2反应现象:黑色固体变成红色固体,同时生成能使澄清石灰水变浑浊的无色气体;2.一氧化碳还原氧化铁用赤铁矿炼铁、高炉炼铁的反应原理:3CO+Fe2O 32Fe+3CO2反应现象:红色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;3.一氧化碳还原氧化亚铁:i.CO+FeO Fe+CO2ii.反应现象:黑色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;4.一氧化碳还原四氧化三铁用磁铁矿炼铁:4CO+Fe3O 43Fe+4CO2;反应现象:黑色固体变成能被磁铁吸引的黑色固体,同时生成能使澄清石灰水变浑浊的无色气体;5.黑火药点燃爆炸:S+2KNO3+3C K2S+N2↑+3CO2↑6.甲烷燃烧:CH4+2O 2CO2+2H2O7.乙醇燃烧:C2H5OH+3O 22CO2+3H2O8.二氧化碳使澄清的石灰水变浑浊CaOH2固体变质的原因:CaOH2+CO2=CaCO3↓+H2O9.用NaOH溶液吸收CO2NaOH固体变质的原因:2NaOH+CO2=Na2CO3+H2O10.用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O11.NaOH溶液与SO3反应:2NaOH+SO3=Na2SO4+H2O12.葡萄糖的缓慢氧化:C6H12O6+6O 26CO2+6H2O常见物质的颜色、气味固体1.红色:红磷P、铜Cu、氧化铁Fe2O32.黄色:金Au、硫S3.紫黑色:高锰酸钾晶体KMnO44.淡蓝色:固态氧O25.黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO6.深灰色:石墨C7.无色:金刚石C、干冰CO2、冰H2O8.白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的;9.有刺激性气味的固体:碳酸氢铵NH4HCO3 ;液体1.淡蓝色:液态氧O22.蓝色:含有Cu2+的溶液3.浅绿色:含有Fe2+的溶液4.黄色:含有Fe3+的溶液5.银白色:汞Hg6.我们学过的大多数液体都是无色的;7.有特殊气味的液体:乙醇C2H5OH8.有刺激性气味的液体:醋酸CH3COOH气体1.红棕色气体:二氧化氮NO2 ;2.有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等;3.有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等;4.我们学过的大多数气体都是无色无味的;5.计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧O3等;6.能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等;。