三组分系统氯化钠-硫酸钠-水的溶解度图
- 格式:doc
- 大小:58.50 KB
- 文档页数:3

第三章 三元水盐体系
3-1标绘NaCl-Na 2SO 4-H 2O 体系50℃等温图,注明各区域的意义。
NaCl-Na 2SO 4-H 2O 体系50℃数据
3-2用相图确定下列系统(总重量均为1000公斤)在50℃的状态,并计算固、液相重量。
(1)M ,含NaCl30.5%,Na 2SO 410.0%
,H 2O59.5%; (2)N ,含NaCl9.5%,Na 2SO 430.0%,H 2O60.5%; (3)P ,含NaCl48.0%,H 2O52.0%。
3-3试分析含NaCl 10%,Na 2SO 415%,H 2O75%的系统50℃等温蒸发过程。
3-4根据上图填空:固相 的溶解度随温度升高而加大,固相
的溶解度随温度升高而减小。
系统M 在60℃时状态为 ,冷却至40℃时有 析出,继续冷却至20℃时会有 析出。
3-5有含KCl 5%,K 2SO 45%,H 2O90%的体系在25℃等温蒸发,如果体系重100公斤,试计算:
(1) K 2SO 4 单独析出量最大时的蒸发水量,K 2SO 4析出量及析出率; (2) 蒸发水量为60公斤时K 2SO 4析出量及析出率;
(3) K
2SO
4
析出率为85%时的蒸发水量。

硫酸钠和氯化钠的溶解度曲线概述说明以及解释1. 引言1.1 概述本文主要研究硫酸钠和氯化钠的溶解度曲线,并对其进行概述、说明和解释。
溶解度是指在一定温度下,某种物质在特定溶剂中能够溶解的最大量。
硫酸钠和氯化钠作为常见的无机盐,在工业生产和日常生活中都具有重要应用。
1.2 文章结构本文共分为五个部分,具体结构如下:引言:介绍文章的研究背景、目的和结构。
硫酸钠的溶解度曲线:对硫酸钠的溶解度曲线进行定义、背景知识介绍,并且详细描述实验方法和结果。
最后对结果进行解释和讨论。
氯化钠的溶解度曲线:对氯化钠的溶解度曲线进行定义、背景知识介绍,并且详细描述实验方法和结果。
最后对结果进行解释和讨论。
对比分析与讨论:比较硫酸钠和氯化钠的溶解度曲线特点,分析影响溶解度的因素,并展望其应用场景与发展趋势。
结论与展望:总结分析结果及重要发现,提出未来研究方向,并分析本研究的局限性及改进措施。
1.3 目的通过对硫酸钠和氯化钠的溶解度曲线进行研究,我们旨在深入了解这两种物质在不同条件下的溶解度规律以及影响因素。
通过实验方法和结果的描述,我们将给出对溶解度曲线进行合理解释和讨论的依据。
同时,通过比较分析两种物质的溶解度曲线特点以及影响因素,我们将探讨其应用场景,并展望未来关于溶解度研究领域的发展趋势。
以上就是文章引言部分内容,接下来将会详细介绍硫酸钠和氯化钠的溶解度曲线、实验方法和结果、解释和讨论等内容。
2. 硫酸钠的溶解度曲线2.1 定义和背景知识硫酸钠是一种常见的无机盐,化学式为Na2SO4。
它可以以固体形式存在,也可以通过在水中溶解得到溶液。
溶解度曲线描述了在不同温度下硫酸钠在水中的溶解度变化规律。
溶解度是指单位溶剂中能够溶解的物质的质量或摩尔数。
通常用于描述离子晶体(如硫酸钠)在水中的溶解情况。
对于硫酸钠而言,其溶解过程可以表示为以下方程式:Na2SO4(s) ↔Na+(aq) + SO42-(aq)此方程式表明,在水中加入固态硫酸钠后,它会与水分子发生反应并分离成正离子Na+和负离子SO42-。


2-1 三元水盐系溶解度测定(设计性实验)第一部分设计性实验教学大纲实验课程名称:专业实验(化学工程与工艺)实验项目名称:三元水盐系溶解度测定实验类型:设计性实验实验类别:基础□专业基础□实验学时:4-6一、实验目的1、自行设计实验方案、实验步骤,学习三元水盐体系液固相平衡数据的测定方法。
2、通过绘制NaCl-NH4Cl-H2O三元体系等温相图,学会相图的绘制与应用;3、复习液固相平衡知识,训练恒温、取样、称量、分析等基本操作技术。
二、预习与参考1、陈钟秀、顾飞燕、胡望明编,化工热力学(第二版),北京:化学工业出版社,2001年2、牛自得、程芳琴主编,水盐体系相图及其应用,天津:天津大学出版社,2002年。
3、青岛科技大学化工实验中心编,化学工程与工艺专业实验,2003年4、杭州大学化学系分析化学教研室编,分析化学手册(第二版)第二分册,北京:化学工业出版社,1997年三、设计指标以二元系统的溶解度数据为基础,在所设定的温度下,设计NaCl-NH4Cl-H2O三元水盐体系合理的原始构成和实验步骤,进行实验,获得实验温度下的液固平衡数据,通过分析、计算,用所得数据绘制出NaCl-NH4Cl-H2O三元体系等温相图。
四、实验要求(设计要求)自行设计实验方案和原始数据,包括流程、实验步骤,分析方法等,达到实验目的。
五、实验(设计)仪器设备和材料清单水浴恒温震荡装置,酸、碱滴定装置,玻璃仪器;电子天平,分析天平,氯化钠,氯化铵,氢氧化钠、硝酸银标准溶液,甲醛溶液,蒸馏水,指示剂。
六、调试及结果测试原始数据和实验方案经指导教师审核后,自行调试。
利用提供的玻璃仪器和试剂自行分析。
七、实验报告要求要求有实验目的、实验原理、实验方案和步骤、实验数据记录,对实验数据进行处理,计算液固亮相的组成,绘制出相图,并对所得的实验结果进行讨论(包括方案的合理性、误差分析、成败原因等)。
八、思考题1、本实验条件下的结果与标准值有何差异,为什么?2、取样操作不当,会产生那些可能情况?第二部分三元水盐系溶解度测定(参考)一、实验目的水盐系是自然界(海水、盐湖)和无机化工生产中(肥料、碱、盐)常见的反应体系。

S olubility摘要:氯化钠在水、盐酸、硫酸、氯化钙溶液、氯化镁溶液、硫酸钠溶液等无机溶剂中溶解度,相图。
氯化钠在甲醇、乙醇、丙醇、丁醇、吡啶、乙二醇、DMF、DMSO、THF等溶剂中的溶解度。
目录
1氯化钠在水中的溶解度 (1)
2氯化钠在盐酸中溶解度 (3)
3氯化钠在硫酸中的溶解度 (4)
4氯化钠与氯化钙在水中的互溶度,相图 (4)
5氯化钠与氯化镁在水中的互溶度,相图 (5)
6氯化钠与氯化镁在水中的互溶度,相图 (6)
7氯化钠在其它无机溶剂中的溶解度 (10)
8氯化钠在甲醇中的溶解度 (11)
9氯化钠在乙醇及乙醇溶液中的溶解度 (11)
10氯化钠在其它有机溶剂中的溶解度 (12)
1氯化钠在水中的溶解度
2氯化钠在盐酸中溶解度
3氯化钠在硫酸中溶解度
4氯化钠与氯化钙在水中的互溶度(相图)
5氯化钠在氯化镁溶液中的溶解度(相图)
6氯化钠与硫酸钠溶液的互溶度(相图)
7氯化钠在重水及其它无机溶剂中溶解度
8氯化钠在甲醇中的溶解度
9氯化钠在乙醇溶液中的溶解度
10氯化钠在其它有机无机溶剂中的溶解度。


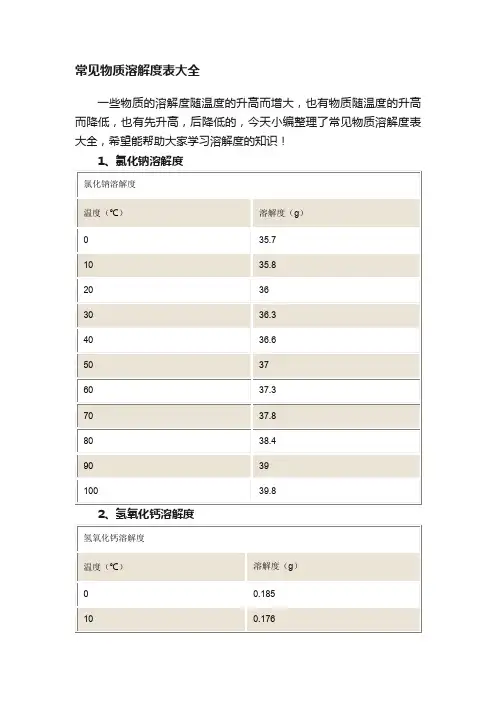
常见物质溶解度表大全
一些物质的溶解度随温度的升高而增大,也有物质随温度的升高而降低,也有先升高,后降低的,今天小编整理了常见物质溶解度表大全,希望能帮助大家学习溶解度的知识!
1、氯化钠溶解度
2、氢氧化钙溶解度
3、硫酸钠溶解度
4、碳酸钠溶解度
5、碳酸氢钠溶解度
6、氯化钙溶解度
7、硫酸钙溶解度
8、氯化钾溶解度
9、硫酸铵溶解度
10、氯化铵溶解度
12、硫酸铜溶解度
13、氢氧化钾溶解度
以上就是我们常见以及常考到的一些物质的溶解度了,通过溶解度表,大家可以更加直观地判断物质的溶解度随温度升高而发生的变化。
![三组分系统氯化钠-硫酸钠-水的溶解度图[参照材料]](https://uimg.taocdn.com/2b0230030912a216147929a6.webp)
三组分系统氯化钠-硫酸钠-水的溶解度图表1为氯化钠(A)-硫酸钠(B)-水(C)三组分系统在50℃时的溶解度数据,将数据描绘在等边三角形的坐标图上,则得到图1。
表1 氯化钠(A)-硫酸钠(B)-水(C)在50℃时的溶解度液相组成固相氯化钠(A)硫酸钠(B)水(C)26.8 0 73.2 氯化钠25.0 3.7 71.3 氯化钠24.2 5.3 70.5 氯化钠+硫酸钠20.0 7.65 72.35 硫酸钠15.0 12.1 72.9 硫酸钠10.0 18.1 71.9 硫酸钠5.0 24.7 70.3 硫酸钠0 31.8 68.2 硫酸钠H 2O(C)NaCl(A)Na 2SO 4(B)901000102030405060708090100Na 2SO 4/%图1 氯化钠(A )-硫酸钠(B )-水(C )系统50℃溶解度图图中CbEc 区为氯化钠、硫酸钠在水中的不饱和溶液。
在该区内任意一个系统点,相数Ф=1,温度、压力已固定,故f’=C -Ф+0=3-1+0=2,即在该相区内两种盐的组成均可在一定范围内独立改变而不致引起相态及相数的变化。
c 点表示氯化钠在水中的溶解度(CA 边上无硫酸钠),cE 线是水中溶有氯化钠后,硫酸钠在其中的溶解度曲线;同理,bE 线为氯化钠的溶解度曲线,在该线上f’=C -Ф+0=3-2+0=1。
这表明,在对氯化钠饱和的溶液中(cE ),若确定氯化钠和硫酸钠两者中的一个组成,则另一个组成将随之而有定值,对于硫酸钠饱和的溶液(bE )亦可如此理解。
E点叫共饱点,即l(E)对氯化钠及硫酸钠都是饱和的。
bEB区是硫酸钠结晶区,设系统点p落在这一区域内,则平衡时分成两相,一相为固体硫酸钠,另一相为对硫酸钠饱和的硫酸钠及氯化钠的水溶液。
B(纯硫酸钠)和p的连结线与硫酸钠溶解度曲线bE的交点q表示与硫酸钠平衡的饱和溶液的组成。
按杠杆规则,s(B)的质量/溶液(q)的质量=qp/pB。


三元水盐系溶解度测定(参考)一、实验目的水盐系是自然界(海水、盐湖)和无机化工生产中(肥料、碱、盐)常见的反应体系。
在无机盐生产中常常要将可溶性盐或原料溶解在水溶液中,或者需要将某种盐从水溶液种结晶出来。
在发生溶解、结晶、混合、蒸发、冷却、分离等水盐体系的相变化过程时,首先需要了解盐类的溶解度关系。
将水盐体系平衡状态下的溶解度实验数据标绘在坐标纸上而得到的图即为相图。
它不仅能给出盐类的溶解或结晶顺序、名称和组成,还能进行物料量的计算,并能对工艺过程及其操作条件乃至反应器的设计提供基本要求。
无机化工生产中最常用的是三元水盐体系,因此设置本实验,提出如下要求:(1)学习三元水盐体系液固相平衡数据的测定方法。
(2)自行设计实验方案,绘制出NaCl-NH4Cl-H2O三元体系等温相图,学会相图的绘制与应用;(3)复习液固相平衡知识,训练恒温、取样、称量、分析等基本操作技术。
二、实验原理与方法根据NaCl、NH4Cl在水中溶解度的不同,配制不同重量组成的一系列样品溶液,在恒温下搅拌一定时间后,对各饱和溶液进行分析,用所得数据在坐标纸上绘出一系列点。
同时,测定与饱和溶液相平衡的固相组成,以所得数据在图上绘出的点与相应的饱和溶液点相连即得相应的直线。
连接各饱和溶液即为该温度下的NaCl、NH4Cl溶解度曲线。
三元水盐体系溶解度与相图实验测定有湿固相法、合成复合体法和物理化学分析法,本实验采用湿固相法。
湿固相法以连线规则为基础,当液固相达平衡后,分别取出饱和溶液和含饱和溶液的湿固相加以分析,所得的点可连成几条不同的直线,它们的交点就是这些饱和溶液所平衡的固相点。
如果交点正好落在代表一种盐的顶点,则为该盐的无水盐点;如果交点刚好落在两直线角边上,则固相点为水合物;如果交点落在直角三角形的斜边上,则固相为无水复盐;交点落在三角形内任一点,固相均为水合复盐。
另外,如果有两条或两条以上的相邻连线都从液相的同一点出发,则这液相点为两盐的共饱和点。
三组分系统氯化钠-硫酸钠-水的溶解度图表1为氯化钠(A)-硫酸钠(B)-水(C)三组分系统在50℃时的溶解度数据,将数据描绘在等边三角形的坐标图上,则得到图1。
表1 氯化钠(A)-硫酸钠(B)-水(C)在50℃时的溶解度液相组成固相氯化钠(A)硫酸钠(B)水(C)26.8 0 73.2 氯化钠25.0 3.7 71.3 氯化钠24.2 5.3 70.5 氯化钠+硫酸钠20.0 7.65 72.35 硫酸钠15.0 12.1 72.9 硫酸钠10.0 18.1 71.9 硫酸钠5.0 24.7 70.3 硫酸钠0 31.8 68.2 硫酸钠H 2O(C)NaCl(A)Na 2SO 4(B)901000102030405060708090100Na 2SO 4/%图1 氯化钠(A )-硫酸钠(B )-水(C )系统50℃溶解度图图中CbEc 区为氯化钠、硫酸钠在水中的不饱和溶液。
在该区内任意一个系统点,相数Ф=1,温度、压力已固定,故f’=C -Ф+0=3-1+0=2,即在该相区内两种盐的组成均可在一定范围内独立改变而不致引起相态及相数的变化。
c 点表示氯化钠在水中的溶解度(CA 边上无硫酸钠),cE 线是水中溶有氯化钠后,硫酸钠在其中的溶解度曲线;同理,bE 线为氯化钠的溶解度曲线,在该线上f’=C -Ф+0=3-2+0=1。
这表明,在对氯化钠饱和的溶液中(cE ),若确定氯化钠和硫酸钠两者中的一个组成,则另一个组成将随之而有定值,对于硫酸钠饱和的溶液(bE )亦可如此理解。
E 点叫共饱点,即l (E )对氯化钠及硫酸钠都是饱和的。
bEB区是硫酸钠结晶区,设系统点p落在这一区域内,则平衡时分成两相,一相为固体硫酸钠,另一相为对硫酸钠饱和的硫酸钠及氯化钠的水溶液。
B(纯硫酸钠)和p的连结线与硫酸钠溶解度曲线bE的交点q表示与硫酸钠平衡的饱和溶液的组成。
按杠杆规则,s(B)的质量/溶液(q)的质量=qp/pB。
氟化钠溶解度氟化钠:溶解度 32.65kg/mol ,溶于水,微溶于醇,水溶液呈碱性,它是一种具有广泛用途 的氟盐。
(1 )氟化钠溶解度: 温度(°C ) 15 18 21 25 100%- 溶解度(%)3.854.224.004.034.11(2)根据化学化工物性数据手册(无机卷) 溶解度见该手册P445。
(3 )百度百科氟化訥’无色发矗馳或白色粉末,比重2 2岳=・潛干水(蜃解度 1ITC 企66、20a C 4.06, 30D C 4.22^ 40e C 4A. 60°0 4 68. 80°C 4 B9^ 10 0s C5 08).氢氟鹼徴融于醇-水溶橄呈卿性,沼于氢氟餵而戚氟化氢钠,能腐 蚀玻璃.有羞! 氟化钠如何生成氟化氢:(仅供参考)HF+NaOH-——>NaF+H 2O这个方程式中的NaOH 是用来处理废水中超标的HF,生成NaF 溶液,然后沉淀或 浓缩得到NaF 脚料(包含着其他杂质),NaF 产生过程是这样吗?如果脚料中NaF 的含量高,可以回收利用,脚料经过初步处理(过滤等),加入 浓盐酸,反应生成HF 溶液反应方程式:NaF (s )+HCl (aq )=HF (aq )+NaCl (aq )。
注意盐酸浓度不可太过,同时 防止HF 挥发到空气中。
氟化钠:1、温度低,溶解度小,或者放入大于溶解度的氟化钠,溶液处于过饱和状 态,但又处于不会析出晶体的某种状态.2、有可能部分氟化纳与水起反应,因为氟化物是容易水解的:2NaF+2H 2O=2NaOH+F 2 T +HT 有微小的气泡放出,这样就看到水中是乳白色的氟化钠会部分水解生成 HF 和NaOH 。
温度(C ) 溶解度(g/100g 水)H 2O 2以及在NaOH 的1020 30 40 50 60 80 100 3.53 3.85 4.174.20 4.40 4.554.68 4.895.08P443,氟化钠在水中的溶解度情况如下:另外,氯化钠在NH 3和S02中的溶解度、在有机溶剂中的溶解度、在NaOH的溶解度25摄氏度时饱和溶液浓度可达26.4mol/LNaCl的溶解度30 C时硫酸钙溶解度0.264g,折合成相同温度下为2600mg/L,其中钙为764mg/L、硫酸根为1835mg/L。
硫酸钠在水中溶解度表硫酸钠,化学式为Na2SO4,是一种常用的无机盐。
它在水中的溶解度会受到一系列因素的影响,如温度、压力、离子强度等。
因此,了解硫酸钠在水中的溶解度表对于化学实验和工业生产有着重要的意义。
步骤一、了解硫酸钠的基本性质首先,我们需要了解硫酸钠这种化合物的基本性质。
硫酸钠是一种白色晶体,常温下是无水物。
它可以在水中溶解,但在乙醇、乙醚等有机溶剂中却不溶。
在水中溶解度取决于温度、离子强度及其他因素。
步骤二、查找硫酸钠在水中的溶解度表在确定硫酸钠基本性质之后,我们需要查找硫酸钠在水中的溶解度表。
可以在化学实验书籍、化学杂志、化学专业网站等地方寻找相关数据。
以国际纯化学品编码(CAS)或化学名称作为标识符可以帮助我们准确地找到该化合物的相关数据。
根据所得数据,我们可以总结出硫酸钠在不同温度下的溶解度。
以下是常见温度下硫酸钠的溶解度表:- 0℃:42.44g/100mL- 10℃:43.60g/100mL- 20℃:45.40g/100mL- 30℃:47.14g/100mL- 40℃:49.07g/100mL- 50℃:50.91g/100mL- 60℃:53.18g/100mL- 70℃:55.55g/100mL- 80℃:57.94g/100mL- 90℃:60.40g/100mL- 100℃:63.01g/100mL步骤三、分析硫酸钠在不同温度下的溶解度硫酸钠在水中的溶解度随温度的变化呈现出一定的规律性。
随着温度升高,硫酸钠在水中的溶解度也会逐渐增加。
这是因为随着温度升高,分子运动加剧,分子间距离缩短,离子间的作用力减弱,从而使离子更容易从晶体中脱离,溶解进入溶液中。
在一定温度范围内,随着温度升高,硫酸钠在水中的溶解度增加的速度会逐渐变缓。
此外,硫酸钠在水中的溶解度还受到其他因素的影响,如离子强度、压力、pH值等。
步骤四、应用硫酸钠在水中的溶解度表硫酸钠在水中的溶解度表是化学实验和工业生产过程中必不可少的参考资料。
三组分系统氯化钠-硫酸钠-水的溶解度图表1为氯化钠(A)-硫酸钠(B)-水(C)三组分系统在50℃时的溶解度数据,将数据描绘在等边三角形的坐标图上,则得到图1。
表1 氯化钠(A)-硫酸钠(B)-水(C)在50℃时的溶解度液相组成固相氯化钠(A)硫酸钠(B)水(C)26.8073.2氯化钠25.0 3.771.3氯化钠24.2 5.370.5氯化钠+硫酸钠20.07.6572.35硫酸钠15.012.172.9硫酸钠10.018.171.9硫酸钠5.024.770.3硫酸钠031.868.2硫酸钠H 2O(C)NaCl(A)Na 2SO 4(B)901000102030405060708090100Na 2SO 4/%图1 氯化钠(A )-硫酸钠(B )-水(C )系统50℃溶解度图图中CbEc 区为氯化钠、硫酸钠在水中的不饱和溶液。
在该区内任意一个系统点,相数Ф=1,温度、压力已固定,故f’=C -Ф+0=3-1+0=2,即在该相区内两种盐的组成均可在一定范围内独立改变而不致引起相态及相数的变化。
c 点表示氯化钠在水中的溶解度(CA 边上无硫酸钠),cE 线是水中溶有氯化钠后,硫酸钠在其中的溶解度曲线;同理,bE 线为氯化钠的溶解度曲线,在该线上f’=C -Ф+0=3-2+0=1。
这表明,在对氯化钠饱和的溶液中(cE ),若确定氯化钠和硫酸钠两者中的一个组成,则另一个组成将随之而有定值,对于硫酸钠饱和的溶液(bE )亦可如此理解。
E点叫共饱点,即l(E)对氯化钠及硫酸钠都是饱和的。
bEB区是硫酸钠结晶区,设系统点p落在这一区域内,则平衡时分成两相,一相为固体硫酸钠,另一相为对硫酸钠饱和的硫酸钠及氯化钠的水溶液。
B(纯硫酸钠)和p的连结线与硫酸钠溶解度曲线bE的交点q表示与硫酸钠平衡的饱和溶液的组成。
按杠杆规则,s(B)的质量/溶液(q)的质量=qp/pB。
同理,cEA是氯化钠结晶区。
位于EAB区域中的系统点是由氯化钠晶体、氯化钾晶体和共饱和溶液l(E)所组成,因而是三相平衡区。
三组分系统氯化钠-硫酸钠-水的溶解度图表1为氯化钠(A)-硫酸钠(B)-水(C)三组分系统在50℃时的溶解度数据,将数据描绘在等边三角形的坐标图上,则得到图1。
表1 氯化钠(A)-硫酸钠(B)-水(C)在50℃时的溶解度
液相组成固相氯化钠(A)硫酸钠(B)水(C)
0氯化钠
氯化钠
氯化钠+硫酸钠
硫酸钠
硫酸钠
硫酸钠
硫酸钠0硫酸钠
H 2
O(C)
NaCl(A)
Na 2
SO 4
(B)
90
1000
10
20
3040
50
6070
8090
100
Na 2
SO 4
/%
图1 氯化钠(A )-硫酸钠(B )-水(C )系统50℃溶解度图
图中CbEc 区为氯化钠、硫酸钠在水中的不饱和溶液。
在该区内任意一个系统点,相数Ф=1,温度、压力已固定,故f’=C -Ф+0=3-1+0=2,即在该相区内两种盐的组成均可在一定范围内独立改变而不致引起相态及相数的变化。
c 点表示氯化钠在水中的溶解度(CA 边上无硫酸钠),cE 线是水中溶有氯化钠后,硫酸钠在其中的溶解度曲线;同理,bE 线为氯化钠的溶解度曲线,在该线上f’=C -Ф+0=3-2+0=1。
这表明,在对氯化钠饱和的溶液中(cE ),若确定氯化钠和硫酸钠两者中的一个组成,则另一个组成将随之而有定值,对于硫酸钠饱和的溶液(bE )亦可如此理解。
E点叫共饱点,即l(E)对氯化钠及硫酸钠都是饱和的。
bEB区是硫酸钠结晶区,设系统点p落在这一区域内,则平衡时分成两相,一相为固体硫酸钠,另一相为对硫酸钠饱和的硫酸钠及氯化钠的水溶液。
B(纯硫酸钠)和p 的连结线与硫酸钠溶解度曲线bE的交点q表示与硫酸钠平衡的饱和溶液的组成。
按杠杆规则,s(B)的质量/溶液(q)的质量=qp/pB。
同理,cEA是氯化钠结晶区。
位于EAB区域中的系统点是由氯化钠晶体、氯化钾晶体和共饱和溶液l(E)所组成,因而是三相平衡区。
由相率,f’=C-Ф+0=3-3+0=0,即在一定温度和压力下,每个相的组成都是固定的。